化学反应速率与化学平衡高考题汇编
- 格式:doc
- 大小:1.11 MB
- 文档页数:10
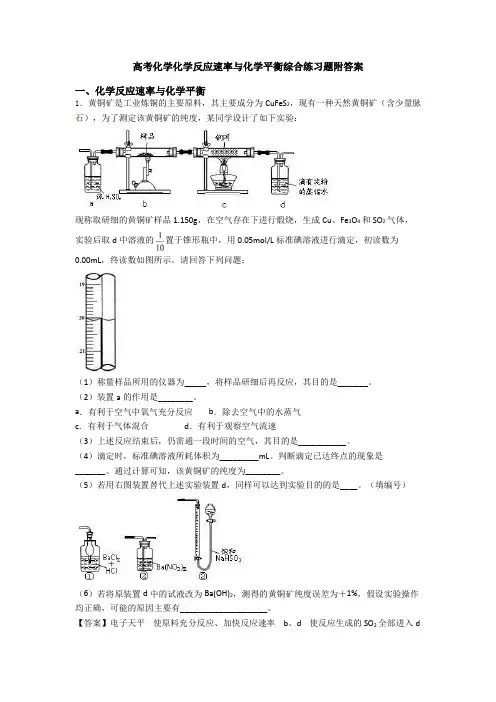
高考化学化学反应速率与化学平衡综合练习题附答案一、化学反应速率与化学平衡1.黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量脉石),为了测定该黄铜矿的纯度,某同学设计了如下实验:现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,初读数为0.00mL,终读数如图所示。
请回答下列问题:(1)称量样品所用的仪器为_____,将样品研细后再反应,其目的是_______。
(2)装置a的作用是________。
a.有利于空气中氧气充分反应 b.除去空气中的水蒸气c.有利于气体混合 d.有利于观察空气流速(3)上述反应结束后,仍需通一段时间的空气,其目的是___________。
(4)滴定时,标准碘溶液所耗体积为_________mL。
判断滴定已达终点的现象是_______。
通过计算可知,该黄铜矿的纯度为________。
(5)若用右图装置替代上述实验装置d,同样可以达到实验目的的是____。
(填编号)(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有____________________。
【答案】电子天平使原料充分反应、加快反应速率 b、d 使反应生成的SO2全部进入d装置中,使结果精确 20.10mL 溶液恰好由无色变成浅蓝色,且半分钟内不褪色 80.4% ②空气中的CO2与Ba(OH)2反应生成BaCO3沉淀;BaSO3被氧化成BaSO4【解析】【分析】(1)根据称量黄铜矿样品1.150g,选择精确度较高的仪器;将样品研细,增大了接触面积;(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;(3)反应产生的二氧化硫应该尽可能的被d装置吸收;(4)根据滴定管的读数方法读出消耗碘溶液的体积,根据反应结束时的颜色变化判断滴定终点;先找出黄铜矿和二氧化硫及碘单质的关系式CuFeS2~2SO2~2I2,再根据题中数据进行计算;(5)图2中的②中通入二氧化硫,反应生成了硫酸钡沉淀,可以根据硫酸钡的质量计算二氧化硫的量;(6)Ba(OH)2溶液能吸收空气的CO2,另外BaSO3易被空气中氧气氧化,这些原因均能引起测定误差。

考点6 化学反应速率和化学平衡一、选择题1.(2011·全国卷I ·8)在容积可变的密闭容器中,2mol 2N 和8mol 2H 在一定条件下反应,达到平衡时,2H 的转化率为25%,则平衡时氨气的体积分数接近于( )A 。
5%B 。
10% C.15% D.20% 【答案】选C 。
2.(2011·四川高考·13)可逆反应错误!X(g)+2Y(g)2Z (g )、错误!2M(g)N (g )+P(g )分别在密闭容器的两个反应室中进行,反应室之间有无摩擦、可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示: 下列判断正确的是:( ) A 。
反应错误!的正反应是吸热反应B.达平衡(I )时体系的压强与反应开始时体系的压强之比为14:15C 。
达平衡(I )时,X 的转化率为115D 。
在平衡(I )和平衡(II)中,M 的体积分数相等 【答案】选C.3。
(2011·重庆高考·7)下列叙述正确的是( ) A 。
Fe 分别与氯气和稀盐酸反应所得氯化物相同B.K 、Zn 分别与不足量的稀硫酸反应所得溶液均呈中性 C 。
Li 、Na 、K 的原子半径和密度随原子序数的增加而增大 D 。
C 、P 、S 、Cl 的最高价氧化物对应水化物的酸性逐渐增强 【答案】选D 。
4.(2011·重庆高考·10)一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( )【答案】选A 。
5.(2011·江苏高考·10)下列图示与对应的叙述相符的是A.图5表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化B.图6表示0.100 0 mol•L —1NaOH 溶液滴定20。
00mL0。
100 0 mol•L —1CH 3COOH 溶液所得到的滴定曲线 C 。
图7表示KNO 3的溶解度曲线,图中a 点所示的溶液是80 ℃时KNO 3的不饱和溶液 D 。

第6讲化学反应速率和化学平衡(时间:45分钟分值:100分)一、选择题(共7个小题,每小题6分,共42分)1.(2013·泰安高三质检)在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是()。
A.反应可表示为3X+Y2ZB.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大D.升高温度,平衡常数一定增大解析从反应开始到0.4 s时,X、Y、Z的物质的量浓度变化量分别为0.3 mol·L-1、0.1 mol·L-1、0.2 mol·L-1,则其化学计量数之比为3∶1∶2,A正确。
从反应开始到0.4 s时,以Y表示的化学反应速率为0.1 mol·L-10.4 s=0.25 mol·L-1·s-1,B正确。
增大压强,正逆反应速率均增大,但增大的倍数不同,C正确;由于不知道反应是吸热还是放热,故升高温度,平衡常数可能增大也可能减小,D不正确。
答案 D2.(2013·济南市高三质检)对于可逆反应:4NH 3(g)+5O2(g)4NO(g)+6H2O(g),下列叙述正确的是()。
A.反应达到平衡时,若两种反应物的转化率相等,则起始投入的n(NH3)∶n(O2)=4∶5 B.反应达到平衡时,对体系充入稀有气体并加压,平衡总是向逆反应方向移动C.反应达到平衡时,若向压强固定的密闭容器中充入稀有气体,平衡不移动D.当v正(NH3)∶v正(NO)=1∶1时,说明该化学反应已经达到平衡解析NH3和O2的转化量之比等于其化学计量数之比,若二者的起始投料之比等于其化学计量数之比,则它们的转化率相等。
答案 A3.利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH 3)2Ac+CO+NH3[Cu(NH3)3]Ac·CO。

高中化学《化学反应速率与化学平衡》练习题(附答案解析)学校:___________姓名:___________班级:___________一、单选题1.对于在恒容密闭容器中进行的反应()()()()22C s +H O g CO g +H g ,下列说法错误的是 ( )A .其他条件不变,充入少量He ,则反应速率增大B .若()()2正逆v CO =v H O ,则反应达到平衡状态C .其他条件不变,增加C(s)的质量,反应速率不变D .若混合气体的质量不再改变,则反应达到平衡状态 2.下列反应中,熵减小的是( ) A .2HI (g)=H 2 (g)+I 2 (g)B .NH 4NO 3爆炸:2NH 4NO 3 (s)=2N 2 (g)+4H 2O (g)+O 2 (g)C .2O 3 (g)=3O 2 (g)D .4NH 3 (g)+5O 2 (g)=4NO (g)+6H 2O (1)3.aA(g)+bB(g)⇌cC(g)+dD(g) ΔH=Q ,同时符合两图中各曲线规律的是( )A .a+b>c+d T 1>T 2 Q>0B .a+b>c+d T 1>T 2 Q<0C .a+b>c+d T 1<T 2 Q<0D .a+b <c+d T 1<T 2 Q<04.某对于平衡体系xA(g)+yB(g)mC(g)+nD(g),其他条件不变增大压强,C 的百分含量减少,则下列关系中正确的是( ) A .x +m<n B .x +y<m +n C .m +n>xD .m +n<y +x5.已知某反应中各物质的浓度数据如下: ()()-1-1mA g +nB g qC g /mol L 3.6 2.4 2.42s /mol L 2.41.64.0⋅⋅()起始浓度末浓度则m:n:q等于()A.3:2:2 B.3:2:3 C.3:2:4 D.3:2:56.化学知识和技术发展离不开伟大化学家,下列人物与其贡献不匹配的是()A.侯德榜——工业制备烧碱B.勒夏特列——化学平衡的移动C.李比希——元素定量分析D.盖斯——反应热的计算7.现有下列两个图象:下列反应中符合上述图象的是()A.N2(g)+3H2(g)2NH3(g) ΔH<0B.2SO3(g)2SO2(g)+O2(g) ΔH>0C.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0D.H2S(g)H2(g)+S(s) ΔH>0,10min 8.将1mol X和3mol Y在2L的恒容密闭容器中混合,一定条件下发生反应X(s)3Y(g)2Z(g)时测得Y的物质的量为2.4mol,下列说法正确的是()A.10min内,X的平均反应速率为0.01mol/(L·min)B.第10min时,Z的浓度为0.4mol/LC.10min时,X的转化率为20%D.反应时,向容器中通入He,容器内压强增大,反应速率加快9.下列说法正确的是()A.活化分子间的碰撞一定能发生化学反应B.增大浓度时,化学反应速率加快,主要原因是反应物活化分子百分数增大,单位时间内有效碰撞次数增多C.△H<0的反应均是自发反应D.反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57kJ•mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向10.下图是可逆反应X 2+3Y 22Z 在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述不正确的是( )A .t 1、t 2时,用不同物质表示正、逆反应速率有2v(X 2)=v(Z)B .t 2时,反应已达到了一定限度C .t 2~t 3,反应不再发生D .t 2~t 3,各物质的浓度不再发生变化 11.已知298K 时,2SO 2(g)+O 2(g)2SO 3(g);△H=-197kJ ·mol -1。

专题42化学反应速率与平衡图像问题1.【2022年湖南卷】向体积均为1L 的两恒容容器中分别充入2mol X 和1mol Y 发生反应:2X(g)+Y(g)Z(g) ΔH ,其中甲为绝热过程,乙为恒温过程,两反应体系的压强随时间的变化曲线如图所示。
下列说法正确的是A .ΔH>0B .气体的总物质的量:a c n <nC .a 点平衡常数:K>12D .反应速率:a b v <v 正正【答案】BC 【解析】A .甲容器在绝热条件下,随着反应的进行,压强先增大后减小,根据理想气体状态方程PV=nRT 可知,刚开始压强增大的原因是因为容器温度升高,则说明上述反应过程放热,即H ∆<0,故A 错误;B .根据A 项分析可知,上述密闭溶液中的反应为放热反应,图中a 点和c 点的压强相等,因甲容器为绝热过程,乙容器为恒温过程,若两者气体物质的量相等,则甲容器压强大于乙容器压强,则说明甲容器中气体的总物质的量此时相比乙容器在减小即气体总物质的量:n a <n c ,故B 正确;C .a 点为平衡点,此时容器的总压为p ,根据理想气体状态方程PV=nRT 可知,在恒容条件下进行,气体的物质的量之比等于P T整体之比,根据A 项分析可知,绝热条件下,反应到平衡状态放热,所以T a >T 始,压强:Pa=12P 始,则n a <12n 始,可设Y 转化的物质的量浓度为xmol∙L −1,则列出三段式如下:02X(g)+Y(g)Z(g)2102x xx 22x 1x x c cc ∆-- 平,则有[(22x)(1x)x]mol -+-+<13mol 2⨯,计算得到x >0.75,那么化学平衡常数K=2c(Z)c (X)c(Y)⋅>20.75120.50.25=⨯,故C 正确;D .根据图像可知,甲容器达到平衡的时间短,温度高,所以达到平衡的速率相对乙容器的快,即V a 正>V b 正,故D 错误。

专题十一化学反应速率和化学平衡考点一化学反应速率1.(2022北京,14,3分)CO2捕获和转化可减少CO2排放并实现资源利用,原理如图1所示。
反应①完成之后,以N2为载气,将恒定组成的N2、CH4混合气,以恒定流速通入反应器,单位时间流出气体各组分的物质的量随反应时间变化如图2所示。
反应过程中始终未检测到CO2,在催化剂上检测到有积炭。
下列说法不正确...的是()图1图2A.反应①为CaO+CO2CaCO3;反应②为CaCO3+CH4CaO+2CO+2H2B.t1~t3,n(H2)比n(CO)多,且生成H2的速率不变,推测有副反应CH4C+2H2C.t2时刻,副反应生成H2的速率大于反应②生成H2的速率D.t3之后,生成CO的速率为0,是因为反应②不再发生答案C根据题图1,可知反应①为CO2与CaO反应生成CaCO3,反应②为CaCO3与CH4在催化剂作用下反应生成CaO、CO和H2,A正确;由题图2可知,t1~t3,n(H2)比n(CO)多,生成H2的速率不变,又因为在催化剂上检测到有积炭,故发生的副反应为CH4C+2H2,B正确;t2时刻,CO的气体流速=反应②生成的H2的气体流速≈1.5mmol·min-1,副反应生成的H2的气体流速≈0.5mmol·min-1,故副反应生成H2的速率小于反应②生成H2的速率,C错误;只有反应②生成CO,题图2中t3之后CO气体流速为0,反应②不再发生,所以CO的生成速率为0,D正确。
方法技巧认真审题,仔细观察原理示意图和坐标图:①提取题中有价值的信息,找出每一个转化过程的反应物和生成物;②读懂坐标图中每一条曲线代表的物质,然后确定其变化量。
2.(2022广东,15,4分)在相同条件下研究催化剂Ⅰ、Ⅱ对反应X→2Y的影响,各物质浓度c随反应时间t的部分变化曲线如图,则()A.无催化剂时,反应不能进行B.与催化剂Ⅰ相比,Ⅱ使反应活化能更低C.a曲线表示使用催化剂Ⅱ时X的浓度随t的变化D.使用催化剂Ⅰ时,0~2min内,v(X)=1.0mol·L-1·min-1答案D由题图可知,无催化剂时,反应能进行,但是反应速率比较慢,A项错误;在相同条件下,与催化剂Ⅱ相比,在使用催化剂Ⅰ时生成物的浓度变化量更大,反应速率更快,故催化剂Ⅰ使反应活化能更低,B项错误;0~2min时,反应物浓度的变化量与生成物浓度的变化量之比等于其化学计量数之比,故a曲线表示使用催化剂Ⅰ时X的浓度随t的变化,C项错误;使用催化剂Ⅰ时,0~2min内,v(X)=(4.0mol·L-1-2.0mol·L-1)÷2 min=1.0mol·L-1·min-1,D项正确。
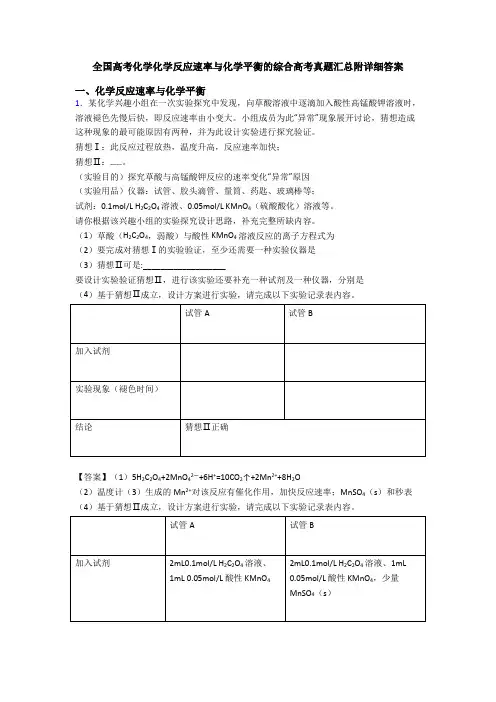
全国高考化学化学反应速率与化学平衡的综合高考真题汇总附详细答案一、化学反应速率与化学平衡1.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,溶液褪色先慢后快,即反应速率由小变大。
小组成员为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种,并为此设计实验进行探究验证。
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;猜想Ⅱ:……。
(实验目的)探究草酸与高锰酸钾反应的速率变化“异常”原因(实验用品)仪器:试管、胶头滴管、量筒、药匙、玻璃棒等;试剂:0.1mol/L H2C2O4溶液、0.05mol/L KMnO4(硫酸酸化)溶液等。
请你根据该兴趣小组的实验探究设计思路,补充完整所缺内容。
(1)草酸(H2C2O4,弱酸)与酸性KMnO4溶液反应的离子方程式为(2)要完成对猜想Ⅰ的实验验证,至少还需要一种实验仪器是(3)猜想Ⅱ可是:___________________要设计实验验证猜想Ⅱ,进行该实验还要补充一种试剂及一种仪器,分别是(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
【答案】(1)5H2C2O4+2MnO42—+6H+=10CO2↑+2Mn2++8H2O(2)温度计(3)生成的Mn2+对该反应有催化作用,加快反应速率;MnSO4(s)和秒表(4)基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
(加入试剂时只要A试管与B试管所加的0.1mol/L H2C2O4溶液、0.05mol/L 酸性KMnO4体积相等即给分。
)【解析】试题分析:猜想II:影响反应速率的因素有浓度、压强、温度和催化剂,而草酸与高锰酸钾溶液发生反应:5H2C2O4+2MnO4-+6H+=10CO2↑+2 Mn2++8H2O,溶液褪色先慢后快,即反应速率由小变大,反应物是溶液,无气体,故不能是反应物的浓度和压强对反应速率产生的影响,则只能是生成的产物又做了此反应的催化剂,加快了反应速率,故答案为生成的Mn2+在反应中起到催化剂的作用,加快了反应速率;(1)草酸中的碳元素被在酸性条件下能被高锰酸钾溶液氧化为CO2,高锰酸根能被还原为Mn2+,根据得失电子数守恒来配平可得离子方程式为:5H2C2O4+2MnO4-+6H+=10CO2↑+2 Mn2++8H2O;(2)由于猜想I是认为可能是由于反应放热导致体系温度升高而加快了反应速率,故应测量反应前和反应开始后一段时间的温度变化,则还缺少温度计;(3)猜想II是认为生成的Mn2+在反应中起到催化剂的作用,由于Cl-也能使高锰酸钾溶液褪色,故为了避免Cl-的干扰,故应补充MnSO4固体,通过测量溶液褪色的时间的长短来验证猜想,则还需的仪器是秒表;(4)要通过对比实验来验证猜想Ⅱ,则实验B和实验A的试剂的选择应除了MnSO4固体不同,其他均应相同,故试管B内加入的试剂是在试管A试剂的基础上多加了MnSO4(s),由于结论是猜想II成立,则试管B的褪色时间应该比试管A的更快,故答案为2.连二亚硫酸钠(Na2S2O4)俗称保险粉,是工业上重要的还原性漂白剂,也是重要的食品抗氧化剂。

2020-2021高考化学化学反应速率与化学平衡综合题汇编及详细答案一、化学反应速率与化学平衡1.影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol/L、2 mol/L、18.4 mol/L)。
设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表实验步骤现象结论①分别取等体积的2mol/L的硫酸于试管中②反应速率Mg>Fe,Cu不反应金属的性质越活泼,反应速率越快(1)甲同学表中实验步骤②为____________________(2)甲同学的实验目的是:在相同的温度下,__________________________________。
实验二:乙同学为了更精确的研究浓度对反应速率的影响,利用下图所示装置进行定量实验。
(3)乙同学在实验中应该测定的数据是______________。
(4)乙同学完成该实验应选用的实验药品是______________________;该实验中不选用某浓度的硫酸,理由是_________________________。
【答案】分别投入大小、形状相同的Cu、Fe、Mg 研究金属(或反应物)本身的性质与反应速率的关系一定时间内产生气体的体积(或产生一定体积的气体所需时间) Mg(或Fe)和0.5 mol/L硫酸和2 mol/L硫酸常温下Mg与18.4 mol/L硫酸反应生成SO2,Fe在18.4 mol/L硫酸中钝化【解析】【分析】(1)要比较金属和稀硫酸的反应快慢,则应该使金属的形状和大小都是相同的,即分别投入形状、大小相同的Cu、Fe、Mg;(2)根据步骤和现象,目的是探究金属(反应物)本身的性质与反应速率的关系;(3)要定量研究,需要测定一定时间内产生气体的体积(或产生一定体积的气体所需要的时间);(4)浓硫酸和金属反应不能生成氢气,而铜与稀硫酸又不反应,所以选择的药品是Mg (或Fe)、0.5ol/L硫酸和2mol/L硫酸。

化学反应速率和平衡高考题汇总1、2017全国卷I,283H2S与CO2在高温下发生反应:H2Sg+CO2g COSg+H2Og;在610K时,将0.10molCO2与0.40molH2S充入2.5L的空钢瓶中,反应平衡后水的物质的量分数为0.02;①H2S的平衡转化率1α=_______%,反应平衡常数K=________;②在620K重复试验,平衡后水的物质的量分数为0.03,H2S的转化率2α_____1α,该反应的∆H_____0;填“>”“<”或“=”③向反应器中再分别充入下列气体,能使H2S转化率增大的是________填标号A.H2SB.CO2C.COSD.N22、2017全国卷II,27丁烯是一种重要的化工原料,可由丁烷催化脱氢制备;回答下列问题:1正丁烷C4H10脱氢制1-丁烯C4H8的热化学方程式如下:①C4H10g=C4H8g+H2gΔH1图a是反应①平衡转化率与反应温度及压强的关系图,x_________0.1填“大于”或“小于”;欲使丁烯的平衡产率提高,应采取的措施是__________填标号;A.升高温度B.降低温度C.增大压强D.降低压强2丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器氢气的作用是活化催化剂,出口气中含有丁烯、丁烷、氢气等;图b为丁烯产率与进料气中n氢气/n丁烷的关系;图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________;3图c为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物;丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________;3、2017全国卷III,28砷As是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途;回答下列问题:2工业上常将含砷废渣主要成分为As2S3制成浆状,通入O2氧化,生成H3AsO4和单质硫;写出发生反应的化学方程式________;该反应需要在加压下进行,原因是________________________;4298K时,将20mL3x mol·L1Na3AsO3、20mL3x mol·L1I2和20mLNaOH 溶液混合,发生反应:33AsO-aq+I2aq+2OHaq34AsO-aq+2Iaq+H2Ol;溶液中c34AsO-与反应时间t的关系如图所示;①下列可判断反应达到平衡的是__________填标号;a.溶液的pH不再变化b.v I=2v 33AsO -c.c 34AsO -/c 33AsO -不再变化d.c I=y mol·L 1②t m 时,v 正_____v 逆填“大于”“小于”或“等于”;③t m 时v 逆_____t n 时v 逆填“大于”“小于”或“等于”,理由是_____________;④若平衡时溶液的pH=14,则该反应的平衡常数K 为___________; 4、2017北京理综26TiCl 4是由钛精矿主要成分为TiO 2制备钛Ti 的重要中间产物,制备纯TiCl 4的流程示意图如下: 资料:TiCl 4及所含杂质氯化物的性质1氯化过程:TiO 2与Cl 2难以直接反应,加碳生成CO 和CO 2可使反应得以进行;②氯化过程中CO 和CO 2可以相互转化,根据如图判断:CO 2生成CO 反应的ΔH _____0填“>”“<”或“=”,判断依据:_______________;5、2017天津理综6常压下羰基化法精炼镍的原理为:Nis+4COgNiCO 4g;230℃时,该反应的平衡常数K =2×105;已知:NiCO 4的沸点为42.2℃,固体杂质不参与反应;第一阶段:将粗镍与CO 反应转化成气态NiCO 4;第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍;下列判断正确的是A .增加c CO,平衡向正向移动,反应的平衡常数增大B .第一阶段,在30℃和50℃两者之间选择反应温度,选50℃C .第二阶段,NiCO 4分解率较低D .该反应达到平衡时,v 生成NiCO 4=4v 生成CO6、2017天津理综10H 2S 和SO 2会对环境和人体健康带来极大的危害,工业上采取多种方法减少这些有害气体的排放,回答下列方法中的问题;Ⅰ.H 2S 的除去方法1:生物脱H 2S 的原理为:H 2S+Fe 2SO 43S↓+2FeSO 4+H 2SO 44FeSO 4+O 2+2H 2SO 42Fe 2SO 43+2H 2O1硫杆菌存在时,FeSO 4被氧化的速率是无菌时的5×105倍,该菌的作用是______________;2由图3和图4判断使用硫杆菌的最佳条件为______________;若反应温度过高,反应速率下降,其原因是______________;Ⅱ.SO 2的除去方法1双减法:用NaOH 吸收SO 2,并用CaO 使NaOH 再生NaOH 溶液2SO CaO−−−→←−−−①②Na 2SO 3 4写出过程①的离子方程式:____________________________;CaO 在水中存在如下转化:CaOs+H 2OlCaOH 2sCa 2+aq+2OHaq从平衡移动的角度,简述过程②NaOH 再生的原理____________________________________;7、2017海南化学11已知反应COg+H 2Og CO 2g+H 2g△H<0.在一定温度和压强下于密闭容器中,反应达到平衡.下列叙述正确的是 A .升高温度,K 减小 B .减小压强,nCO 2增加C .更换高效催化剂,αCO 增大D .充入一定量的氮气,nH 2不变8、2017海南化学14碳酸钠是一种重要的化工原料,主要采用氨碱法生产.回答下列问题:2已知:①2NaOHs+CO 2g═Na 2CO 3s+H 2Og△H 1=﹣127.4kJ mol ﹣1②NaOHs+CO 2g═NaHCO 3s△H 1=﹣131.5kJ mol ﹣1反应2NaHCO 3s═Na 2CO 3s+H 2Og+CO 2g 的平衡常数表达式K= .9、2017江苏化学10H 2O 2分解速率受多种因素影响;实验测得70℃时不同条件下H 2O 2浓度随时间的变化如图所示;下列说法正确的是 A.图甲表明,其他条件相同时,H 2O 2浓度越小,其分解速率越快 B.图乙表明,其他条件相同时,溶液pH 越小,H 2O 2分解速率越快 C.图丙表明,少量Mn 2+存在时,溶液碱性越强,H 2O 2分解速率越快 D.图丙和图丁表明,碱性溶液中,Mn 2+对H 2O 2分解速率的影响大 10、2017江苏化学15温度为T 1时,在三个容积均为1L 的恒容密闭容器中仅发生反应:2NO 2g2NOg+O 2g 正反应吸热;实验测得:v 正=v NO 2消耗=k 正c 2NO 2,v 逆=v NO 消耗=2v O 2消耗=k 逆c 2NO·c O 2,k 正、k 逆为速率常数,受温度影响;下列说法正确的是A.达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为4∶5B.达平衡时,容器Ⅱ中cO 2/cNO 2比容器Ⅰ中的大C.达平衡时,容器Ⅲ中NO 的体积分数小于50%D.当温度改变为T 2时,若k 正=k 逆,则T 2>T 1 11、2017浙江化学12已知:Xg +2Yg3Zg ΔH =-a kJ·molˉ1a>0;下列说法不正确...的是 A .0.1molX 和0.2molY 充分反应生成Z 的物质的量一定小于0.3molB .达到化学平衡状态时,X 、Y 、Z 的浓度不再发生变化C.达到化学平衡状态时,反应放出的总热量可达akJD.升高反应温度,逆反应速率增大,正反应速率减小12、2017浙江化学21对水样中溶质M的分解速率影响因素进行研究;在相同温度下,M的物质的量浓度mol·Lˉ1随时间min变化的有关实验数据见下表;下列说法不正确...的是A.在0~20min内,Ⅰ中M的分解速率为0.015mol·Lˉ1·minˉ1 B.水样酸性越强,M的分解速率越快C.在0~20min内,Ⅲ中M的分解百分率比Ⅱ大D.由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快13、2017浙江化学302在常压、Ru/TiO2催化下,CO2和H2混和气体体积比1∶4,总物质的量a mol进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示选择性:转化的CO2中生成CH4或CO的百分比;反应ⅠCO2g+4H24g+2H2Og ΔH4反应ⅡCO2g+H2+H2Og ΔH5①下列说法不正确...的是________A.△H4小于零B.温度可影响产物的选择性C.CO2平衡转化率随温度升高先增大后减少D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L该温度下反应Ⅰ的平衡常数为________用a、V表示③350℃下CH4物质的量随时间的变化曲线如图3所示;画出400℃下0~t1时刻CH4物质的量随时间的变化曲线;答案:1、3①2.5 2.8×10-3②>>③B2、1123小于AD2氢气是产物之一,随着n氢气/n丁烷增大,逆反应速率增大,原料气中过量氢气使反应①逆向移动,所以丁烯产率下降;3升高温度有利于反应向吸热方向进行温度升高反应速率加快 丁烯高温裂解生成短链烃类 3、22As 2S 3+5O 2+6H 2O=4H 3AsO 4+6S 增加反应物O 2的浓度,提高As 2O 3的转化速率4①a、c②大于③小于t m 时生成物浓度较低④13124y (mol L )(x-y )--⋅ 4、1②>随温度升高,CO 含量增大,说明生成CO 的反应是吸热反应 5、B6、1降低反应活化能或作催化剂230℃、pH=2.0蛋白质变性或硫杆菌失去活性 42OH -+SO 223SO -+H 2O 23SO -与Ca 2+生成CaSO 3沉淀,平衡向正向移动,有NaOH 生成 7、AD 8、cH 2OcCO 2 9、D 10、CD 11、D 12、D13、2CD625V 2/a 2。

高考化学化学反应速率与化学平衡综合题附答案一、化学反应速率与化学平衡1.用H2O2、KI和洗洁精可完成“大象牙膏”实验(短时间内产生大量泡沫),某同学依据文献资料对该实验进行探究。
(1)资料1:KI在该反应中的作用:H2O2+I-=H2O+IO-;H2O2+IO-=H2O+O2↑+I-。
总反应的化学方程式是________________。
(2)资料2:H2O2分解反应过程中能量变化如图所示,其中①有KI加入,②无KI加入。
下列判断正确的是___________(填字母)。
a. 加入KI后改变了反应的路径b. 加入KI后改变了总反应的能量变化c. H2O2+I-=H2O+IO-是放热反应(3)实验中发现,H2O2与KI溶液混合后,产生大量气泡,溶液颜色变黄。
再加入CCl4,振荡、静置,气泡明显减少。
资料3:I2也可催化H2O2的分解反应。
①加CCl4并振荡、静置后还可观察到___________,说明有I2生成。
②气泡明显减少的原因可能是:i. H2O2浓度降低;ii. ________。
以下对照实验说明i不是主要原因:向H2O2溶液中加入KI溶液,待溶液变黄后,分成两等份于A、B两试管中。
A试管加入CCl4,B试管不加CCl4,分别振荡、静置。
观察到的现象是_____________。
(4)资料4:I-(aq)+I2(aq)ƒI3-(aq) K=640。
为了探究体系中含碘微粒的存在形式,进行实验:向20 mL一定浓度的H2O2溶液中加入10mL 0.10mol·L-1 KI溶液,达平衡后,相关微粒浓度如下:微粒I-I2I3-浓度/(mol·L-1) 2.5×10-3a 4.0×10-3①a=__________。
②该平衡体系中除了含有I-,I2,I3-外,一定还含有其他含碘微粒,理由是________________。
【答案】2H2O2KI2H2O+O2↑ a 下层溶液呈紫红色在水溶液中I2的浓度降低 A试管中产生气泡明显变少;B 试管中产生气泡速率没有明显减小 32.510-⨯ 2c (I 2)+c (I-)+3c (I 3-)<0.033mol ·L -1【解析】 【分析】(1)H 2O 2+I -=H 2O +IO -,H 2O 2+IO -=H 2O +O 2↑+I -,把两式加和,即可得到总反应的化学方程式。

第1页共24页2023年高考化学总复习:化学反应速率与化学
平衡
注意事项
1.全卷满分100分。
考试用时90分钟。
2.可能用到的相对原子质量:H 1C 12O 16N 14Zn 65。
一、选择题(本题共15小题,每小题3分,共45分)
1.关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr ),易诱发关节疼痛,其化学机理是①HUr (aq )+H 2O (l
)Ur -(aq )+H 3O +(aq )、②Ur -(aq )+Na +(aq
)NaUr (s )ΔH 。
下列叙述不正
确的是()
A.降低温度,反应②平衡正向移动
B.反应②正向吸热
C.降低关节滑液中HUr 及Na +含量是治疗方法之一
D.关节保暖可以缓解疼痛,原理是平衡②逆向移动
2.已知当ΔH -T ·ΔS <0时化学反应能自发进行。
下列化学反应肯定能自发进行的是(
)A.N 2(g )+3H 2(g
)
2NH 3(g )B.2K (s )+2H 2O (l
)
2K +(aq )+2OH -(aq )+H 2↑C.2Mg (s )+O 2(g
)
2MgO (s )D.CaCO 3(s
)CaO (s )+CO 2(g )。
高考化学化学反应速率与化学平衡(大题培优易错难题)及详细答案一、化学反应速率与化学平衡1.研究不同pH时CuSO4溶液对H2O2分解的催化作用。
资料:a.Cu2O为红色固体,难溶于水,能溶于硫酸,生成Cu和Cu2+。
b.CuO2为棕褐色固体,难溶于水,能溶于硫酸,生成Cu2+和H2O2。
c.H2O2有弱酸性:H2O2H+ +HO2-,HO2-H+ +O22-。
编号实验现象Ⅰ向1mL pH=2的1mol·L−1CuSO4溶液中加入0.5mL30% H2O2溶液出现少量气泡Ⅱ向1mL pH=3的1mol·L−1CuSO4溶液中加入0.5mL30% H2O2溶液立即产生少量棕黄色沉淀,出现较明显气泡Ⅲ向1mL pH=5的1mol·L−1CuSO4溶液中加入0.5mL30% H2O2溶液立即产生大量棕褐色沉淀,产生大量气泡(1)经检验生成的气体均为O2,Ⅰ中CuSO4催化分解H2O2的化学方程式是__。
(2)对Ⅲ中棕褐色沉淀的成分提出2种假设:ⅰ.CuO2,ⅱ.Cu2O和CuO2的混合物。
为检验上述假设,进行实验Ⅳ:过滤Ⅲ中的沉淀,洗涤,加入过量硫酸,沉淀完全溶解,溶液呈蓝色,并产生少量气泡。
①若Ⅲ中生成的沉淀为CuO2,其反应的离子方程式是__。
②依据Ⅳ中沉淀完全溶解,甲同学认为假设ⅱ不成立,乙同学不同意甲同学的观点,理由是__。
③为探究沉淀中是否存在Cu2O,设计如下实验:将Ⅲ中沉淀洗涤、干燥后,取a g固体溶于过量稀硫酸,充分加热。
冷却后调节溶液pH,以PAN为指示剂,向溶液中滴加c mol·L−1EDTA溶液至滴定终点,消耗EDTA溶液V mL。
V=__,可知沉淀中不含Cu2O,假设ⅰ成立。
(已知:Cu2++EDTA= EDTA-Cu2+,M(CuO2)=96g·mol−1,M(Cu2O)=144g·mol−1)(3)结合方程式,运用化学反应原理解释Ⅲ中生成的沉淀多于Ⅱ中的原因__。
高一化学化学反应速率和化学平衡试题1.下列关于化学反应的速率和限度的说法不正确的是()A.任何可逆反应都有一定的限度B.影响化学反应速率的条件有温度、催化剂、浓度等C.化学平衡状态指的是反应物和生成物浓度相等时的状态D.决定反应速率的主要因素是反应物的性质【答案】C【解析】A.任何可逆反应都是在一定的条件下进行的,当反应在该条件下达到平衡时就达到了该条件下的最大程度,即有一定的限度,正确;B.在内因不变时,外界条件如影响化温度、催化剂、浓度等也会对化学反应产生影响,正确;C.化学平衡状态指的是任何反应物和生成物浓度都保持不变的状态,错误;D.决定反应速率的主要因素是参加化学反应的物质本身的性质,正确。
【考点】考查关于化学反应的速率和限度的知识。
2.T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。
反应过程中X、Y、Z 的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。
则下列结论错误的是A.容器中发生的反应可表示为:3X(g)+Y(g)2Z(g)B.反应进行前3min内,用X表示的反应速率v(X)=0.1mol/(L·min)C.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂D.保持其他条件不变,升高温度,化学平衡向逆反应方向移动【答案】D【解析】 A.根据图示1可知:XY是反应物,Z是生成物,它们的物质的量的比等于3:2:1,由于最终各种物质都存在,所以该反应是可逆反应。
故容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g),正确;B.反应进行前3min内,用X表示的反应速率v(X)=(2.0—1.4)mol÷2L÷3min= 0.1mol/(L·min),正确;C.由图3可知:各种物质在2min时就达到了平衡,但是物质的平衡浓度不变,所以平衡未发生移动。
2025年高考化学复习之小题狂练300题(选择题):化学反应速率与化学平衡一.选择题(共10小题)1.(2024•江西)温度T下,向1L真空刚性容器中加入1mol(CH3)2CHOH,反应达到平衡时,c(Y)=0.4mol/L,下列说法正确的是()A.再充入1mol X和1mol Y,此时v正<v逆B.再充入1mol X,平衡时,c(Y)=0.8mol/LC.再充入1mol N2,平衡向右移动D.若温度升高,X的转化率增加,则上述反应ΔH<02.(2024•广东)对反应S(g)⇌T(g)(I为中间产物),相同条件下:①加入催化剂,反应达到平衡所需时间大幅缩短;②提高反应温度,c平(S)/c平(T)增大,c平(S)/c平(I)减小。
基于以上事实,可能的反应历程示意图(—为无催化剂,…为有催化剂)为()A.B.C.D.3.(2024•北京)苯在浓HNO3和浓H2SO4作用下,反应过程中能量变化示意图如图。
下列说法不正确的是()A.从中间体到产物,无论从产物稳定性还是反应速率的角度均有利于产物ⅡB.X为苯的加成产物,Y为苯的取代产物C.由苯得到M时,苯中的大π键没有变化D.对于生成Y的反应,浓H2SO4作催化剂4.(2024•北京)不同条件下,当KMnO4与KI按照反应①②的化学计量比恰好反应,结果如下。
反应序号起始酸碱性KI KMnO4还原产物氧化产物物质的量/mol物质的量/mol①酸性0.001n Mn2+I2②中性0.00110n MnO2已知:的氧化性随酸性减弱而减弱。
下列说法正确的是()A.反应①,n(Mn2+):n(I2)=1:5B.对比反应①和②,x=3C.对比反应①和②,I﹣的还原性随酸性减弱而减弱D.随反应进行,体系pH变化:①增大,②不变5.(2024•江苏)二氧化碳加氢制甲醇过程中的主要反应(忽略其他副反应)为:①CO2(g)+H2(g)═CO(g)+H2O(g)ΔH1=41.2kJ•mol﹣1②CO(g)+2H2(g)═CH3OH(g)ΔH2225℃、8×106Pa下,将一定比例CO2、H2混合气匀速通过装有催化剂的绝热反应管。
专题十一化学反应速率和化学平衡考点二化学平衡1.(2022北京,12,3分)某MOFs多孔材料孔径大小和形状恰好将N2O4“固定”,能高选择性吸附NO2。
废气中的NO2被吸附后,经处理能全部转化为HNO3。
原理示意图如下。
已知:2NO2(g)N2O4(g)ΔH<0下列说法不正确...的是() A.温度升高时不利于NO2吸附B.多孔材料“固定”N2O4,促进2NO2N2O4平衡正向移动C.转化为HNO3的反应是2N2O4+O2+2H2O4HNO3D.每获得0.4mol HNO3时,转移电子的数目为6.02×1022答案D2NO2(g)N2O4(g)ΔH<0,温度升高,平衡逆向移动,NO2生成N2O4的转化率降低,多孔材料不能将更多的N2O4“固定”,故不利于NO2吸附,A正确;多孔材料“固定”N2O4,使混合气体中N2O4的浓度降低,促进平衡2NO2N2O4正向移动,B正确;N2O4与O2和H2O发生氧化还原反应生成硝酸,C正确;由C项中反应2N2O4+O2+2H2O4HNO3可知,每生成0.4mol HNO3,转移电子的数目为0.4×6.02×1023,D错误。
2.(2022广东,13,4分)恒容密闭容器中,BaSO4(s)+4H2(g)BaS(s)+4H2O(g)在不同温度下达平衡时,各组分的物质的量(n)如图所示。
下列说法正确的是()A.该反应的ΔH<0B.a为n(H2O)随温度的变化曲线C.向平衡体系中充入惰性气体,平衡不移动D.向平衡体系中加入BaSO4,H2的平衡转化率增大答案C随着温度升高,n(H2)减小,说明平衡正向移动,反应的ΔH>0,A不正确;起始时H2为4mol,200℃时H2约为0.5mol,即约有3.5mol H2参加反应,根据化学方程式计算可知此时生成的H2O约为3.5mol,故题图中最上方的曲线为n(H2O)随温度的变化曲线,B不正确;恒容体系中充入惰性气体,H2、H2O的浓度均不变,平衡不移动,C 正确;BaSO4为固体,加入BaSO4,平衡不移动,D不正确。
高考化学专题复习:化学反应速率和化学平衡一、单项选择题(共12小题)1.10mL浓度为1mol•L-1的盐酸与过量的锌粉反应,若加入适量的下列溶液,能减慢反应速率但又不影响氢气生成量的是()A.Na2SO4B.H2SO4C.CuSO4D.Na2CO32.某温度下的恒容密闭容器中,有下述反应:A(g)+2B(g)⇌C(g)+D(g)。
下列情况不能说明该反应一定达到化学平衡状态的是()A.混合气体的压强B.消耗2molB的时候消耗1molCC.A的浓度不再改变D.混合气体的密度3.将一定量纯净的氨基甲酸铵置于密闭真空恒容容器中(固体体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)⇌2NH3(g)+CO2(g)。
不能判断该分解反应达到化学平衡的是()A.混合气体的压强不再变化B.混合气体的密度不再变化C.混合气体的平均相对分子质量不再变化D.混合气体的总物质的量不再变化4.可逆反应:2NO2(g)⇌2NO(g)+O2(g),在体积固定的密闭容器中,达到平衡状态的标志是()①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时生成2nmolNO③用NO2、NO、O2表示的反应速率之比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A.①④⑥⑦B.①④⑤⑥⑦C.②④⑥⑦D.②③④⑥⑦5.已知反应4CO+2NO2=N2+4CO2在不同条件下的化学反应速率如下,反应速率最快的是()A.v(CO)=1.5mol•L-1•min-1B.v(NO2)=0.015mol•L-1•s-1C.v(N2)=0.4mol•L-1•min-1D.v(CO2)=1.7mol•L-1•min-1 6.下列说法正确的是()A.对于A(s)+B(g)⇌C(g)+D(g)的反应,加入A,反应速率加快B.2NO2⇌N2O4(正反应放热),升高温度,反应速率减慢C.一定温度下,反应N2(g)+3H2(g)⇌2NH3(g)在密闭容器中进行,恒压,充入He不改变反应速率D.100mL2mol•L-1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快7.一定条件下:2A(g)+B(s)⇌C(g)△H<0。
化学反应速率和化学平衡高考题汇编一.化学反应速率的相关知识及计算1.(08广东卷)对于反应2SO 2(g)+O 2(g)2SO 3(g),能增大正反应速率的措施是( ) A .通入大量O 2B .增大容积C .移去部分SO 3D .降低体系温度2.(08上海卷)等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间t 产生气体体积V 的数据,根据数据绘制得到图1,则曲线a 、b 、c 、d 所对应的实验组别可能是( )A .4-3-2-1B .1-2-3-4C .3-4-2-1D .1-2-4-3二.平衡的标志问题3.(2005年广东)对可逆反应4NH 3(g) + 5O 2(g)4NO(g) + 6H 2O(g),下列叙述正确的是 ( )A .达到化学平衡时,4v 正(O 2) = 5v 逆(NO )B .若单位时间内生成x mol NO 的同时,消耗x mol NH 3,则反应达到平衡状态C .达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大D .化学反应速率关系是:2v 正(NH 3) = 3v 正(H 2O )4.(2005年北京春)一定条件下,在密闭容器中,能表示反应X(气)+2 Y(气)产 2 Z(气),一定达到化学平衡状态的是 ( )①X 、Y 、Z 的物质的量之比为l :2:2 ②X 、Y 、Z 的浓度不再发生变化③容器中的压强不再发生变化 ④单位时间内生成n mol Z ,同时生成2n mol Y A .①② B .①④ C .②③ D .③④ 三.等效平衡问题5.(2005年江苏)一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g) 3C(g),若反应开始时充入2 mol A 和2 mol B ,达平衡后A 的体积分数为a %。
其他条件不变时,若按下列四种配比作为起始物质,平衡后A 的体积分数大于a %的是A .2 mol CB .2 mol A 、1 mol B 和1 mol He (不参加反应)C .1 mol B 和1 mol CD .2 mol A 、3 mol B 和3 mol C 6. (2004年北京卷)在一定温度下,一定体积的密闭容器中有如下平衡:H 2(气)+I 2(气) 2HI (气) 已知H 2和I 2的起始浓度均为110.0-⋅L mol 时,达平衡时HI 的浓度为116.0-⋅L mol 。
若H 2和I 2的起始浓度均变为120.0-⋅L mol ,则平衡时H 2的浓度(1-⋅L mol )是A. 0.16B. 0.08C. 0.04D. 0.027.(08全国Ⅱ卷)在相同温度和压强下,对反应CO 2(g)+H 2(g)错误!未找到引用源。
CO(g)+H 2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表CO 2 H 2COH 2O甲 amol amol 0mol 0mol 乙 2amol amol 0mol 0mol 丙 0mol 0mol amol amol 丁amol0molamolamol上述四种情况达到平衡后,n(CO)的大小顺序是( ) A .乙=丁>丙=甲 B .乙>丁>甲>丙 C .丁>乙>丙=甲D .丁>丙>乙>甲8.(2004年全国)某温度下在密闭容器中发生如下反应:)()(2g N g M + 2E (g )若开始时只充入2mol E (g ),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2mol M 和1mol N 的混合气体达平衡时M 的转化率为( ) A .20% B .40%C .60%D .80%四.化学平衡移动问题9.(08天津卷)对平衡CO 2(g )错误!未找到引用源。
CO 2(aq );△H= -19.75kJ/mol ,为增大二氧化碳气体在水中的溶解度,应采用的方法是( ) A .升温增压 B .降温减压 C .升温减压D .降温增压10.(2006全国)年反应2A(g)+B(g)2C(g);△H >0。
下列反应条件有利于生成C 的是A 低温、低压B 低温、高压C 高温、高压D 高温、低压11.(2005全国)已知反应A 2(g )+2B 2(g ) 2AB 2(g )△H<0下列说法正确的是( )A .升高温度,正向反应速率增加,逆向反应速率减小B .升高温度有利于反应速率增加,从而缩短达到平衡的时间C .达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动D .达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动 12.(2007年全国II )已知:C (s )+CO 2(g )2CO (g ) △H >0。
该反应达到平衡后,下列条件有利于反应向正方向进行的是A .升高温度和减小压强B .降低温度和减小压强C .降低温度和增大压强D .升高温度和增大压强13.(08广东卷)将H 2(g)和Br 2(g)充入恒容密闭容器,恒温下发生反应H 2(g )+Br 2(g) 错误!未找到引用源。
2HBr(g )0H ∆<,g 平衡时Br 2(g)的转化率为a ;若初始条件相同,绝热下进行上述反应,平衡时Br 2(g)的转化率为b 。
a 与b 的关系是( ) A .a >bB .a=bC .a <bD .无法确定14.(08北京卷)工业上制备纯硅反应的热化学方程式如下:SiCl 4(g)+2H 2(g)错误!未找到引用源。
Si(s)+4HCl(g);△H =+QkJ·mol -1(Q >0)某温度、压强下,将一定量的反应物通入密闭容器进行以上的反应(此条件下为可逆反应),下列叙述正确的是( )A .反应过程中,若增大压强能提高SiCl 4的转化率 物 质 物质的量实验B.若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJC.反应至4min时,若HCl的浓度为0.12mol·L-1,则H2的反应速率为0.03mol/(L·min)D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH恰好反应五. 化学平衡的图像问题15.(08四川卷)在密闭的容器中进行如下的反应:H2(G+I2(g)错误!未找到引用源。
2HI(g),在温度T1和T2时,产物的量彧时间的关系如下图所示,符合图象的正确的判断是( )A.T1>T2,△H>0 B.T1>T2,△H<0 C.T1<T2,△H>0 D.T1<T2,△H<016.(08全国Ⅰ卷)已知:4NH3(g)+5O2(g)=4NO(g)+6H2(g). △H=-1025kJ/mol该反应是一个可逆反应。
若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( C )17、(2007福建卷)下图是在恒温密闭容器中进行的某化学反应的反应速率随时间变化的示意图。
下列叙述与示意图不相不符....的是A、反应达平衡时,正反应速率和逆反应速率相等B、该反应达到平衡态I后,增大反应物的浓度,平衡发生移动,达到平衡态IIC、该反应达到平衡态I以后,减小反应物浓度,平衡发生移动,达到平衡态IID、同一种反应物在平衡态I和平衡态II时浓度不相等。
六.化学平衡的计算问题18.(08海南卷)X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于()A.33% B.40% C.50% D.65%19.(2004年广东卷)一定温度下,反应2SO2 + O22SO2,达到平衡时,n(SO2):n(O2):n(SO3)=2:3:4。
缩小体积,反应再次达到平衡时,n(O2)=0.8mol,n(SO3)=1.4mol,此时SO2的物质的量应是A、0.4molB、0.6molC、0.8molD、1.2mol20.(2004年全国)恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) 2NH3(g)(1)若反应进行到某时刻t时,n t (N2) = 13mol,n t (NH3) = 6mol,计算a的值(2)反应达平衡时,混合气体的体积为726.8L(标况下),其中NH3的含量(体积分数)为25%。
计算平移时NH3的物质的量。
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比,下同),n(始)∶n(平) = 。
(4)原混合气体中,a∶b = 。
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= 。
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) = 。
七、综合21.(08海南卷)反应A(g)+B(g)错误!未找到引用源。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
(1)该反应是____________________反应(填“吸热”“放热”);(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”“减小”“不变”),原因是____________________________________________;(3)反应体系中加入催化剂对反应热是否有影响?_______________,原因是_________。
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1_________,E2________(填“增大”“减小、”“不变”)。
22.(08上海卷)在2L密闭容器中,800℃时反应2NO(g)+O2(g)错误!未找到引用源。
2NO2(g)体系中,n(NO)随时间的变化如表:(1)右图中表示NO2的变化的曲线是____________。
用O2表示从0~2s内该反应的平均速率v=___________。
(2)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2)b、容器内压强保持不变c、v逆(NO)=2v正(O2)d、容器内的密度保持不变(3)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体b、适当升高温度c、增大O2的浓度d、选择高效的催化剂23.(08江苏卷)将一定量的SO2和含0.7mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2+O22SO3(正反应放热)。
反应达到平衡后,将容器中的混合气体通过过量NaOH溶液,气体体积减少了21.28L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6L(以上气体体积均为标准状况下的体积)。