酚酞在不同pH值溶液中的颜色
- 格式:doc
- 大小:235.00 KB
- 文档页数:1
酚酞在不同pH 值溶液中的颜色
陈晓勇摘录于网络内容
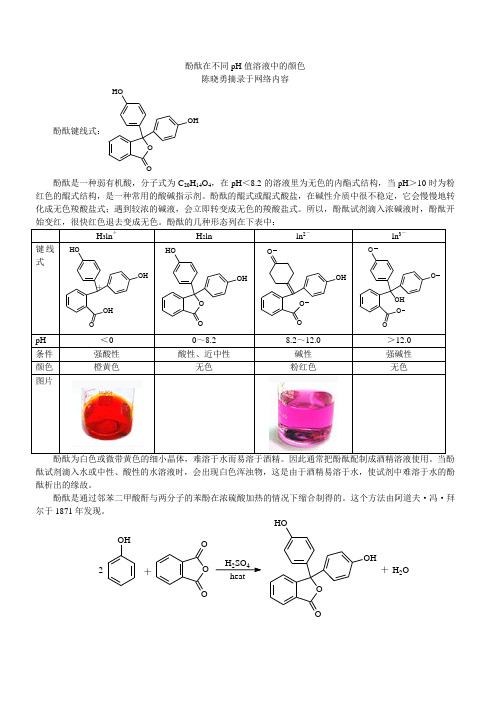
酚酞键线式:
O O
HO
OH
酚酞是一种弱有机酸,分子式为C 20H 14O 4,在pH <8.2的溶液里为无色的内酯式结构,当pH >10时为粉红色的醌式结构,是一种常用的酸碱指示剂。
酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立即转变成无色的羧酸盐式。
所以,酚酞试剂滴入浓碱液时,酚酞开
酚酞为白色或微带黄色的细小晶体,难溶于水而易溶于酒精。
因此通常把酚酞配制成酒精溶液使用。
当酚酞试剂滴入水或中性、酸性的水溶液时,会出现白色浑浊物,这是由于酒精易溶于水,使试剂中难溶于水的酚酞析出的缘故。
酚酞是通过邻苯二甲酸酐与两分子的苯酚在浓硫酸加热的情况下缩合制得的。
这个方法由阿道夫·冯·拜尔于1871年发现。
O O
HO
OH
OH O O O
+
2
H 2SO 4+H 2O。

酸碱指示剂的pH范围酸碱指示剂是一种可以通过改变颜色来显示溶液酸碱性质的化学物质。
它们被广泛应用于实验室和工业中,以确定溶液的pH值。
酸碱指示剂的pH范围取决于它们的化学结构。
常见的酸碱指示剂有酚酞、溴甲酚、甲基橙、酚红、碱紫、天青、金黄等。
不同的指示剂在不同的pH范围内显示不同的颜色变化。
酸碱指示剂的pH范围通常可以通过观察颜色的转变来确定。
在低pH条件下,指示剂通常呈现酸性颜色,而在高pH条件下,则呈现碱性颜色。
如果将指示剂加入中性溶液中,它们通常会显示中性颜色。
下面是一些常见的酸碱指示剂及其pH范围:1. 酚酞:酚酞是一种常用的酸碱指示剂,它的pH范围大约在8.2-10.0之间。
在酸性溶液中,酚酞呈现无色或淡粉红色;而在中性和碱性溶液中,则会变为鲜红色。
2. 溴甲酚:溴甲酚是另一种常见的酸碱指示剂,其pH范围大约在5.2-6.8之间。
在酸性溶液中,溴甲酚呈现黄色;而在中性和碱性溶液中,则会变为紫色。
3. 甲基橙:甲基橙是一种广泛使用的酸碱指示剂,其pH范围大约在3.2-4.4之间。
在酸性溶液中,甲基橙呈现红色;而在中性和碱性溶液中,则会变为黄色。
4. 酚红:酚红是一种常用于测定酸碱度的指示剂,其pH范围大约在6.4-8.0之间。
在酸性溶液中,酚红呈现黄色;而在中性和碱性溶液中,则会变为红色。
5. 碱紫:碱紫是一种常用于测定碱度的指示剂,其pH范围大约在11.6-14.0之间。
在酸性和中性溶液中,碱紫呈现黄色;而在碱性溶液中,则会变为紫色。
需要注意的是,每种酸碱指示剂的pH范围都可能略有不同,取决于溶液中其他化学物质的存在和浓度。
因此,在使用酸碱指示剂进行pH测试时,最好选择适合特定溶液的指示剂,并根据颜色变化及时进行判断。
总的来说,酸碱指示剂是一种方便快捷的工具,可用于酸碱度测试。
了解不同指示剂的pH范围和颜色变化规律可以帮助我们更准确地确定溶液的酸碱性质。
但需要注意的是,为了获得更准确的pH值,建议结合使用pH计等精密仪器进行测量。



酸碱中和指示剂酸碱中和指示剂是化学实验和分析中常用的一类化学试剂。
它们能够根据对颜色的敏感性来检测溶液的酸碱性。
本文将就酸碱中和指示剂的原理、常见种类和应用进行详细介绍。
酸碱中和指示剂的原理:酸碱中和指示剂的工作原理基于溶液的酸碱中和反应,并通过对于颜色变化的敏感性来确认溶液的酸碱性。
这些指示剂通常是弱干扰色试剂,当它们加入到溶液中时,会根据该溶液的酸碱性发生颜色变化,从而能够判断溶液的酸碱度。
常见的酸碱中和指示剂:1. 酚酞:颜色变化范围为无色到红色,pH变化范围为8.2-10.0。
它通常用于检测酸性溶液的中和终点。
2. 甲基橙:颜色变化范围为红色到黄色,pH变化范围为3.1-4.4。
它通常用于检测碱性溶液的中和终点。
3. 品红:颜色变化范围为黄色到红色,pH变化范围为5.0-6.6。
它通常用于检测弱酸性溶液的中和终点。
4. 酸性紫:颜色变化范围为红色到紫色,pH变化范围为1.0-2.8。
它通常用于检测强酸性溶液的中和终点。
5. 酚酞蓝:颜色变化范围为黄色到红色,pH变化范围为9.0-10.6。
它通常用于检测碱性溶液的中和终点。
酸碱中和指示剂的应用:1. 酸碱滴定:酸碱中和指示剂在滴定实验中起到了重要的作用。
当滴定剂与滴定样品反应到达中和点时,溶液的pH值会发生剧烈变化,此时酸碱中和指示剂也会发生颜色变化,以提醒实验人员停止添加滴定剂。
2. 环境检测:酸碱中和指示剂也可应用于环境监测。
例如,通过对自然水体(如湖泊、河流)或土壤样品进行酸碱中和指示剂测试,可以评估它们的酸碱性,从而判断它们是否受到污染。
3. 科研实验:酸碱中和指示剂在实验室中的研究工作中具有广泛的应用。
例如,在化学分析中,酸碱中和指示剂可以用于测定样品的酸碱性或中和程度,从而确定其化学性质。
4. 教学演示:酸碱中和指示剂可以被用于教学演示中,以帮助学生直观地理解酸碱性和中和反应。
总结:酸碱中和指示剂具有广泛的应用。
它们能够根据颜色变化来判断溶液的酸碱性,为实验和分析提供了便利。

酚酞的原理
酚酞是一种常用的指示剂,常用于酸碱滴定中。
其化学结构为邻羟基苯酚上连接了一个草酸酯基团。
酚酞的工作原理是基于其在不同pH条件下的颜色变化。
在强
酸性条件下,酚酞呈现无色状态。
随着溶液由酸性向中性pH
过渡,酚酞开始呈现红色。
当溶液的pH值逐渐增加到碱性时,酚酞的颜色变成了深红色。
这种颜色变化是由于酚酞分子的结构和溶液中的氢离子浓度有关。
在酸性条件下,溶液中的氢离子浓度高,与酚酞发生反应形成无色的负离子态酚酞。
当溶液逐渐中性化时,氢离子浓度减少,酚酞开始从负离子态转变为中性分子态,因而表现出红色。
当溶液变为碱性时,氢离子浓度进一步减少,酚酞完全转变为中性分子态,颜色变为深红色。
利用酚酞的这种特性,可以通过观察酸碱滴定反应过程中酚酞的颜色变化来判断滴定终点的达到,从而确定溶液中金属离子或酸碱溶液的浓度。
需要注意的是,在一些碱性溶液中,会出现由于与酚酞形成络合物而导致颜色变化不明显的情况。
此时,通常会选择其他适合于该溶液条件的指示剂来替代酚酞。
酚酞变色机理酚酞变色范围是 pH8.2--10.0,酚酞在强酸性(如浓硫酸)环境中呈现桔黄色,酸性及中性环境无色, 碱性(pH8.2--10.0)呈粉红色,强碱性环境无色。
======================2009年8月11日 修正======================鉴于因为搜索"酚酞变色范围"的浏览量激增,特添加以下内容 酚酞在各种pH 下的颜色如下图:1. 强酸性环境中的橘黄色2. 酸性环境中的无色4. 碱性环境中的红色(8.2-10.0)5. 强碱性环境中的无色(>10.0)3. 滴定终点(≈8.2)8.26. 网上找到的反应原理(点击看原图)====== 照片由"彩色实验室"提供======2010年9月10日修正图片来自/f?kz=1129090520#酚酞是一种弱有机酸,在pH<8.2的溶液里为无色的内酯式结构,当pH>8.2时为红色的醌式结构.酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立即转变成无色的羧酸盐式.所以,酚酞试剂滴入浓碱液时,酚酞开始变红,很快红色退去变成无色.实验表明酚酞在大于2mol/L的氢氧化钠溶液中呈现无色,当遇到氢离子后即可变回红色.另外,酚酞在强酸性溶液中(例如98%浓硫酸)会呈现橙色.以上资料摘自《酚酞在不同条件下的颜色》,中学化学资源网.阅读以下内容可能浪费您的时间。
==================本部分内容于 2010年2月4日修正===================探究酚酞试液在不同酸碱溶液中颜色变化的原因一、实验目的探究经酸性(碱性)漂白剂漂白后的物体是否会遇碱(酸)颜色被还原。
二、实验猜想会被还原。
三、试验用品1.仪器:坩埚、三角架、泥三角、酒精灯、坩埚钳、玻璃棒、脱脂棉、试管、试管夹等2.药剂:金属钠、酚酞试液、稀硝酸、水、稀硫酸、浓硫酸、>2mol/L的NAOH(aq)、新制的氯水、有色花瓣等四、实验过程(一)1.将金属钠置于坩埚中,并加热,钠燃烧,并生成黄色的过氧化钠固体.(如图1-1、图1-2、图1-3)2.加水,反映放热,并生成氧气。
一、实验目的1. 了解酚酞的物理和化学性质。
2. 探究酚酞在不同溶液中的颜色变化。
3. 分析酚酞在不同浓度下的颜色变化规律。
4. 评估酚酞作为酸碱指示剂的适用性。
二、实验原理酚酞是一种常用的酸碱指示剂,它在酸性溶液中呈无色,在碱性溶液中呈红色。
酚酞的颜色变化是由于其分子结构在不同pH值下的转变。
本实验主要研究酚酞在不同溶液中的颜色变化,以及其在不同浓度下的颜色变化规律。
三、实验材料1. 酚酞试剂:1g酚酞固体,溶解于100mL乙醇中。
2. 稀盐酸:0.1mol/L,0.5mol/L,1.0mol/L。
3. 氢氧化钠溶液:0.1mol/L,0.5mol/L,1.0mol/L。
4. 蒸馏水。
5. 试管、滴管、烧杯、量筒、pH计。
四、实验步骤1. 酚酞在不同pH值溶液中的颜色变化(1)取一支试管,加入5mL 0.1mol/L的稀盐酸,用pH计测量pH值。
(2)滴加几滴酚酞试剂,观察并记录颜色变化。
(3)逐渐增加稀盐酸的浓度,重复步骤(2),观察并记录颜色变化。
(4)用蒸馏水稀释稀盐酸,重复步骤(2)和(3),观察并记录颜色变化。
(5)取一支试管,加入5mL 0.1mol/L的氢氧化钠溶液,用pH计测量pH值。
(6)滴加几滴酚酞试剂,观察并记录颜色变化。
(7)逐渐增加氢氧化钠溶液的浓度,重复步骤(6),观察并记录颜色变化。
2. 酚酞在不同浓度溶液中的颜色变化规律(1)取三支试管,分别加入5mL 0.1mol/L、0.5mol/L、1.0mol/L的氢氧化钠溶液。
(2)分别滴加几滴酚酞试剂,观察并记录颜色变化。
(3)重复步骤(1)和(2),将氢氧化钠溶液的浓度分别改为0.1mol/L、0.5mol/L、1.0mol/L的稀盐酸。
五、实验结果与分析1. 酚酞在不同pH值溶液中的颜色变化实验结果显示,酚酞在酸性溶液中呈无色,在碱性溶液中呈红色。
随着稀盐酸浓度的增加,酚酞颜色逐渐变浅;随着氢氧化钠溶液浓度的增加,酚酞颜色逐渐变深。
酸碱指示剂的选择指示剂的颜色变化原理酸碱指示剂的选择与指示剂的颜色变化原理酸碱指示剂是化学实验中常用的一种试剂,通过它们的颜色变化可以判断溶液的酸碱性质。
在选择合适的指示剂时,需要考虑溶液的pH 范围,以及指示剂的反应性和颜色变化原理。
本文将针对酸碱指示剂的选择与指示剂的颜色变化原理展开讨论。
一、酸碱指示剂的选择1. 中性范围指示剂中性范围指示剂可以在接近中性的溶液中发生颜色变化,常用的有酚酞、红石蕊等。
酚酞在pH值在6.8-8.2之间时呈现红色,在低于6.8时呈现无色,在高于8.2时呈现洋红色;红石蕊的颜色则由红变黄再变无色。
2. 酸碱范围指示剂酸碱范围指示剂可以在一定酸碱范围内发生颜色变化,常用的有溴酚蓝、甲基橙等。
溴酚蓝在pH值在5.6-6.8之间呈现绿色,在低于5.6时呈现黄色,在高于6.8时呈现蓝色;甲基橙在酸性条件下呈现红色,而在碱性条件下呈现黄色。
3. 宽范围指示剂宽范围指示剂可以在较广泛的酸碱范围内发生颜色变化,常用的有酚酞蓝、石蕊红等。
酚酞蓝能够在pH值在1.2-2.8之间呈现红色,在低于1.2时呈现浅黄色,在高于2.8时呈现蓝色;石蕊红能够在酸性条件下呈现红色,在碱性条件下呈现蓝色。
二、指示剂的颜色变化原理指示剂的颜色变化原理与指示剂分子内部的化学结构以及与溶液中物质的相互作用密切相关。
1. 酚酞酚酞分子中含有酚性的羟基和酮性的酮基,其颜色变化是通过酚性羟基和酮性酮基的亲电性互相转移电子所致。
在酸性溶液中,酚酞分子被酸质子化,形成无色酚酞酸分子;而在碱性溶液中,酚酞酸分子接受碱质子,形成呈现红色的酚酞阴离子。
2. 红石蕊红石蕊的颜色变化原理是通过氢氧根离子的取代作用引起的。
红石蕊分子中含有两个酚性羟基和一个环状结构,当溶液为酸性时,氢氧根离子(OH-)被酸质子取代,形成无色的红石蕊分子;而在碱性溶液中,氢氧根离子不再取代,从而呈现黄色。
3. 溴酚蓝溴酚蓝分子中含有溴酚基和苯酚基,其颜色变化主要由氢氧根离子的取代作用引起。
酚酞指示剂变色原理的计算化学实验研究酚酞指示剂变色原理的计算化学实验研究一、引言酚酞(Phenolphthalein)是一种广泛应用于酸碱滴定的指示剂,其在酸性溶液中呈无色,而在碱性溶液中则呈现出明显的紫红色。
酚酞的变色原理一直是化学领域内的热门研究课题之一,通过计算化学实验研究其变色机理,有助于深入了解其分子结构和物理特性,进而提高酸碱滴定实验的准确性和可控性。
二、实验方法1. 酚酞的结构模拟首先,通过计算化学软件几何优化酚酞分子的结构,获得最稳定的构型。
然后,利用量子化学方法计算酚酞分子的电子结构、能量和振动波数。
2. pH值的计算通过计算化学软件模拟不同浓度的酸性和碱性溶液,计算其对应的pH值。
根据计算结果,选择合适的酸性和碱性溶液供后续的实验研究使用。
3. 酚酞变色机理的计算建立酚酞分子在酸性和碱性条件下的模型,并利用分子动力学模拟方法,模拟溶液中的分子运动轨迹、分子间相互作用等。
通过模拟实验,研究酚酞分子在酸碱环境下的构象、电荷分布、氢键和离子态形成等因素的变化规律。
三、实验结果与分析1. 酚酞分子的结构模拟结果显示,其主要由苯环和酞环组成,酞环中的两个羟基与苯环上的一个羟基形成氢键结合。
2. pH值的计算结果表明,当浓度为0.1 mol/L时,HCl 溶液的pH值约为1.0,NaOH溶液的pH值约为13.0。
3. 酚酞分子在酸性溶液中,羟基上的氢原子对周围水分子起到供体作用,形成氢键。
而在碱性溶液中,羟基上的氢原子被氢氧根离子取代,使酚酞分子失去了氢键的形成。
四、实验结论通过计算化学实验研究,我们得到了酚酞指示剂变色原理的一些重要结论:1. 酚酞变色机理主要与其分子结构中的羟基形成氢键有关;2. 酚酞在酸性溶液中,羟基上的氢原子形成氢键,使酚酞分子呈无色,而在碱性溶液中,羟基上的氢原子被氢氧根离子取代,导致酚酞分子呈紫红色;3. 酸碱溶液的pH值对酚酞变色起到决定性影响。
这些结论为酸碱滴定实验的准确性和可控性提供了理论基础,对于进一步优化酚酞指示剂的设计和应用具有重要意义。
酚酞在不同pH 值溶液中的颜色
陈晓勇摘录于网络内容
酚酞键线式:
O O
HO
OH
酚酞是一种弱有机酸,分子式为C 20H 14O 4,在pH <8.2的溶液里为无色的内酯式结构,当pH >10时为粉红色的醌式结构,是一种常用的酸碱指示剂。
酚酞的醌式或醌式酸盐,在碱性介质中很不稳定,它会慢慢地转化成无色羧酸盐式;遇到较浓的碱液,会立即转变成无色的羧酸盐式。
所以,酚酞试剂滴入浓碱液时,酚酞开
酚酞为白色或微带黄色的细小晶体,难溶于水而易溶于酒精。
因此通常把酚酞配制成酒精溶液使用。
当酚酞试剂滴入水或中性、酸性的水溶液时,会出现白色浑浊物,这是由于酒精易溶于水,使试剂中难溶于水的酚酞析出的缘故。
酚酞是通过邻苯二甲酸酐与两分子的苯酚在浓硫酸加热的情况下缩合制得的。
这个方法由阿道夫·冯·拜尔于1871年发现。
O O
HO
OH
OH O O O
+
2
H 2SO 4+H 2O。