元素及其化合物专题复习指导
- 格式:docx
- 大小:59.28 KB
- 文档页数:7
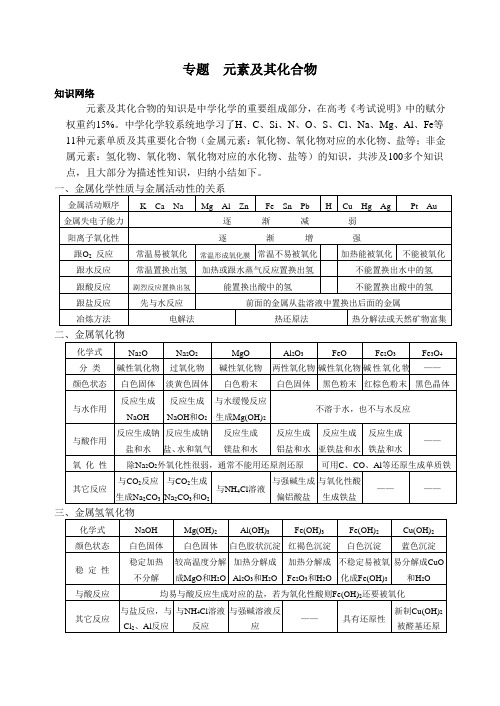
专题元素及其化合物知识网络元素及其化合物的知识是中学化学的重要组成部分,在高考《考试说明》中的赋分权重约15%。
中学化学较系统地学习了H、C、Si、N、O、S、Cl、Na、Mg、Al、Fe等11种元素单质及其重要化合物(金属元素:氧化物、氧化物对应的水化物、盐等;非金属元素:氢化物、氧化物、氧化物对应的水化物、盐等)的知识,共涉及100多个知识点,且大部分为描述性知识,归纳小结如下。
学法点拨元素及其化合物的知识是中学化学的核心内容,它是基本概念、基本理论、化学计算、化学实验等知识的载体,反过来,这些知识的掌握又有利于理解和巩固元素化合物知识。
要较好地解答有关元素化合物的习题,必须注意以下三个方面:1.从知识准备上讲,平时的学习中必须注意:对同族元素....,要深刻领会其相似性和递变规律,特别关注各自的特殊性,如卤素学习中要重点掌握单质与金属等反应的相似性,氢化物的稳定性、卤化银的溶解性等的递变规律,氟和碘的有关特性;对同类物质....,要认真理解其具有某些通性(共性)的原因,如何应用各自的特性进行鉴别,如酸的通性、碱的通性、铵盐与碱反应和铵盐稳定性等,它们具有通性的原因是由于分别含有相同的H+、OH-、NH4+离子,而与之匹配的酸根离子、金属离子各不相同,又具有各自的特性;对相似或相近的物质........,要详尽分析其组成微粒和微粒结构,由此推导其性质,进行全面比较、归纳,认识它们的区别和联系,如液氯和氯水,氧化钠和过氧化钠等。
此外,还要注意物质的重要用途及环境保护等热点问题。
2.从思维过程上讲,在分析有关元素化合物的问题时,必须紧紧抓住组成结构决定性质、变化,性质、变化决定制法、用途这一化学思维主线。
学习中,对物质的性质、变化要联系理论知识进行分析理解,充分挖掘理论知识对学习元素化合物知识的指导作用,对物质的重要用途要从它的性质、变化上加以认识,对化学实验要仔细分析实验原理、认真解释预期的或反常的实验现象、合理进行结论推断,提高自己的分析判断能力。



浅谈元素化合物知识复习的几点做法元素化合物知识包括元素及其单质、化合物的组成、结构、性质、变化、用途、存在、制法等内容。
在复习时, 尽量将学科内知识有机结合, 充分了解学科内各知识之间的内在联系。
同时注重学科间的综合、渗透, 训练分析问题、解决问题的科学方法。
在复习落实“四个强调”。
一、强调化学用语的书写我们知道, 课本有关元素化合物的知识内容, 大都是通过概念、命题、符号的形式来表述的。
也有部分学生把化学称之为理科中的文科, 花大量时间对元素化合物知识记忆。
而表述知识内容的形式往往是化学用语。
物质的组成、结构、性质变化以及变化过程中的质量、能量守恒均可用化学用语来表述。
用部分同学的话说, 学化学的感受, 很大部分来自于把物质世界用符号化描述, 用符号展现了“物质形象”, 用符号展现物质的“行为艺术”。
虽说同学们对化学用语学习很重视, 但化学用语内容表述的多样性, 不同表述的不可替代性, 使得你们用化学用语表述时常出现“张冠李戴”或“词不达意”。
多少聪明的同学悲壮而又无奈地说: “我做(写)错了, 其实我想到了。
”因此, 复习元素化合物知识时, 每一章节重要物质的相关化学用语内容, 你们须认真领会, 书写, 并四五人一组相互批改矫正, 易错难写的知识点收集起来张贴, 并进行重复训练。
二、强调知识网络结构的构建化学课本对元素化合物性质的陈述, 主要以单质、氢化物、氧化物、酸、碱、盐或以元素化合价变化二条主线来构成物质间性质联系的。
因此, 在复习中, 我们要用简明的网络结构来体现各章节主要物质的相互联系, 从而快速、全面、准确地展示各章节物质性质的概况, 整体把握知识的脉络。
三、强调学以致用化学知识内容与人们的生活、生产实际密切相关, 化学为自然科学的发展以及社会进步有具大贡献。
学习不仅仅是记住已记载的信息, 而应学有所用, 学以致用。
因此, 在元素化合物知识复习中, 应找些以鲜明的“背景材料+学科知识+学科能力”的材料, 让学生阅读改进, 扩大知识面, 开阔视野, 培养解决实际问题的意识和能力, 形成知识、规律、方法、技巧的思维能力的训练。

高三化学总复习第四部分元素及其化合物复习元素及其化合物复习方法元素及其化合物知识繁杂、头绪纷乱,不易掌握,归纳总结至关重要。
复习元素及其化合物知识要从以下四方面入手:1.原原本本看书按以下顺序:非金属——第Ⅶ主族卤素、第Ⅵ主族氧、硫、第Ⅴ主族氮磷、第Ⅳ主族碳硅。
金属——碱金属钠、镁、铝、铁不动笔不看书。
要一边看书,一边动手书写、抄录、整理。
对于某些物质的得特殊性质、重要用途要格外注意。
要先看书总结,后做题,不要一边做题一边翻书。
2.纵向知识网络总结通过知识网络总结,抓住各物质的化学性质、制轩、用途及各物质间的相互关系。
编织网络要由点连线、由线织网。
(点——非金属:单质、气态氢化物、氧化物、含氧酸、含氧酸盐。
金属:单质、氧化物、碱、含氧酸盐。
)3.横向表格比较通过横向比较,抓住同类物质间的异同,即找出共性,做到举一反三,触类旁通;找出个性,具体情况具体分析,找出解题关键。
通过以上看书、织网、比较,可以使元素化合物知识条理化、系统化、网络化。
4.抓住重点、难点和易错点在全面、系统复习的基础上,要抓住各族知识的重点、难点和易错点,增强复习的针对性和实效性。
非金属复习一、横向表格比较(一)单质:(二)非金属气态氢化物:HCl H2S NH3CH4化学性质水溶液酸碱性和水酸通性和金属和酸反应:和盐反应:和碱和碱性氧化物和盐氧化性(H+)——还原性和氧气和其它——备注溶解性气味气味毒性溶解性气味制备——————(三)非金属氧化物:SO2SO3NO NO2P2O5CO CO2SiO2化学性质酸酐通性和水——————和碱——————氧化性2NO+2CO=N2+2CO2——————还原性—————————特殊性制备————备注不是酸酐不是酸酐不是酸酐(四)典型含氧酸:H2SO4H2SO3HNO3H3PO4H2SiO4H2CO3HClO化学酸性强弱比较H2SO4H2SO3H2SiO3HNO3>H3PO4>H2CO3>HClO酸通和金属和碱性氧化物——————二、纵向知识网络总结(写出相应的化学方程式或离子方程式)(一)氯及化合物(二)硫及其化合物(三)氮及其化合物(四)磷及其化合物(五)碳及其化合物(六)硅及其化合物三、几个要点(一)第ⅦA族1.卤素单质的颜色F2Cl2Br2I2单质水溶液——萃取剂中————(C6H6CCl4)2.Cl2的实验室制法(见实验部分)原理:原料:装置:(发生、净化、收集、尾气处理)3.漂白粉(漂白精)的制取、成分、保存、漂白原理4.卤族元素的比较:物理性质:(二)第ⅥA族1.价态体系(氧化还原反应)2.浓H2SO4与稀H2SO4氧化性比较浓H2SO4稀H2SO4起氧化作用的元素还原产物能被氧化的物质氧化性强弱选择能被氧化的物质填入空格中①活泼金属②金属③某些非金属单质如C、S等④某些含低价元素的化合物,如H2S、S2-、I-、Fe2+等3、H2O2的弱酸性、氧化性、还原性、漂白性、不稳定性例题:下面四个涉及双氧水的反应(未配平):A.Na2O2+HCl——H2O2+NaClB.Ag2O+H2O2——Ag+O2+H2OC.H2O2——O2+H2OD.H2O2+Cr2(SO4)3+KOH——K2CrO4+H2O+K2SO4①H2O2只体现氧化性的反应是(填序号)____________。

元素化合物知识的复习建议一、按照以下规律来掌握某种物质的性质1、物理性质:色、味、态、溶解性、熔沸点2、化学性质(1)先分类→所属类别的通性(2)看化合价的可变性→氧化性或还原性(化合价的可变性)(3)稳定性(4)特性3、与社会生活、生产、环境的关系(用途)二、记忆所属类别的通性1、单质(1)非金属单质的性质(卤素、H2、O2、N2、S、Si、C)①非金属单质+金属单质→盐(氧化物)②非金属单质+氧化物(H2O、某些金属氧化物)③非金属单质+氧化性酸→气态非金属氧化物+水(2)金属单质的性质(Na、Al、Fe、Cu)①金属单质+非金属单质→盐(氧化物)②金属单质+H2O→碱(金属氧化物)+氢气③金属单质+ 非氧化性酸→盐+ 氢气(金属活动顺序表中H前金属)金属单质+氧化性酸→盐+ 水+气态非金属氧化物④金属单质+ 盐(可溶)→新金属+ 新盐(活动性:金属单质〉新金属)金属的冶炼:依据金属活动顺序表电解熔融态化合物—Al前金属热还原法:Zn—Pb加热法:Cu—Ag2、氧化物(1)非金属氧化物(CO、CO2、NO、NO2、SiO2、SO2)酸性氧化物的性质(CO2、NO2、SiO2、SO2)①酸性氧化物+水→酸②酸性氧化物+碱(可溶)→盐+水③酸性氧化物+碱性氧化物→含氧酸盐(2)金属氧化物(Na2O、Na2O2、Al2O3、FeO、Fe2O3、Fe3O4、CuO、CaO、MgO)碱性氧化物的性质(Na2O、Na2O2、FeO、Fe2O3、CuO、CaO、MgO)①碱性氧化物+水→碱(可溶)②碱性氧化物+酸→盐+水③碱性氧化物+酸性氧化物→含氧酸盐(3)两性氧化物(Al2O3)①两性氧化物+酸→盐+水②两性氧化物+强碱→盐+水3、氢化物(HX、H2O、NH3、H2S、H2O2)(1)易溶于水呈酸性HX 、H2S;呈碱性:NH3(2)化合价还原性:HX、NH3、H2S还原性和氧化性:H2O24、酸的性质(HCl、H2SO4、HNO3、HClO、H2SiO3)(1)与指示剂作用紫色石蕊溶液:紫色→红色无色酚酞溶液:无色→不变色(2)非氧化性酸+ 金属单质→盐+ 氢气(金属活动顺序表中H前金属)氧化性酸+ 金属单质→盐+ 水+气态非金属氧化物(3)酸+ 碱性氧化物→盐+ 水(4)酸+ 碱→盐+ 水(5)酸+ 盐→新酸+ 新盐(强酸制弱酸,不挥发性酸制挥发性酸)5、碱的性质NaOH、Fe(OH)2、Fe(OH)3、Ca(OH)2、NH3•H2O(1)指示剂作用紫色石蕊溶液:紫色→蓝色无色酚酞溶液:无色→红色(2)碱(可溶)+ 酸性氧化物→盐+ 水(3)碱+ 酸→盐+ 水(4)碱(可溶)+ 盐→新碱+ 新盐△(5)不溶性碱→金属氧化物+水6、两性氢氧化物Al(OH)3(1)两性氢氧化物+酸→盐+ 水(2)两性氢氧化物+强碱→盐+ 水7、盐的性质(Fe2+、Fe3+、NH4+、Na2CO3、NaHCO3、Na2SiO3、CaCO3)(1)盐(可溶)+ 金属单质→新金属+ 新盐(活动性:金属单质〉新金属)(2)盐+ 酸→新盐+ 新酸(强酸制弱酸,不挥发性酸制挥发性酸)(3)盐(可溶)+ 碱(可溶)→新盐+ 新碱(生成物任一不溶或产生气体)(4)盐(可溶)+ 盐(可溶)→新盐+ 新盐(生成物任一不溶)示例:SO21、物理性质:色(无色)、味(刺激性气味)、态(气态)、水溶性(可溶于水)、密度(大于空气)、沸点(低,易液化)、2、化学性质类别:非金属氧化物(酸性氧化物)(1)酸性氧化物的通性①酸性氧化物+水→酸SO2+H2O====H2SO3(可逆反应)②酸性氧化物+碱→盐+水SO2+2NaOH====Na2SO3+H2OSO2+Ca(OH)2====CaSO3+H2O③酸性氧化物+碱性氧化物→含氧酸盐SO2+CaO====CaSO32、化合价:+4(中间价态),因此SO2既有氧化性也有还原性氧化性:SO2+Cl2+H2O===H2SO4+HCl(SO2气体通入氯水中)催化剂还原性:SO2+O2======SO3(可逆反应)△3、特性:毒性、漂白性4、形成酸雨、做漂白剂三、选择题训练收集高考、高三模拟文理基题进行同知识点的题组变形训练;对常见题型进行专项训练:如阿伏加德罗常数、离子方程式、离子共存等。
高三元素化合物如何复习化学学习原则是根据学习任务、学习规律和总结化学学习经验,而对学习化学提出的基本法则。
那么,在学习上有什么方法吗?下面给大家分享一些关于高三元素化合物如何复习,希望对大家有所帮助。
高三元素化合物如何复习1、学习课标,解读教材编写用意。
课程标准按性质的不同将元素分为金属和非金属两大类,将元素化合物的知识编排为“金属及其重要化合物”和“非金属及其重要化合物”两个内容,教材对应旧教材中的卤族、氮族、氧族、碳族、碱金属等,以及镁、铁、铜等元素。
教材的编排弱化的“族”的概念,对元素化合物的化学性质没有要求面面俱到,只强调学习和掌握常见元素及其化合物突出的一些特征反应,与课标保持一致。
在苏教版教材中,主要介绍基本的或典型的化学事实,如物质的物理性质或者化学性质、物质的用途及物质在生产生活中的应用、与社会的联系,并不追求知识的知识性和连贯性,注重知识的实用性和有效性[2]。
2、利用“建构主义”的原理,科学整合复习教材。
单一的命题或者事实按照一定逻辑或者线索组织成块的知识。
与其让高三同学单一复习某种元素化合物知识,不如将这一单一知识组织成块,让高三同学对元素化合物形成一个完整的认识结构体系。
高三对元素化合物的复习就不能对课本内容简单重复,而要从更高角度对各章节考点进行分析、比较、归纳、整理,形成完整清晰的体系。
3、利用线索将元素化合物知识整合成块。
元素化合物知识虽然零散,但它们之间存在一定的联系,找出一定方法可以整合。
首先,用分类、价态思想组织元素网络图,同一元素在单质及化合物中有化合价高低顺序,金属元素按照金属—氧化物—碱—盐,非金属按照氢化物—单质—氧化物—酸—盐。
如此,将硫元素转化线理清,碳和氮元素的复习套用该转化模式将水到渠成。
又如二氧化碳作为酸性氧化物的性质理清后,二氧化硫与其有很大的相似,在此基础上通过化合价的分析,抓住共性和特性,高三同学的逻辑思维方面是可以互相联系的。
其次,元素化合物的性质由结构决定,性质又决定其存在、制法、用途及保存方法。
高三元素及化合物复习教学建议说明:(1)、镁在考试大纲中没有做要求,但是在必修2中提到,考试中也时有呈现,我觉得就把教材中的镁知识弄清楚就可以了,不用展开学习。
例如:(2012年新课标9)D 常温常压下,22.4氯气与足量镁粉充分反应,转移的电子数为2N A (2015新课标2.12)海水开发利用的部分过程如图所示。
下列说法错误的是C .工业生产常选用NaOH 作为沉淀剂(2015重庆卷)第2题C 选项,Al 2O 3和MgO 均可与NaOH溶液反应) (2)、对于元素及化合物的考察,重点考察单质及其重要化合物的主要性质及应用,我认为重点放在必修一、必修二,选修4上,以课本为中心,熟练掌握课本知识就可以了,不必展开。
对于选修二工业原理,重庆卷考察比较多,全国一卷略有考察。
选修二复习时,我们就按照重庆卷内容复习就足够了。
主要就是纯碱工业、硫酸工业、硝酸工业、金属铁、铝冶炼工业、氯碱工业等。
考察卤素氯气、溴、碘,二氧化硫、硫酸;铵盐,、硝酸、碳酸盐、碳酸氢盐、二氧化硅、硅酸,铁单质重庆卷对元素单质及化合物考察,分值基本不变比较平稳,都控制在17分左右。
主要考察卤素次氯酸根、氯气、溴,硫的氧化物,氮氧化物,硝酸盐,硝酸、铵盐,硅,二氧化硅,硫酸盐、碳酸盐、碳酸氢盐、质化合物(铁盐、铝离子)性质、铝的冶炼,氮化合物氨气、铵盐、硝酸,硫化合物浓硫酸、硫化物、亚硫酸盐性质,卤素单质性质。
结论:全国卷与重庆相比总体相差不大。
2.1 知识点的考查符合教材、大纲和考纲试题中对知识的考查完全符合教材、大纲和考纲,并且绝大多数都是教材中基本内容、主干内容。
(2013新课标1)28.(15分)回答下列问题:(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。
工业上从铅土矿制备较高纯度Al2O3的主要工艺流程是(以化学方程式表示)。
来源于必修2 P93(2015新课标2)12.海水开发利用的部分过程如图所示。
高三化学复习辅导(元素及其化合物部分)
重要考点与认知要求:
1、了解这些元素的单质和氢化物的重要性质,并进行比较。
2、了解这些元素的氧化物的重要性质。
3、以Na2O2为例,了解过氧化物的性质。
4、掌握硫酸和硝酸的制备原理、性质和用途。
5、了解磷酸和硅酸的主要性质和用途。
6、了解常见盐类的性质和用途。
7、了解常见化肥的基本性质。
8、了解硫、氮、碳的氧化物对大气的污染,以及防止大气污染。
9、了解一些生活用水的净化及工业污水的处理方法。
复习要点:
1、要掌握以下重要物质的相互关系。
(1)有关O2、H2、H2O、H2O2的转化关系。
(2)硫及其重要化合物
(3)氮气其重要化合物
(4)磷及其重要化合物
(5)碳及其重要化合物
(6)硅及其重要化合物
2、非金属的单质、氢化物、氧化物往往在常温下呈气态,因此对于它们的实验室制法、性质、主要用途作一归纳是十分重要的。
3
NaCl+N
2NaCl+H2SO4Na2SO4+2HCl↑
CaCl
注:
①因为C2H2、C2H4的气体密度很接近空气,所以不宜用向下排气法收集。
②因为NO极易与空气中氧气反应生成NO2所以只能用排水法收集。
思考:对于NH3和HCl这2种污染性气体的尾气吸收装置为什么要选用倒置的漏斗?。
下笔如有神读书破万卷________________________________ 元索及其化合物专题复习指导李德文长沙市一中高考走向近几年高考题的特点之一是加强了元素知识与基本概念和基本理论的结合,故元素的单质及其化合物知识在高考中的考查要求逐渐提高。
而这部分的知识内容繁杂、零碎、分散,同学们难以系统掌握和运用。
知识点拨在高三复习时,米用“知识主线知识点知识网”的方式复习,将会收到良好的复习效果。
一、抓住主线,系统掌握元素化合物部分的知识点分散,可采取两条复习主线的方法复习。
第一为“知识主线一一知识点”。
通过每一族典型物质的复习,把它按物质的分类连成主线。
知识点清晰,便于记忆,掌握较系统。
第二以解题思路、思维过程为主线,重在加强思维品质的锻炼。
在复习元素的单质及其他合物时首先列出以下知识主线:1 •非金属知识主线单质 态物 化气氢氧化物物的物化应化 氧对水HCICl 2 = --------------> HClOf H?S* NH 严23oo 相应 的盐NaClO Ca(ClO)2 Na z SO 3 Na.SO, NaNO.円1严 P —P2()5~*H3POL CH- — C — CO co 厂H2COL SiH4* Si —Si()L HzSiOL 2・金属知识主线 Ca(H 2PO 4)2CaHPOqCa 3(PO 4)2 CaCO,Ca(HC()3)2 Na 2SiO.单 M 氧化物器f 化 f 对应的 — 贝物 水化物相应的盐NaOH->Na ?CO 3NaHCO.下笔如有神读书破万卷氧化物氧化物对的应一水化物MgO^ AI2O3FeO 佻2()3~ FeQo Cu,(> CuO Fe (OH) 2Fe(OH)3Cu(()ITb~相应的盐MgCl2A1CLNaA102FeSOqFc^CSOO.CuSO,元素性质递变的关系,重点掌握典型金属与典型非金属在周期表中的位置与关系”。
这就进一步要求我们在复习中重视理论知识与元素知识的结合运用。
所以在形成知识主线的基础上,教师重点放在结合化学理论复习典型元素化 合物,并以此带动全局知识的复习,掌握复习方法,培养自学能力。
更有利于解 决高考中守纲不守本的新信息题,有利于发挥迁移能1格式进行联想复习。
力, 预测未知元素。
复习知识点时按图图1 知识点联怒复习框图二、形成网络,提高能力近几年高考题中多个知识点用多种形式联系在一起的选择题、框图题、计算题、实验题的考查份量逐渐加大。
所以,将知识点进行比较、进行网络 化十分重要。
尤其对观察能力、思维能力、解题能力的培养是很有 帮助的。
典 型例题;,而工厂仓库内存有大量的 MgCll 、某厂得知市场紧缺无水 例2、盐酸和炭。
于是技术科设计了二种制备工艺,进, MnOMgO , NHCW )技术科设计的制备1行试产后,投入生产,使工厂扭亏为盈。
试问:(加盐酸,生 MgO 工艺是哪二种(用反应方程式表明流程。
但请注意,用,加热脱结晶水时 会发生水O •MgCl 成溶液,蒸发析出晶体为 MgCl6H 222 )评估此二种工艺的 经济效益。
解现象)? ( 2下笔如有神读书破万卷 ____________________ ________二门甲法:忙的+肚IC1二M R C12 + H ?O 厳縮结晶为M 国Ch FH 心MgCl t • 6H 3O+ NH,CI+NH, * +HC1 f 十3HQ禅逸出的气体冷却冋收用 Mn<}J -F4Ha = MhCI J +Cl i t + ZHQ 肋* 4-Clj J MgCl ;(2)^法经济效雄烏•使料利用率岛JI N1I.CI 网收*能源谊狂低】乙法能辭梢桎大・U 门;需 札放C 例2、化合物A 的焰色反应为黄色,遇盐酸有无色刺激性气体--- ■存在 -- •制法原子结构作如A溶液,反应后得化合物B的溶液,再对B出,将硫粉加入沸腾的下实验:、的溶液滴加盐酸,溶液变浑浊,同时有气体C放出;b a.取少量B的条件下,将物质的量浓度相等的硝酸银溶液和77或稍大于在pH等于的体积比混合,有白色沉淀生成,且沉淀的颜色逐渐发生:1B溶液以黄如下变化:白黑,在沉淀颜色发生变化的过程中,溶逐渐显酸性,且酸性不断增强;c.另取少量硝酸银溶液,向其中不断地加B的溶液至过量,开始有白色沉淀生成,后来沉淀逐渐消失,生成白色沉淀和沉淀消失的过程中,溶液的pH基本保持不变。
(1)请写出下列反应的化学方程式:①B的生成;②B跟盐酸反应;③生成白色沉淀;④沉淀变色;⑤白色沉淀消失(2)沉淀变色的过程中,溶液酸性不断增强的原因。
(3)沉淀颜色为何不断变化,最终成黑色其原因?蘇噩思躍:①焰色反应呈枝色是N&、无邑姻滋性气悴C圧SO:.由此推知J&N肌在N去SO’十B反应中”化合物B的价态比0价至+」价之间•而柠见硫的柄社牝令物中符合卜述价态的只右血岛5、即为氐②这胆必須补充一点鼻賞有配合性•能和忍门孑形成[利⑸OjJ-配离子.若等物西的戢诫度啊A肿 6 E j iSWW 2 ' }的体积比混*生成的白邑阮握只能是入心缶①斥是过盘的矶谱液•剤形成jf配合物电菱慙侶口)乙③Agj&O,的H色拭淀的濒色变比由白游萤f茵棕"感・可由FcCOHl^FtfOH).的頰亀璧化中得到启块,措趙黑色就圧变比的产物的缆逼•餵邑邂渐加擬是严覇的陆斷爹的过稈”在聽的比合物中为黑色的股是命畠織化输■茂黑邑樹质昂舷風男一产物是展.由于査化血朝中酸性不斷增强*可斷宦捷从产物逆向思蓉,运用元*守垣,可推知反症物之星元索人沉淀变色的方程式是山乐禺a + +H=S6. j 至干恥所问他韓很済菸知识过关1.朱砂(又名丹砂)是一种红色的颜料,它是某种金属的高价化合物现通过以下实验来确定朱砂的组成:下笔如有神读书破万卷_____________________________的化学)B E) A C的离子方程式;(3 (1)朱砂的化学式是;(2方程式。
-2-+(3 ) 3Hg + + 2Br +S0(2 ) S01) HgS; + Br + 2HO = 4H ;(答案:(4222 )+ 2NO T + 4HO8HNO(稀)=3Hg (NO )2233.荷兰是一个沿海的低地国家,在政府的支持下,地球化学家奥林2夫•斯却林教授正在从事用化学手段抬高沿海地区的海拔高度的研究, 以永久性 地解决海水淹没陆地的威胁。
其方法是根据分子数目相同的情况下, 硫酸钙比碳 酸钙的体积大一倍的事实,用废弃的硫酸灌入地下的石灰 岩层中实现的。
写出反应的化学方程式和离子方程式。
2-+ 2H+SOO +CO T;CaCO +(答案:CaCO+ HSO= CaSO +H42342324 +HO+CO T) =CaSO 242镁在空气中充分燃烧,为了分析燃烧产物的成分做如下 9. 6g 3、将 实验:f m 博于过最盐酸工NaOH 加热上—-亠亠空气中燃烧严:甲 ----------- 丙 ----------- 有氨气生成 S——~*丨丁 溶于过粧盐威 十 加过亠 锻烧r“ 〔乙 -------------- 丁 ----------- > 戊一乙f d 赳说淀](1)写出物质甲、乙、丙、丁、戊的化学式;,戊4 gSOH,硫酸增重3. (2)若将上述实验生成的氨气通过稀42固体,求镁燃烧的混合物中甲与乙的物质煅烧 到质量不再变化时得到8g 的量之比;3)写出甲变化为丙的化学反应方程式。
(;2; (2 ) 1: Cl 、NH 、MgCl 、Mg(OH)N (答案:(1 )Mg 、MgO 23224 ) + 8HC1 =3MgCl+ 2NHClN(3 )Mg 4232 的如下图各步反应中,最 A 和A 是同一周期的元素.在 4、A 和A 11和 D 均为白色沉淀。
后生成的D 1CL、::Mg(OH)、 A Al 、、MgMg (答案:A :、B : N C.: MgCI D 13222 :. AlCl.C ) (SOAI : B 、: DAI (OH)) 31313421.读书破万卷下笔如有神 ______________________________5、现有属于酸、碱、盐类的四种化合物A 、B 、C 、D 。
根据下列实验事实判断各是什么物质。
(1)A 与B 在试管中混合微热,产生在空气中会形成白雾的稳定气态 氢化物E 。
ZVB▼B过童Na.CO 胡片试推断:D ;、B 、C 、A 。
B 、CD A 、1111(2) B与C共热会产生气态氯化物F, E与F能直接化合生成盐。
( 3) A 与C 两种稀溶液混合会产生不溶于D 的白色沉淀。
( 4) D 的稀溶液与金属反应有气体生成,但不产生氢气。
( 5) E 的水溶液加入AgNO 溶液产生不溶于D 的白色沉淀。
3试推断:A、B、C、D 。
(答案:HSO 、NHC1、Ba(OH) 、HNO ) 32442.。