7.活化能
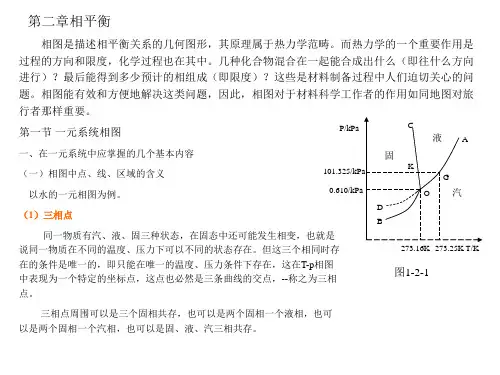
图8给出了两个不同温度下的分子(或原子)能量的基本分布。可以看出
是能量为Ea或者能量比Ea大的分子或原子的比例。阿累尼乌斯等式告 诉我们当且仅当相互反应的物质间至少存在临界能Ea。因为含有这种能量的或者
更大能量的粒子的比例是
,所以反应速率正比于该式。
当Ea值增加的时候,需要的能量也增加,并且分子要获得这种能量也变得更
(1)在反应结束时,化学上并不发生改变 (2)只能需要极少的量 (3)催化活性是常常正比于它的表面积 (4)催化剂是有选择性的:如果出现不同的反应,催化剂可以在不影响其
积分:
或者,
得: +常数
当t=0时,取c=co,我们有常数=ln co.并且:
或者:
也可以写作:
图3 反应率与浓度的关系
从上面我们可以看到在H2O2分解的反应中, (ln c)-t 的图像是一条直线(图3.)。 它是一级反应的特征-----浓度指数(n)是“1”。
4
一级反应: 放射性衰变 等式:
课件(八)
记住:在所有的动力学和热力学的计算中,必须使用“绝对温度尺度”开尔文 (K)表示,它与摄氏温度的关系为: K = oC + 273.16 因此, 0K = –273.16 oC,它与热力学绝对温度对应.logk VS 1/T的线性图揭示 出了以下关系:
在后面的推导重,这个经验关系可以方便地写成:
其中A是比例常数,有时被叫作反应常数;R是气体常数其值等于8.31 J/mole K; E是反应活化能,单位是J/mole K;而e是自然对数的底数。因为ln x = 2.3 log10x, 我们可以将上式重新写成:
6. 阿累尼乌斯理论
阿累尼乌斯提出的分子反应理论主要为定性的理论,这让我们得出了速率常 数的经验表达式。后来的理论(这在3.091课程范围之外) 阐述更详细并且使原来 的观点更加定量。