陌生方程式的书写素材
- 格式:pptx
- 大小:2.17 MB
- 文档页数:21


高中化学讲座:陌生方程式的书写陌生方程式的书写在书写陌生方程式时,需要遵循以下基本原则和步骤:1.判断好反应物(氧化剂、还原剂)和产物(氧化产物、还原产物)。
2.电子得失守恒。
3.电荷守恒。
4.原子守恒。
接下来是一些练:1.铜屑放入稀硫酸中不发生反应,但在稀硫酸中加入H2O2后,铜屑可以逐渐溶解。
该反应的离子方程式为:Cu + H2O2 + 2H+ → Cu2+ + 2H2O。
2.将20 mL 0.5 mol/L K2SO3溶液逐滴加入到20 mL 0.2mol/L KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。
反应的离子方程式为:2MnO4- + 5SO32- + 6H+ → 2Mn2+ +5SO42- + 4H2O。
3.CO是工业上常用的还原剂。
在500℃时,在催化剂作用下,11.2 L(标准状况)SO2与CO发生化学反应,转移了2×6.02×1023个电子。
该反应的化学方程式为:SO2 + 2CO →S + 2CO2.4.在氢氧化钠的环境中,氯气与碘化钠反应,每1摩碘化钠完全反应转移6XXX。
反应化学方程式为:3Cl2 + NaI +6NaOH → NaIO3 + 6NaCl + 3H2O。
5.氮气的实验室制法是用氯化铵(NH4Cl)与亚硝酸钠(NaNO2)反应,同时生成氯化钠和水。
该反应的化学方程式为:NH4Cl + NaNO2 → NaCl + 2H2O + N2↑。
6.氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式:NO3- + 4H+ + 3e- → NO + 2H2O。
KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
1) 该氧化还原反应的方程式为:14HNO3 + 3Cu2O →6Cu(NO3)2 + 2NO↑ + 7H2O。
2) 反应中硝酸体现了氧化性质。
3) 反应中产生了0.2 mol气体,转移电子的物质的量是0.2/2=0.1 mol。

陌生化学方程式书写专项练习1.(东I)S2Cl2与水反映,有无色刺激性气味气体产生,并有黄色沉淀生成,该反映的化学方程式是。
2.(东I)欲降低废水中重金属元素铬的毒性,可将Cr2O72−转化为Cr(OH)3沉淀除去。
工业用电解法来处置含Cr2O72−废水。
阳极反映式是Fe-2e-=Fe2+,阴极反映式是2 H+ +2e-=H2↑。
Fe2+与酸性溶液中的Cr2O72−反映的离子方程式是,取得的金属阳离子在阴极区可沉淀完全。
3.(西I)通空气的条件下煅烧铬铁矿(主要成份可表示为FeO·Cr2O3)和NaOH的固体混合物生成Na2CrO4和NaFeO2反映的化学方程式是。
4.(朝I)石灰乳中通入Cl2 ,取得Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反映的化学方程式是。
5.(朝I)CaCl2溶液中通入NH3和CO2两种气体后,生成超细CaCO3的化学方程式是。
6.(海I)将含Cr2O72﹣的废水调至pH为2~3,再加入Na2S2O3溶液(转化为SO42﹣),该反映发生时,每mol Cr2O72-转移mol e-,该反映的离子方程式为。
7.(丰I)铁屑与石墨能形成微型原电池,SO32—在酸性条件下放电生成H2S进入气相从而达到从废水中除去Na2SO3的目的,写出SO32—在酸性条件下放电生成H2S的电极反映式:。
8.(石I)氨气在纯氧中燃烧,生成一种单质和水,试写出该反映的化学方程式。
科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是(填“正极”或“负极”);碱性条件下,该电极发生反映的电极反映式为。
9.(东II)已知Na2S2O3溶液与Cl2反映时,1mol Na2S2O3转移8 mol电子。
该反映的离子方程式是。
10.(西II)SO2气体通入足量BaCl2和硝酸的混合溶液中,生成白色沉淀和无色气体,反映的离子方程式是。
11.(西II)直接加热AlCl3·6H2O不能取得无水AlCl3。

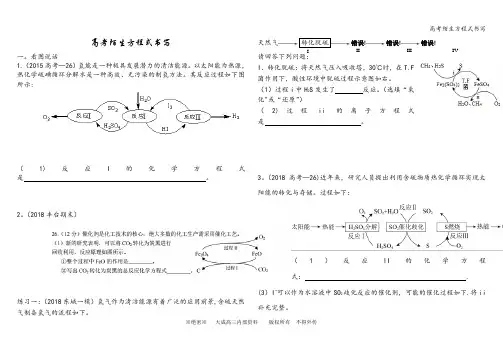
高考陌生方程式书写一。
看图说话1.(2015高考—26)氢能是一种极具发展潜力的清洁能源。
以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。
其反应过程如下图所示:(1)反应I的化学方程式是。
2。
(2018丰台期末)练习一:(2018东城一模)氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。
天然气转化脱硫错误!错误!错误!请回答下列问题:I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如右。
(1)过程i中H2S发生了反应。
(选填“氧化"或“还原”)(2)过程ii的离子方程式是。
3。
(2018高考—26)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。
过程如下:(1)反应II的化学方程式: . (3)I可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下.将ii 补充完整。
I II III IV※绝密※大成高三内部资料版权所有不得外传※绝密※ 大成高三内部资料 版权所有 不得外传i . SO 2 + 4I + 4H +=== S ↓+ 2I 2 + 2H 2Oii 。
I 2 + 2H 2O + === + + 2I练习二。
(2016高考—27)以废旧铅酸电池中的含铅废料(Pb 、PbO 、PbO 2、PbSO 4及炭黑等)和H 2SO 4为原料,制备高纯PbO ,实现铅的再生利用。
其工作流程如下:(1)过程Ⅰ中,在2Fe +催化下,Pb 和PbO 2反应生成PbSO 4的化学方程式是.(2)过程Ⅰ中,2Fe +催化过程可表示为:ⅰ:22324422Fe +PbO +4H +SO =2Fe+PbSO +2H O ++-+ⅱ:……①写出ⅱ的离子方程式: 。
二。
图文并茂,字字留心4.(2018高考-28)实验小组制备高铁酸钾(K 2FeO 4)并探究其性质.(1)制备K 2FeO 4(夹持装置略)① A 为氯气发生装置。

高三化学专题复习——“陌生方程式的书写”所谓陌生方程式即课本中没出现的,但利用所学知识能解决的一类题目,此类题目常在实验题或工艺流程题目中考察。
常见的类型有:一、利用守恒原理只需配平既可。
此类题往往给出了反应物、生成物或反应物、生成物却一物质(常见的有水、酸或碱等),这类题只需配平并根据提示写出反应条件即可。
如:例题1:过碳酸钠商品中一般都含有碳酸钠,为了测定它的纯度,取一定量的样品和盐酸反应生成氯化钠和二氧化碳、氧气。
写出过碳酸钠(Na2CO4)和HCl反应的化学方程式【变式1】若在空气中加热MgCl2.6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式。
【变式2】硫粉、炭粉与硝酸钾混合,可以得到黑火药。
黑火药爆炸的产物与其组成有关。
一般黑火药组成为一硫二硝三碳,爆炸产物为K2S、N2、CO2。
(1)写出黑火药爆炸反应的化学方程式该反应的氧化剂是,还原剂是。
(2)求氧化产物与还原产物的物质的量之比。
【变式3】氮气的实验室制法是用氯化铵(NH4Cl)与亚硝酸钠(NaNO2)反应,同时生成氯化钠和水.写出该反应的化学方程式:二、利用复分解反应知识进行书写如工业上煤的脱硫,又如过氧化钠与盐酸反应的原理与过氧化钠与水反应原理相似,写出其方程式。
三、利用氧化还原反应原理进行书写解题要点:1、元素化合价有升必有降。
2、对变价元素的氧化或还原产物一般是相邻价态的物质。
3、利用守恒原理进行配平。
基本原则及步骤1、判断好反应物(氧化剂、还原剂)和产物(氧化产物、还原产物)2、电子得失守恒3、电荷守恒4、原子守恒例2:某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2已知该反应中H2O2只发生如下过程:H2O2→ O2(1)该反应中的还原剂是。
(2)该反应中,发生还原反应的过程是→。
(3)写出该反应的化学方程式。
【变式4】某一反应体系中共有Pb3O4、NO、MnO2、Cr2O3、Cr(MnO4)2和Pb(N3)2(名称叠氧化铅,其中Pb为+2价)六种物质,已知Pb(N3)2是反应物之一。

2017年高三化学小专题八陌生方程式的书写一、信息型氧化还原反应方程式的书写“四步法”书写陌生氧化还原反应方程式:第一步:根据元素化合价的升降判断氧化剂、还原剂、氧化产物、还原产物。
第二步:按“氧化剂+还原剂=还原产物+氧化产物”写出方程式,根据得失电子守恒配平上述四种物质。
注意:不属于“氧化剂、还原剂、氧化产物、还原产物”的物质这一步暂不写在方程式中。
第三步:根据电荷守恒或反应物的酸碱性,在方程式左边或右边补充H+、OH-或H2O等。
第四步:根据质量守恒配平反应方程式。
例:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4晶体。
请回答:软锰矿制备K2MnO4的化学方程式是KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是解析:(1)第一步,Mn元素由MnO2中的+4价升高到K2MnO4中的+6价,故MnO2是还原剂,K2MnO4是氧化产物。
Cl元素由KClO3中的+5价降低到KCl中的-1价,故KClO3是氧化剂,KCl是还原产物。
第二步,按“氧化剂+还原剂=还原产物+氧化产物”把化学方程式初步写为:KClO3+3MnO2=KCl+3K2MnO4。
由于Cl元素降6价,Mn元素升2价,所以MnO2、K2MnO4的化学计量数均为3。
第三步,由于反应是在碱性条件下进行,且第一步写出的方程式中右边钾元素物质的量多于左边钾元素的物质的量,故在方程式左边反应物中补充KOH,右边生成物中补充H2O:KClO3+3MnO2+KOH =KCl+3K2MnO4+H2O。
第四步,根据K元素守恒,在KOH前面配6;根据H元素守恒在H2O前面配3。
两边的O 元素相等,说明方程式已配平:3MnO2+6KOH+KClO3=3K2MnO4+KCl+3H2O。

陌生方程式书写专项练习1.利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2。
生产中溶液需保持弱碱性,在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,反应的离子方程式:____________________________________。
【答案】3NO+2H+=NO+2NO↑+H2O2.生产硫化钠大多采用无水芒硝(Na2SO4)-碳粉还原法,若煅烧所得气体为等物质的量的CO和CO2,写出煅烧时发生反应的化学方程式:______________________________。
【答案】3Na2SO4+8C3Na2S+4CO↑+4CO2↑3.向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式:__________________________________________。
【答案】SO+I2+H2O=2I-+SO+2H+4.向含Cr2O的酸性废水中加入FeSO4溶液,使Cr2O全部转化为Cr3+。
写出该反应的离子方程式:_____________________________________。
【答案】Cr2O+6Fe2++14H+=2Cr3++6Fe3++7H2O5.温度高于200 ℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),该反应的化学方程式:_______________________________________________。
【答案】4Al(NO3)312NO2↑+3O2↑+2Al2O36.(1)AgNO3光照易分解,生成Ag和红棕色气体等物质,其光照分解反应的化学方程式:_________________________________________。
【答案】2AgNO32Ag+2NO2↑+O2↑(2)氢能是一种极具发展潜力的清洁能源,以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。

陌生化学方程式的书写陌生情景中(信息型)的化学方程式书写时,首先要根据材料中的信息写出部分反应物和生成物的化学式,再看是否有化合价升降,如果有,必须先根据“有升必有降”的原则写出并配平与这些元素有关的物质,然后再根据质量守恒定律写出并配平其它物质。
1、石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)由溶液IV生成沉淀V的总反应的离子方程式为2、镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。
由于电池使用后电极材料对环境有危害。
某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②K sp (Ni(OH)△): 5.0×10-16 ,K sp (NiC2O4): 4.0×10-10(1)写出加入Na2C2O4溶液后反应的化学方程式________________ 。
(2)写出加入NaOH溶液所发生反应的离子方程式。
3、近年来,我国储氢纳米碳管研究取得重大进展,用电弧法合成的碳纳米管中常伴有大量碳纳米颗粒(杂质),这种碳纳米颗粒可用氧化气化法提纯,请完成并配平其反应化学方程式为:___C+__K2Cr2O7 +====___CO2↑+ ____K2SO4+ __Cr2(SO4)3+ ___H2O,其中氧化剂是________________,氧化产物是___________。
4、碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。
工业上可从电解精炼铜的阳极泥中提取碲。
TeO2是两性氧化物,微溶于水,可溶于强酸或强碱。
从上述阳极泥中提取碲的一种工艺流程如下:①“碱浸”时TeO2发生反应的化学方程式_______________________。

精锐教育学科教师辅导教案学员编号: 年 级:初三 课 时 数: 1学员姓名: 辅导科目:化学 学科教师:授课类型T (能力) 星 级★★★ 授课日期及时段教学内容<建议用时5分钟!>1、 做馒头时,面团经发酵后生成一些酸(用HX 表示其化学式),此时可加一些纯碱溶液,用力揉合,面团变得疏松多孔。
原因是面团中的酸能与纯碱反应产生______。
该反应的化学方程式为:_______________。
【答案】1、CO 2,Na 2CO 3+2HX==2NaX+H 2O+CO 2↑2、在日常生活中常用一些铝制器皿,在清洗铝制器皿表面的污垢时,不能使用热的碱性溶液,因为铝能与热的碱性溶液中的氢氧化钠、水发生作用而被腐蚀,生成偏铝酸钠(NaAlO 2)和一种可燃性气体。
该反应的化学方程式为:_____________________________________。
【答案】2、2Al+2Na+2H 2O==2NaAlO 2+3H 2↑3、(1)为适应火车提速,沪宁线上原有的短轨已全部连接为超长轨。
工程技术人员常用点燃铝热剂(铝粉和氧化铁粉末的混合物,能释放大量的热量)的方法来生成熔融状态的铁,从而焊接钢轨间的缝隙。
写出有关的化学方程式_____________________________,其中还原剂是________,其基本反应类型是____________。
(2)钮扣电池是一种常用的微型银锌电池,在电池内装有氧化银和锌等物质。
当电池工作时,主要是锌与氧化银发生置换反应,从而产生电流,此反应的化学方程式:__________________________________。
【答案】3、2Al+Fe 2O 3 Al 2O 3+2Fe ,Al ,置换反应,Zn+Ag 2O==2Ag+ZnO<建议用时5分钟!>在初中化学试题中,我们常常会遇到一些信息型的化学方程式书写题,这种题和生产、生活实际密切联系,并紧跟前沿科技,对开拓学生视野,培养科学精神以及发展其分析问题、解决问题有能力都有极大的作用。
