人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
练习:
1.下列物质中,化学式能准确表示该物质
分子组成的是 C
A.NH4Cl B.SiO2 C.P4 D.Na2SO4
问题反思——化学式能否表示分子,关 键能判断该物质是否分子晶体
人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
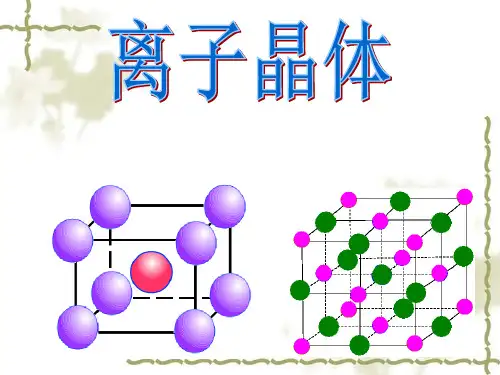
2.下列有关晶体的叙述中不正确的是 (D) A. 金刚石的网状结构中,由共价键形成的碳 原子环中,最小的环上有6个碳原子 B. 氯化钠晶体中,每个Na+周围距离相等的 Na+离子共有6个 C. 氯化铯晶体中,每个铯原子周围紧邻8个氯 原子 D. 干冰晶体中,每个二氧化碳分子周围紧邻 10个二氧化碳分子
➢实验数据——
分析实验数据、结合分解机理可知—— ★阳离子半径越大,碱土金属碳酸盐的分 解温度越高
人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)
课堂巩固
下列说法正确的是( BE) A.离子晶体在固态时不能导电是因为其中没有离子. B.离子晶体中也可能含有共价键. C.离子晶体中一个阳离子只能与一个阴离子形成离子键. D.离子晶体中阴离子与阳离子数总是相等的. E.离子晶体中离子键越强,其熔沸点越高,硬度越大. F.离子晶体中肯定含有金属阳离子。
4.离子晶体结构对物理性质的影响 (1)熔沸点较高,阳离子电荷数越多, 半径越小,熔沸点越高 (2)离子晶体较硬脆 (3)晶体时不导电
人教版-化学选修离子晶体PPT演示( 优秀课 件)
人教版-化学选修离子晶体PPT演示( 优秀课 件)