离子晶体 选修三课件
- 格式:ppt
- 大小:2.99 MB
- 文档页数:35


【选修三】3-4离子晶体(新人教版精品)第四节 离子晶体第1课时【知识与技能】 1、通过复习钠与氯形成氯化钠的过程,使学生理解离子键的概念、形成过程和特点。
2、理解离子晶体的概念、构成及物理性质特征,掌握常见的离子晶体的类型及有关晶胞的计算。
【过程与方法】 1、 复习离子的特征,氯化钠的形成过程,并在此基础上分析离子键的成键微粒和成键性质,培养学生知识迁移的能力和归纳总结的能力。
2、 在学习本节的过程中,可与物理学中静电力的计算相结合,晶体的计算与数学的立体几何、物理学的密度计算相结合。
【情感态度与价值观】 通过本节的学习,进一步认识晶体,并深入了解晶体的内部特征。
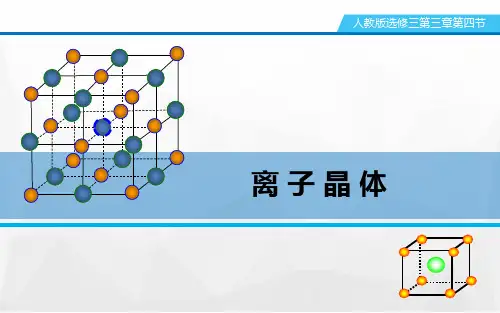
[板书计划] 第四节 离子晶体 一、离子晶体:由阳离子和阴离子通过离子键结合而成的晶体。
1、几何因素:晶体中正负离子的半径比(r +/r -)。
2、电荷因素:正负离子的电荷比。
3、键性因素:离子键的纯粹程度。
4、离子晶体特点:硬度较大、难于压缩、较高的熔点和沸点。
二、晶格能 1、定义:气态离子形成l 摩离子晶体释放的能量,通常取正值。
2、规律:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。
【教案设计】 【问题引入】 1、钠原子与氯原子是如何结合成氯化钠的?你能用电子式表示氯化钠的形成过程吗? 2、根据元素的金属性和非金属性差异,你知道哪些(1)NaF NaCl NaBr NaI988℃801℃747℃660℃(2)NaF CaF2 CaO988℃1360℃2614℃(提示:Ca2+半径略大于Na+半径)【讲解】从离子键的实质是静电引力出发, 影响 F 大小的因素有: 离子的电荷数q 和离子之间的距离r (与离子半径的大小相关)1) 离子电荷数的影响:电荷高,晶格能大,离子晶体的熔沸点高、硬度大。
NaClMgO晶格能(KJ.mol-1)786 3791 熔点(℃)801 2852 摩氏硬度 2.5 6.5 2) 离子半径的影响:半径大, 导致离子间距大, 晶格能小,离子晶体的熔沸点低、硬度小。