某些离子晶体的晶格能/(KJ/mol) 28
仔细阅读表3—8, 分析晶格能的大小 与离子晶体的熔点 有什么关系?离子 晶体的晶格能与哪
些因素有关?
29
2、影响晶格能大小因素: 离子晶体中阴阳离子半径 越小,所带电荷越多,离 子键越强,晶格能越大。
30
3.晶格能的应用:
(1)晶格能越大,离子晶体越
33
⑵原子晶体中,结构相似时, 原子半径越小,共价键键长 越短,键能越大,熔点越高。
⑶分子晶体中(不含氢键 时),分子组成和结构相似 时,相对分子质量越大,范 德华力就越强,熔点就越 34
⑷金属晶体中,离子半 径越小,离子电荷越高, 金属键就越强,熔点就越 高。合金的熔点比它的各 成分金属的熔点低。
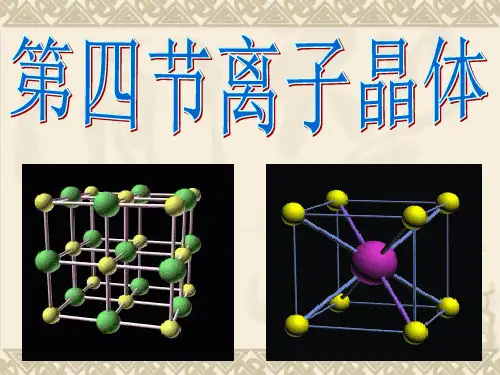
每个Cl- 周围与之最接
近且距离相等的Na+共
有 6 个。
14
15
(1)NaCl晶体中
每个Na+周围最近且等距离的Cl-有 6个,每 个Cl-周围最近且等距离的Na+有 6 个;在每
个Na+周围最近且等距离的Na+有12个,在每
个Cl-周围最近等距离的Cl-有12 个。 Na+和
Cl-的配位数分别为 6 、 6 。一个NaCl晶
返回 23
3. 离子晶体物理性质的特点: (1) 熔沸点较高, 难挥发。
(2) 硬度较大,难于压缩。
(3)一般易溶于水,而难溶于 非极性溶剂。 (4)固态不导电,水溶液或 者熔融状态下能导电。 24
学习目标:
1.了解晶格能的定义 和应用;
2.知道晶格能的大小可 以衡量离子晶体中离子 键的强弱;
25
5.由金属元素与非金属元素组成 的晶体一定是离子晶体。×