最新硫酸的性质和制备yu
- 格式:ppt
- 大小:885.00 KB
- 文档页数:30

硫酸的制备和化学性质硫酸是一种重要的化学物质,在工业生产和实验室中都有广泛的应用。
它是一种无色、无臭的液体,具有强酸性。
本文将探讨硫酸的制备方法以及其化学性质。
1. 硫酸的制备方法硫酸的制备方法有多种,其中最常见的是浓缩硫酸法和铁硫矿氧化法。
浓缩硫酸法是通过浓缩稀硫酸来制备浓硫酸。
首先,将稀硫酸加热,使其蒸发,然后通过冷凝,将蒸汽冷却成液体。
这样就可以得到浓硫酸。
铁硫矿氧化法是利用铁硫矿中的硫化物来制备硫酸。
首先,将铁硫矿破碎成小颗粒,然后在高温下进行氧化反应。
氧化后的产物经过水解,生成硫酸。
2. 硫酸的化学性质硫酸是一种强酸,具有强烈的腐蚀性。
它可以与许多物质反应,产生不同的化学性质。
首先,硫酸可以与金属反应,生成相应的硫酸盐和氢气。
例如,硫酸与铁反应,生成硫酸亚铁和氢气。
这种反应被称为金属与酸的反应。
其次,硫酸可以与碱反应,生成相应的盐和水。
这种反应被称为酸碱中和反应。
例如,硫酸与氢氧化钠反应,生成硫酸钠和水。
此外,硫酸还可以与醇类反应,生成硫酸酯。
这种反应被称为酸醇反应。
例如,硫酸与甲醇反应,生成甲基硫酸甲酯。
另外,硫酸也具有脱水性质。
它可以从许多物质中脱去水分,使它们变干燥。
例如,硫酸可以从蔗糖中脱去水分,将其变成焦糖。
3. 硫酸的应用硫酸在工业生产中有广泛的应用。
它是制造肥料、农药、纤维素和染料等化学品的重要原料。
此外,硫酸还被用于金属表面处理、电池制造和皮革加工等工艺过程中。
在实验室中,硫酸也是一种常用的试剂。
它可以用于调节溶液的酸碱度,催化化学反应,以及进行沉淀和析出等实验操作。
总结:硫酸是一种重要的化学物质,具有强酸性和腐蚀性。
它可以通过浓缩硫酸法和铁硫矿氧化法来制备。
硫酸可以与金属、碱和醇类等物质反应,产生不同的化学性质。
在工业和实验室中,硫酸都有广泛的应用。
了解硫酸的制备方法和化学性质,有助于我们更好地理解和应用这一重要化学物质。





高一化学必修二硫酸的知识点硫酸(H2SO4)是一种常见的无机酸,具有广泛的应用领域,是现代化学工业中重要的原料之一。
本文将介绍硫酸的性质、制备方法,以及其在实际应用中的重要性。
1. 硫酸的性质硫酸是一种无色、无味的液体,具有很强的腐蚀性。
其化学式为H2SO4,分子量98.08 g/mol。
硫酸是一种高度极性的物质,具有良好的溶解性,可以与水、醇类和酚类等广泛溶剂混溶。
硫酸具有强酸性,可与碱反应,生成相应的盐和水。
2. 硫酸的制备方法(1)浓缩硫酸水溶液:在实验室中,可以通过浓缩硫酸的方式制备浓硫酸。
将硫酸稀溶液加热,不断蒸发水分,最终得到浓硫酸。
(2)联系制备法:工业上通常采用的制备硫酸的方法是联系制备法。
这是通过将硫磺(S)和氧气(O2)在反应器内进行反应,生成二氧化硫(SO2),再与空气中的氧气反应,生成二氧化硫气体。
接着,将二氧化硫气体通过冷凝器冷却至液体状态,与浓硫酸反应生成硫酸。
3. 硫酸的应用硫酸具有广泛的应用领域,以下是其中一些重要的应用:(1)化学工业:硫酸是许多化学制品的重要原料,如肥料、农药和染料等。
此外,硫酸也是许多金属的提取和精炼过程中的重要溶剂。
(2)石油工业:在炼油过程中,硫酸用于催化裂化和脱气,帮助提高燃料质量。
(3)电池制造:硫酸是制造铅酸电池的重要成分,铅酸电池被广泛应用于汽车和UPS(不间断电源)等设备上。
(4)清洁剂制造:硫酸在清洗和去污过程中具有良好的酸性,因此被广泛用于制造清洁剂。
(5)实验室应用:硫酸作为一种重要的实验试剂,被广泛应用于化学实验室中的多种实验过程中,如酸碱中和反应等。
综上所述,硫酸作为一种重要的化学物质,在各个领域都具有广泛的应用。
我们应该加深对硫酸性质的理解,并且注意在使用硫酸时要注意安全性,避免对人体和环境造成伤害。

硫酸的制备知识点总结硫酸是一种常见且重要的化学物质,在许多工业过程和实验室中都有广泛的应用。
下面,我将为你总结硫酸的制备知识点,帮助你更好地了解这个过程。
1.硫酸的化学性质硫酸的化学式为H2SO4,是一种无色、无臭的稠密液体。
它具有强酸性,可与碱反应生成盐和水,并可与金属反应产生氢气。
2.硫酸的制备方法硫酸的制备方法有多种,常用的有浓缩法、吸收法和接触法等。
3.浓缩法浓缩法是最常见和经济的硫酸制备方法之一。
其步骤如下:•首先,将硫磺或硫化氢气体与空气反应生成二氧化硫(SO2)。
•然后,将二氧化硫与氧气反应生成三氧化硫(SO3)。
•最后,将三氧化硫与水反应生成硫酸(H2SO4)。
4.吸收法吸收法是一种利用硫酸的吸湿性制备硫酸的方法,其步骤如下:•首先,将硫磺或硫化氢气体与空气反应生成二氧化硫(SO2)。
•然后,将二氧化硫气体通入硫酸溶液中,发生吸收反应生成亚硫酸(H2SO3)。
•最后,将亚硫酸通过氧化反应转化为硫酸(H2SO4)。
5.接触法接触法是一种利用催化剂加速反应速率的硫酸制备方法,其步骤如下:•首先,将硫磺或硫化氢气体与空气反应生成二氧化硫(SO2)。
•然后,将二氧化硫气体与氧气在催化剂的作用下反应生成三氧化硫(SO3)。
•最后,将三氧化硫与水反应生成硫酸(H2SO4)。
6.硫酸的应用领域硫酸广泛应用于冶金、化工、制药、农业等众多领域。
它可用于制备肥料、染料、洗涤剂、炸药等化学品,也可用于电镀、电池制造、纺织等工业过程。
总结:硫酸的制备是一个重要的化学过程,有多种不同的方法可供选择。
浓缩法、吸收法和接触法是最常用的制备方法,每种方法都有其独特的步骤和特点。
硫酸具有强酸性和广泛的应用领域,是许多工业和实验室中不可或缺的化学物质。

硫酸的物化性质和制备方法[物化性质] 硫酸,分子式为H2SO4,相对分子质量98.07,为无色透亮油状液体,熔点10.4℃。
沸点290℃。
密度1.84g/cm3。
能以随意比例与水混合,并放出大量的热。
化学性质活泼,几乎与全部金属、氧化物、氢氧化物反应生成。
具有极强的吸水性和氧化性,能使棉布、纸张、木材等碳水化合物脱水碳化,接触人体能引起严峻的烧伤。
空气中体积含量达4%~75%时具有爆炸性。
在10℃凝固,加热到340℃分解成和水。
浓度低于76%的硫酸与金属反应会放出氢气。
市售硫酸按纯度不同色彩自无色、黄色乃至红棕色。
密度随含量增强而增强,熔点随含量削减而下降。
[制备办法] (1)硫磺法由硫磺制取二氧化硫气体,再将二氧化硫催化氧化,生成三氧化硫,最后将三氧化硫与水接触制取硫酸。
(2) 硫铁矿法以硫化铁矿为原料,经焙烧得到二氧化疏,经净化、氧化成三氧化硫,用稀硫酸汲取得到成品。
(3)中国专利CN1113878A 此法也是利用焙烧硫化铁矿法,但是,在制备过程中,采纳含N20~60%(分量含量)的纯氧或富氧空气依次顺流流入串联的1~5个硫铁矿氧化焙烧炉中举行硫铁矿的焙烧,每个炉的出口气体温度为600~1000℃。
此高温可用于产生蒸汽及发电。
焙烧硫铁矿完毕后的气体经处理后进入转化炉举行转化,使气体中含有的大部分SO2(50%~100%)转化为SO3,转化后的气体被汲取制备硫酸,汲取后气体中的SO3 50%~100%转化为硫酸产品,所得的终于尾气经升温加压或被喷射吸引后返回硫铁矿焙烧炉前与氧气混合或返回SO2转化炉前与SO2炉气混合或返回SO3汲取塔前与SO3炉气混合后循环用法。
因为生产过程中用法的氧气中含有部分氮气,因此,在生产过程中,气体中N2的含量逐渐增强。
当N2含量达到一定数值时,排放部分硫酸汲取塔后的终于尾气经处理后放空,以维持生产过程中的循环气体中氮的含量为一定数值。
(4)钛白废酸回收硫酸上钛铁矿的主要成分是偏钛酸亚铁,是一种弱酸弱碱盐。
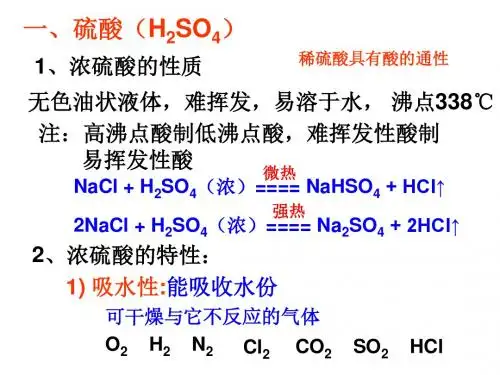

化学硫酸知识点总结硫酸是一种重要的化学品,广泛应用于工业生产、化学实验和其他领域。
本文将从硫酸的性质、制备、应用等方面对硫酸的知识点进行总结。
一、硫酸的性质1. 物理性质硫酸为无色、透明、沸点337℃,密度1.84g/cm³,易溶于水并放出大量热量。
2. 化学性质(1)和金属的反应:硫酸能与金属发生反应,生成相应的硫酸盐和氢气。
例如:H2SO4 + Zn → ZnSO4 + H2↑(2)与碱的反应:硫酸能与碱发生中和反应,生成相应的盐和水。
例如:H2SO4 + 2NaOH → Na2SO4 + 2H2O(3)脱水性:硫酸具有很强的脱水性,能够使许多物质脱水,如脱水醇生成烯烃等。
(4)氧化性:浓硫酸是一种氧化剂,能够与许多物质发生氧化反应。
二、硫酸的制备1. 浓硫酸的制备浓硫酸通常采用铁的接触法进行制备,主要步骤包括将浓硫酸蒸气通入浓硫酸中,然后将浓硫酸和蒸汽混合气体通过铁丝塞的塔体进行接触反应。
2. 稀硫酸的制备稀硫酸的制备方法有很多,一般采用恩格勒法或铁法,也可以用硫和水的氧化反应生成二氧化硫然后再与氧气进一步反应制备硫酸。
三、硫酸的应用1. 工业上的应用硫酸是一种重要的工业原料,广泛用于矿山冶炼、化肥生产、有机合成、电镀等领域。
其中,硫酸最主要的用途是用作化肥、废水处理、矿山浸出和石油冶炼等。
2. 化学实验室中的应用硫酸也是实验室中常用的试剂,用于调节溶液的pH值,进行有机合成反应,还可以用作干燥剂和脱水剂等。
四、硫酸的安全性硫酸具有强酸性和腐蚀性,对皮肤、眼睛和呼吸系统都有一定的危害。
在使用硫酸时,应穿戴好防护装备并注意通风,避免接触皮肤、呼吸道和眼睛。
五、硫酸的环境影响硫酸的环境影响主要表现在两个方面:一是其腐蚀性和毒性对环境造成直接伤害,二是硫酸在大气和水循环中形成酸雨,对土壤、湖泊等造成一定污染,影响自然环境和生态平衡。
结语硫酸是一种重要的化学品,其性质、制备和应用都具有重要意义。

硫酸的性质与制备硫酸(化学式:H2SO4)是一种无色、无臭的强酸,具有广泛的应用领域。
本文将就硫酸的性质及其制备方法进行介绍,以便深入理解硫酸的特性和应用。
一、硫酸的性质1. 分子结构:硫酸的分子式为H2SO4,由2个氢原子、1个硫原子和4个氧原子组成。
其中,一个氢原子与硫原子形成酸性羟基(SO4H),另一个氢原子与氧原子结合成水(H2O)。
2. 强酸性:硫酸是一种强酸,其酸离子活性很高。
硫酸能够与水反应产生大量的氢离子(H+),从而使溶液呈酸性。
3. 强氧化性:硫酸具有很强的氧化性,可以与许多物质发生氧化反应。
例如,硫酸能够与金属反应生成相应的硫酸盐和氢气。
4. 吸湿性:硫酸具有很强的吸湿性,常被使用为干燥剂。
它可以吸收空气中的水分,使空气变干燥。
二、硫酸的制备方法1. 硫磺的制备方法:硫磺是制备硫酸的重要原料之一。
目前,硫磺主要通过沉积硫制备。
将含有硫矿石的原料经过提炼和氧化处理,生成硫磺。
这种方法成本较低且效率较高。
2. 硫酰氯法:硫酰氯是硫酸的重要中间体,在合成过程中起到关键的作用。
硫酰氯可通过硫磺和氯气的反应得到,反应条件需要在高温下进行。
然后,将得到的硫酰氯与氢氧化钠反应,生成硫酸。
3. 临氢硫酸法:这是一种比较常用的制备硫酸的方法。
首先,通过燃烧硫磺产生二氧化硫气体,然后将二氧化硫气体加入硝酸反应生成硫酸。
该方法具有较高的效率和较低的成本。
三、硫酸的应用领域1. 化学工业:硫酸广泛应用于化学工业中,用于制备肥料、染料、涂料和塑料等。
2. 矿山工业:硫酸被用于提取金、银等贵金属,以及精炼铜、铅等有色金属。
3. 石油工业:在石油提炼过程中,硫酸被用于脱除石油中的杂质。
4. 制药工业:硫酸可用于制作各种药物及化妆品,并作为酸化剂使用。
5. 纺织工业:硫酸在纺织工业中常用于去除纤维杂质、酸洗和染色等。
综上所述,硫酸是一种重要的化学物质,具有强酸性和氧化性,可以广泛应用于化学、矿山、石油、制药和纺织等领域。