2013年不合格药品处理情况分析报告
- 格式:doc
- 大小:41.50 KB
- 文档页数:3
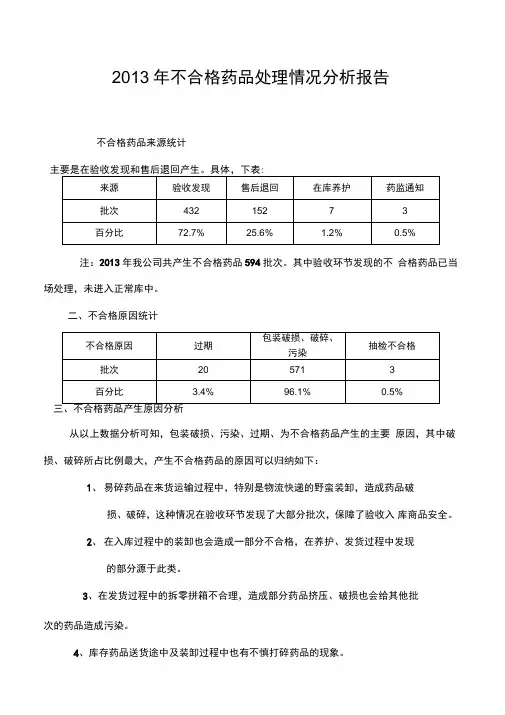
2013年不合格药品处理情况分析报告不合格药品来源统计主要是在验收发现和售后退回产生。
具体,下表:注:2013年我公司共产生不合格药品594批次。
其中验收环节发现的不合格药品已当场处理,未进入正常库中。
二、不合格原因统计三、不合格药品产生原因分析从以上数据分析可知,包装破损、污染、过期、为不合格药品产生的主要原因,其中破损、破碎所占比例最大,产生不合格药品的原因可以归纳如下:1、易碎药品在来货运输过程中,特别是物流快递的野蛮装卸,造成药品破损、破碎,这种情况在验收环节发现了大部分批次,保障了验收入库商品安全。
2、在入库过程中的装卸也会造成一部分不合格,在养护、发货过程中发现的部分源于此类。
3、在发货过程中的拆零拼箱不合理,造成部分药品挤压、破损也会给其他批次的药品造成污染。
4、库存药品送货途中及装卸过程中也有不慎打碎药品的现象。
5、过期药品主要是库存不合理、滞销、或客户在药品近效期时退回后未及时处理造成。
6、药品本身质量问题由顾客投诉、养护、药监部门抽检发现等。
7、2013年,仓库进行改造,改进了空调系统和温湿度监控系统,全库区的存储条件都达到阴凉库标准,电脑实时监控,能及时发现超标的温湿度,及时采取温控措施,保证了库存药品的质量稳定,因此本年度未发生因仓储条件或保管不善造成药品变质的情况。
四、不合格药品的处理1、对这些不合格药品,日常处理严格按照不合格药品管理制度,及时停售,移库,并作好相关记录备案。
2、不合格药品中一部分在质量管理部的监督之下退回供应商,由供应商来承担部分损失,不能处理的一部分由公司统一存放预做销毁处理。
五、预防措施1、此次统计中药品包装破损(破碎、污染)情况最严重。
因加强拆零药品拼箱合格率的检查,严格执行拼箱制度,做好减震,防摔,固液分开运输管理,运输途中控制车速,防止碰撞、挤压以免造成不必要的损失。
2、加强对验收工作的管理,严格把好药品入库的质量关,将最大的不合格风险截流在入库前。

不合格药品处理情况分析药品是人们维护健康的重要物品,但是随着药品市场的扩大和药品生产的增加,也导致了不合格药品的出现。
不合格药品的存在给社会公众带来了极大的健康风险,因此如何处理不合格药品成为了一个重要的问题。
本文将针对不合格药品处理情况进行分析,并提出相应的解决方案。
首先,不合格药品的处理情况主要包括以下几个方面:1.检测和抽查。
药品监管部门通过抽查和检测,对市场上的药品进行监督和管理。
不合格药品一旦被发现,将会被扣押或下架,并进行进一步的调查和处理。
2.惩罚和处罚。
对药品生产企业和销售商,如果涉嫌生产或销售不合格药品,将会受到相应的惩罚和处罚。
这包括罚款、吊销生产许可证等措施,以便惩罚违法行为,保护社会公众健康。
3.教育和宣传。
药品监管部门通过宣传和教育活动,向公众普及有关药品安全和不合格药品的知识。
通过提高公众的认知水平,促使公众自主选择合格的药品,从而减少不合格药品带来的风险。
除了不合格药品的处理情况,我们还需要关注不合格药品产生的原因。
主要有以下几个方面:1.药品生产过程中的违法行为。
一些药品生产企业为了追求利润最大化,可能会采用一些违法行为,如使用劣质原料、不按照规定的生产工艺等,导致药品不合格。
2.药品流通环节的监管不到位。
一些销售商可能会在药品销售过程中,为了赚取更多的利润,采用一些不正当手段,如低价转售、变相销售过期药品等,导致不合格药品的流入市场。
3.药品监管机构的监管不力。
药品监管机构在监管过程中,可能存在监管盲区或监管措施不够严格等问题,导致不合格药品得以流入市场。
针对以上原因和不合格药品的处理情况1.加强药品生产监管。
加强对药品生产企业的监管力度,加大对不合格药品的打击力度。
建立健全药品生产许可证的审核制度,加强对药品生产企业的日常检查和抽样检测。
2.加强药品流通环节的监管。
建立健全药品流通环节的监管机制,对销售商进行检查和抽查,严惩涉嫌销售不合格药品的行为。
加强对药品市场的巡查和监测,及时发现并处理不合格药品。


2013年上半年药品不良反应报告分析我院2013年上半年未收集到ADR,为了解我院药物不良反应(ADR)发生的特点和规律,促进临床合理用药,提醒各医务人员应高度重视ADR工作,完善相关报告分析制度,确保用药安全。
分析漏报的原因:(1)对ADR知识和监测的意义宣传力度不够,导致个别医务人员不了解ADR判断标准和报告程序,无法完成ADR报告。
(2)某些医师认为,ADR就是医疗事故,担心卷入医疗纠纷。
在以往的工作中,一旦出现药品不良反应事件,存在“怕影响声誉、怕惹出麻烦”的误区。
(3)激励和约束机制不全,ADR报告表是医务人员自愿填写上报的,缺乏激励和约束机制,所以各部门的医务人员填写ADR报告主动性差,以致漏报现象的严重。
药品不良反应上报意识不浓、治理不力,给临床药品的安全使用带来隐患。
为了使ADR监测工作更加规范、深入,在接下半年里从以下几点入手:(1)逐步消除临床医护人员对ADR监测的顾虑,提高他们对ADR 的了解。
(2)通过信息共享,发挥院务公开栏的作用,及时公布不良反应信息,避免相同不良反应的发生。
(3)定期进行回顾性分析,通过汇总ADR报告,对药物种类、发生例数、患者年龄等因素进行分析,及时向临床反馈,以便选择安全有效地药品,提高对可引起ADR高发药品的警惕。
(4)各科室应加强ADR报告意识,积极配合ADR监测工作,及时发现及时上报。
药品不良反应(ADR)监测是加强药品管理,提高用药质量和医疗水平的一种重要手段,开展ADR 监测工作一方面可以保障用药安全,避免ADR 的发生;另一方面又可以促进合理用药,提高临床用药水平。
建议我院不断加强临床ADR填报人员的相关知识宣传和培训,不断提高自愿填报ADR的责任意识和能力,使ADR报告监测工作的质和量均有可持续提高。
荔城区黄石卫生院2013年07年13日。


不合格药品处理情况汇总分析不合格药品是指在生产、质量控制、存储和销售过程中,不符合相关法律法规、国家标准和企业质量管理要求的药品。
对于不合格药品的处理,既是企业质量管理的一项重要任务,也是保障患者用药安全的重要环节。
对不合格药品的处理情况进行汇总分析,可以为企业找出不合格的原因,改进质量管理体系,提高药品质量。
一、药品不合格的原因分析1.生产工艺问题:药品生产过程中,可能存在工艺参数设定不合理、工艺参数控制不到位等问题,导致药品不合格。
2.原辅料质量问题:不合格的原辅料可能是因为供应商质量管理不到位、原辅料自身质量问题或者贮存条件不当等原因导致。
3.设备设施问题:生产设备和检测设备的故障、不合格设备使用等问题可能导致药品不合格。
4.操作人员不合格:操作人员的技术水平、操作规范、操作纪律等方面问题会影响药品的质量。
5.药品贮存和运输问题:药品在贮存和运输过程中可能受到温度、湿度等环境因素的影响,导致药品不合格。
二、不合格药品处理措施1.停止生产和销售:一旦发现不合格药品,企业应立即停止相关药品的生产和销售,并追溯到最初的生产批次,对已经生产和流通的药品进行召回。
2.深入调查原因:企业应组织专业团队对不合格药品进行深入调查,找出导致不合格的原因。
3.改进质量管理体系:针对不合格药品的问题,企业需要对自身的质量管理体系进行细致的评估和改进,包括生产工艺、原辅料采购管理、设备设施维护等方面。
4.强化人员培训和管理:加强对操作人员的培训,提高他们的技术水平和操作规范性,提高药品的质量稳定性。
5.贮存和运输条件优化:加强对药品贮存和运输条件的控制,确保药品在整个供应链过程中的质量安全。
对于药品不合格的情况进行汇总分析,可从以下几个方面进行:1.不合格药品类型:对不合格药品的种类进行分类统计,如药品成分不合格、药品外观不合格等,了解不同类型的不合格药品所占比例,以及存在的主要问题。
3.不合格药品的批次:对不合格药品的批次进行追溯和统计,找出不合格药品的集中批次,分析问题原因。


不合格药品分析报告背景介绍药品作为保护人们健康和治疗疾病的重要物品,在市场上的质量和安全问题备受关注。
不合格药品的存在对公众健康造成了极大的威胁。
为了保障人们的健康和权益,我们进行了一项不合格药品的分析研究。
研究目的本研究旨在分析不合格药品的原因和对人体健康的潜在危害,以提供给药品监管部门和公众相关信息,促进合格药品的生产和使用。
研究方法我们采取了以下步骤来进行不合格药品的分析:1. 数据收集我们收集了国内外相关的药品质量监测数据和相关文献,以获取足够的样本进行分析。
2. 样品筛选根据采集到的数据,我们对不合格药品进行筛选和分类,确保研究的准确性和可靠性。
3. 实验分析我们对不合格药品进行了实验室分析,包括成分分析、质量测定、微生物检测等,以了解其不合格的原因和潜在危害。
研究结果经过实验和分析,我们得出了以下结论:1. 药品成分不足或过量部分不合格药品的主要问题是成分不足或过量。
这可能是由于生产过程中的操作失误或质量控制不严格所致。
这些药品可能无法达到预期的疗效,甚至对人体健康产生不可预知的风险。
2. 药品污染一些不合格药品存在微生物污染或其他污染物,如重金属、农药残留等。
这些污染物可能会对人体造成严重的健康问题,包括过敏反应、中毒等。
3. 伪劣产品少数不合格药品可能是伪劣产品,也就是仿冒的药品,其成分与标签上标注的不符。
这些伪劣产品的使用可能导致治疗失败或产生其他不良反应。
结论与建议不合格药品对人体健康和公众利益造成了严重威胁。
为了保障人们的权益和健康,我们提出以下建议:1. 加强药品监管药品监管部门应加强对药品生产和销售环节的监管力度,确保药品质量和安全。
2. 提高生产质量控制药品生产企业应加强质量控制,确保药品成分和质量符合标准,避免不合格药品的产生。
3. 加强消费者教育公众应加强对药品质量和安全的认知,提高警惕性,避免购买和使用不合格药品。
结语本研究通过实验和分析,揭示了不合格药品存在的问题和潜在危害。

2013年度药品审评报告(5篇模版)第一篇:2013年度药品审评报告2013年度药品审评报告国家食品药品监督管理总局药品审评中心国家食品药品监督管理总局药品审评中心是国家食品药品监督管理总局药品注册技术审评机构,负责对药品注册申请进行技术审评。
根据国家食品药品监督管理总局相关工作要求,现将《2013年度药品审评报告》呈现给公众。
一、2013年主要工作措施及进展为更好地维护和促进公众健康,药品审评中心在2013年度深入总结既往经验,继续加强审评管理,不断提升审评效率和质量,保证审评的科学性,着力解决未被满足的临床需求及公众用药的可及性与可支付性问题。
2013年主要的工作措施及进展包括:(一)进一步加强创新药的审评管理遵循创新药研发规律,对申请临床的创新药审评进行了合理优化,制定了《创新药临床申请的综合审评要点》,加强此类注册申请审评的规范化管理,严格安全性评价,提高审评效率,推进创新药尽快进入临床试验,以切实鼓励创新。
制定了《新药上市申请临床评价指南(草案)》,在临床审评部门试行并推广,以规范申请上市新药品种的审评,有效控制新药“市场准入”环节的风险,提高新药上市申请审评的质量和效率。
建立了“特殊审批品种管理库”,对依据《药品注册管理办法》纳入特殊审批程序的品种进行定时梳理和督导,做到精细化管理。
在既往交流协作的基础上,今年与国家重大新药创制专项实施管理办公室建立了协调机制。
并与该办公室化药组的相关负责人召开了专题会议,就如何对在审的“国家重大新药创制专项”立项的化药新药注册申请合理投入审评资源问题进行了讨论,以鼓励新药创制,努力满足公众健康用药需求。
(二)继续探索仿制药的审评管理机制在既往诊断分析国内化药仿制药研发和审评现状的基础上,继续探索改革仿制药的审评管理机制。
着力解决低水平、高重复的仿制药占用审评资源而临床亟需的仿制药得不到及时审评的问题。
今年,药品审评中心积极配合国家总局推进临床亟需仿制药优先审评制度建设。

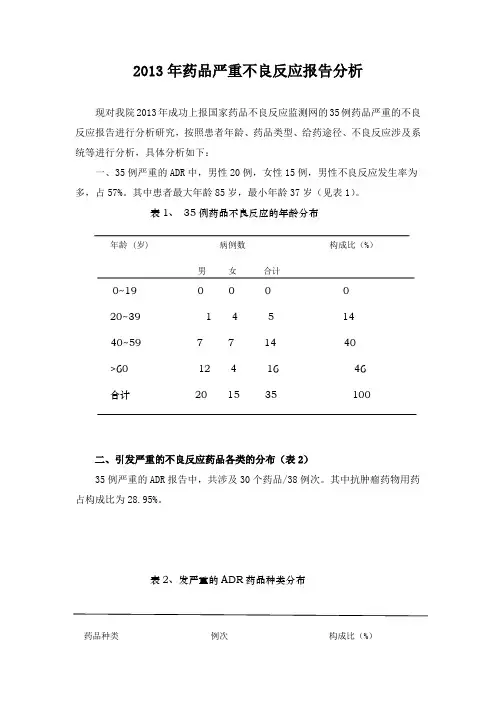
2013年药品严重不良反应报告分析现对我院2013年成功上报国家药品不良反应监测网的35例药品严重的不良反应报告进行分析研究,按照患者年龄、药品类型、给药途径、不良反应涉及系统等进行分析,具体分析如下:一、35例严重的ADR中,男性20例,女性15例,男性不良反应发生率为多,占57%。
其中患者最大年龄85岁,最小年龄37岁(见表1)。
表1、35例药品不良反应的年龄分布年龄 (岁) 病例数构成比(%)男女合计0~19 0 0 0 020~39 1 4 5 1440~59 7 7 14 40>60 12 4 16 46合计20 15 35 100二、引发严重的不良反应药品各类的分布(表2)35例严重的ADR报告中,共涉及30个药品/38例次。
其中抗肿瘤药物用药占构成比为28.95%。
表2、发严重的ADR药品种类分布药品种类例次构成比(%)抗菌药物 6 15.79%中枢神经系统用药物 2 5.26%循环系统用药 5 13.16%激素类 2 5.26%抗肿瘤药物 11 28.95%影响机体免疫功能药物 2 5.26%肝胆辅助用药物 1 2.63%泌尿系统药物 2 5.26%解热镇痛抗炎药物 2 5.26%血液系统用药 1 2.63%诊断用药 3 7.89%其他 1 2.63%三、不同给药途径引起严重的ADR构成(见表3)静脉给药是临床最主要的给药方法之一,在带给患者快速有效治疗的同时,其所发生的不良反应也不可忽视。
表3、不同给药途径引起严重的ADR比例给药途径静脉滴注口服动脉给药泵内注射心内肌注例数 17 14 2 1 1比例 48.6% 40 % 5.7% 2.9% 2.9%四、不良反应涉及的系统/器官及临床表现(见表4)35例严重的ADR报告中涉及10大系统44个临床表现,共51例次,其中以血液系统损害和中枢及外周神经系统损害所占比例较高,分别占到19.6%和15.7%。
由于所发生ADR处置得当,均痊愈或好转,均未产生严重后果。
2013年第三季度药品质量管理检查情况分析总结及整改措施第三季度药品质量管理小组对我院药品质量、各临床科室备用药品的管理进行每月抽检,对一些存在的安全隐患及时采取防范措施,避免药品质量问题的发生,保证了药品的安全供应。
具体检查情况如下:药库:1. 抽查药品:酒石酸美托洛尔、辅酶a、前列地尔、地特胰岛素、诺和锐特充、甘精胰岛素,优泌乐25,贝飞达、脾氨肽、鲑降钙素、狂犬病疫苗、破伤风抗毒素、重组人白介素、重组人促红素这些药品均按储存要求放置在药库冰箱的冷藏室中。
冰箱冷藏室温度显示:2——8°c。
2. 抽查药库抢救药品有专用房间,标签相符。
3. 药库温湿度记录齐全,药库温湿度均符合储存药品需求。
4. 药库入库验收记录完整齐全,有高危药品、冷藏药品养护记录。
5. 特殊药品管理符合“五专”管理规定,有严格进出库记录。
存在问题:药库部分药品还需进一步分类明确,标签有部分脱落情况,还需及时更换标签。
其余没有问题的方面需要继续保持。
一门诊药房:1. 抽查药品:诺和锐特充,重组人干扰素,辅酶a,酒石酸美托洛尔,门冬胰岛素30笔芯、金双歧、甘精胰岛素、贝飞达、脾氨肽、鲑降钙素、狂犬病疫苗、破伤风抗毒素、优泌乐25、地特胰岛素笔芯这些药品均按储存要求放置在药库冰箱的冷藏室中。
冰箱冷藏室温度显示:2——8°c。
2. 抽检药品:厄贝沙坦、阿托伐他丁,辛伐他汀(舒降之)、二甲双胍(格华止)阿奇霉素(希舒美)、头孢克肟(特普宁)、云南白药胶囊,祖师麻膏药,胆石清,曲美布丁,银杏叶滴丸、这几种药品,均是分类摆放,均有明显的标签标示,无有效期小于三个月的药品。
3. 麻醉、精神药品有专人管理、专柜储存、有专门账册并且有详尽出入库的登记。
4. 一门诊药房温湿度记录齐全,温湿度均符合储存药品需求。
存在问题:由于一门诊药房冰箱有限,需要冷藏的药品比较多,摆放过于拥挤,分类不明确,标签不尽相符。
改进措施:1. 购置冰箱,增加容量;2. 减少冷藏药品库存,及时多频次进货。
不合格药品汇总分析报告背景介绍不合格药品是指在药品生产、流通和使用过程中,不符合国家标准要求或者存在安全隐患的药品。
不合格药品的存在严重威胁公众的健康和安全。
为了保障人民群众的权益和生命安全,需要对不合格药品进行汇总分析,以便制定相应的对策和措施。
汇总数据根据相关统计数据,我们对近期不合格药品进行了汇总分析。
以下是我们得出的结论:不合格药品分类根据药品的不合格原因,我们将不合格药品分为以下几类: 1. 药品质量不合格2. 药品生产环境不合格 3. 药品标签不合格 4. 药品不合格流通不合格药品原因分析我们对不合格药品的原因进行了详细的分析。
以下是我们得出的结论:药品质量不合格的原因造成药品质量不合格的原因主要有: 1. 生产工艺不规范 2. 原材料质量不合格 3. 设备设施不达标 4. 生产过程中的操作失误药品生产环境不合格的原因药品生产环境不合格的原因主要有: 1. 无尘室温湿度不稳定 2. 空气质量不达标 3. 人员操作不规范 4. 设备维护不及时药品标签不合格的原因药品标签不合格的原因主要有: 1. 标签印刷错误 2. 标签内容不清晰 3. 标签标示不准确 4. 标签贴附不牢固药品不合格流通的原因药品不合格流通的原因主要有: 1. 无证经营 2. 药品存储条件不符合要求 3. 药品配送环节失误 4. 药品交易环节存在违规行为不合格药品对社会的影响不合格药品对社会的影响主要体现在以下几个方面: 1. 威胁人民群众的健康和生命安全 2. 损害药品行业的声誉 3. 影响人们对药品的信任度 4. 造成不必要的经济损失解决方案针对不合格药品问题,我们提出以下解决方案:政府监管加强政府应加强对药品生产和流通环节的监管力度,强化对药品质量的把关,加大对违法违规药品企业的处罚力度,有效遏制不合格药品的产生和流通。
加强企业自律药品生产和流通企业应加强自律,严格按照国家标准和规定生产和销售药品,加强内部管理,提高自检自控能力,确保药品质量和流通环节的合规性。
2013年第二季度药品不良反应总结与反馈
2013年第二季度我院药品不良反应报告情况分以下五个方面:
一、上报总数及品种:2013年4—6月份,我院共上报药监局不
良反应事件12例,涉及药品10种,其中抗菌药物7例,
中药制剂1例,营养心肌药1例,孕激素1例,止血药1例,镇痛药2例。
二、不良反应发生的品种分布情况分别是:
氨酚曲马多1例,维生素K1针1例,黄体酮胶囊1例,头
孢地尼胶囊1例,头孢克洛胶囊1例,头孢克肟颗粒2例,曲马多缓释片1例,香丹注射液1例,头孢丙烯干混悬剂2
例,果糖二磷酸钠注射液1例。
三、不良反应发生的特点:
药物不良反应临床表现主要是。
2013年不合格药品处理情况分析报告
一、不合格药品来源统计
主要是在验收发现和售后退回产生。
具体,下表:
注:2013年我公司共产生不合格药品594批次。
其中验收环节发现的不合格药品已当场处理,未进入正常库中。
二、不合格原因统计
三、不合格药品产生原因分析
从以上数据分析可知,包装破损、污染、过期、为不合格药品产生的主要原因,其中破损、破碎所占比例最大,产生不合格药品的原因可以归纳如下:
1、易碎药品在来货运输过程中,特别是物流快递的野蛮装卸,造成药品破
损、破碎,这种情况在验收环节发现了大部分批次,保障了验收入
库商品安全。
2、在入库过程中的装卸也会造成一部分不合格,在养护、发货过程中发现
的部分源于此类。
3、在发货过程中的拆零拼箱不合理,造成部分药品挤压、破损也会给其他批次的药品造成污染。
4、库存药品送货途中及装卸过程中也有不慎打碎药品的现象。
5、过期药品主要是库存不合理、滞销、或客户在药品近效期时退回后未及时处理造成。
6、药品本身质量问题由顾客投诉、养护、药监部门抽检发现等。
7、2013年,仓库进行改造,改进了空调系统和温湿度监控系统,全库区的存储条件都达到阴凉库标准,电脑实时监控,能及时发现超标的温湿度,及时采取温控措施,保证了库存药品的质量稳定,因此本年度未发生因仓储条件或保管不善造成药品变质的情况。
四、不合格药品的处理
1、对这些不合格药品,日常处理严格按照不合格药品管理制度,及时停售,移库,并作好相关记录备案。
2、不合格药品中一部分在质量管理部的监督之下退回供应商,由供应商来承担部分损失,不能处理的一部分由公司统一存放预做销毁处理。
五、预防措施
1、此次统计中药品包装破损(破碎、污染)情况最严重。
因加强拆零药品拼箱合格率的检查,严格执行拼箱制度,做好减震,防摔,固液分开运输管理,运输途中控制车速,防止碰撞、挤压以免造成不必要的损失。
2、加强对验收工作的管理,严格把好药品入库的质量关,将最大的不合格风险截流在入库前。
3、药品过期问题还是存在,公司应引起足够重视,加强促销和退货工作,在源头上加强采购工作管理,优化库存结构,减少不必要的损失。
4、继续加强养护工作、改进养护方法,加大对养护人员的专业知识培训工
作,提高识别假劣药品的水平,把好在库养护关。
5、加强对供应商的质量体系审查,及时淘汰一些质量保障体系比较差,资质不健全的供应商,为公司创造一个优良的供货环境。
华润昆山医药有限公司
质量管理部
2013年1月18日
抄报:经理室
抄送:市场运营管理部、采购部、销售部、物流部。