PCR常见问题分析及对策
- 格式:doc
- 大小:205.50 KB
- 文档页数:9


PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)2009-03-28 11:38问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因: 1.引物特异性差 2.模板或引物浓度过高 3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR 2.适当降低模板或引物浓度 3.适当减少酶量 4.降低镁离子浓度 5.适当提高退火温度或使用二阶段温度法 6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因: 1.模板不纯 2.Buffer不合适 3.退火温度偏低 4.酶量过多 5.dNTP、Mg 2+浓度偏高 6.循环次数过多对策: 1.纯化模板 2.更换Buffer 3.适当提高退火温度 4.适量用酶 5.适当降低dNTP和镁离子的浓度 6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策: 1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外; 2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen) 1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI 上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区 2.引物长度一般在15~30碱基之间。

PCR问题总汇及详细解决方案
PCR的影响因素很多的,尤其试剂的保存,人为的因素都很重要: 看看试剂是否有过期或保存不当,可能出现部分变质所以P不出来,换新的试剂看看
人为也很重要,冰上操作的时间,步骤等对P的效果很有影响,可找实验经验好点的人再试一试.
如果是怀疑仪器方面的问题,我觉得也有可能,可以去别的试验室借PCR仪看看是否能行.
别用自己的胶检测,用别人的胶检测试试,以前我P的很好,但是胶有问题老是扩散,后来用别人的胶试了试,非常赞.
本文针对PCR产物序列中引入了错误怎么办?PCR扩增有时出现涂抹带或片状带或地毯样带?如果没有回收到目的片段,还需要作什么对照实验?或者同时出现特异性扩增带与非特异性扩增带?对照实验结果好,却没有回收到目的片段,实验出了什么问题?
PCR体系是10ul的,每次PCR完了以后,管壁上有一层水气,需不需要覆盖矿务油?加多少,具体步骤应怎样?
PCR加样孔上有很亮的条带,但没有产物条带?
PCR的产量有许多因素决定他们的主次关系是什么,各因素又是怎么调节的?
PCR产物大约有900bP,哪种测序方法比较好?直接用纯化的PCR产物测序还是克隆到T载体上再测序?纯化PCR产物的方法哪种比较好?
引物间形成了比较多的二聚体,使产物很少。
这种情况该怎么处理?
为什么会产生弥散(smear)条带?如何解决?。

PCR反应常见问题汇总(转自tiangen)----PCR常见问题分析及对策1.PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
2.假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR 循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD 值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。

普通PCR常见问题及解决对策普通PCR常见问题及解决对策⼀、普通PCR常见问题及解决对策PCR产物的电泳检测时间⼀般为48h以内,有些最好于当⽇电泳检测,⼤于48h 后带型不规则甚致消失。
1. 假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及活性④PCR循环条件。
寻找原因亦应针对上述环节进⾏分析研究。
1.1 模板①模板中含有杂蛋⽩质,②模板中含有Taq酶抑制剂,③模板中蛋⽩质没有消化除净,特别是染⾊体中的组蛋⽩,④在提取制备模板时丢失过多,或吸⼊酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了⽑病,因⽽要配制有效⽽稳定的消化处理液,其程序亦应固定不宜随意更改。
1.2 酶失活需更换新酶,或新旧两种酶同时使⽤,以分析是否因酶的活性丧失或不够⽽导致假阴性。
需注意的是有时忘加Taq酶或溴⼄锭。
1.3 引物引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物⼀条浓度⾼,⼀条浓度低,造成低效率的不对称扩增,对策为:①选定⼀个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,⼀定要有引物条带出现,⽽且两引物带的亮度应⼤体⼀致,如⼀条引物有条带,⼀条引物⽆条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如⼀条引物亮度⾼,⼀条亮度低,在稀释引物时要平衡其浓度。
③引物应⾼浓度⼩量分装保存,防⽌多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成⼆聚体等。
1.4 Mg2+浓度Mg2+离⼦浓度对PCR扩增效率影响很⼤,浓度过⾼可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚⾄使PCR扩增失败⽽不出扩增条带。
1.5 反应体积的改变通常进⾏PCR扩增采⽤的体积为20ul、30ul、50ul。

PCR技术之——常见问题解析及处理方法我们进行核酸扩增时,往往会不定的出现一些异常问题,本期我给大家搜集了一些平时经常性遇到的一些问题,希望对大家有所帮助。
(一)相对特异性 PCR产物的特异性主要取决于引物链的特异性。
由于存在同源序列,随意设计的引物链,其PCR产物在电泳分析时可能出现多条链,因此在设计引物链时应考虑其绝对特异性和相对特异性。
前者指两条引物链的核苷酸序列只与靶DNA片段互补,后者是指两条引物链的核苷酸序列及两者之间的DNA长度对靶DNA片段是特异的,但亦可与其他区域的DNA片段互补,而其PCR产物的长度与靶DNA片段的扩增产物的长度明显不同,应根据两引物问的DNA片段长度,预计PCR产物的大小,并与电泳分析的DNA片段大小比较.或用寡聚核苷酸限制性内切酶片段分析,或用分子杂交、核苷酸序列分析来测定。
(二)标本中存在的有形成分对反应的抑制这一点主要是针对来自临床标本中的杂质加细菌蛋白质和Taq DNA聚合酶抑制因子,须注意避免污染和去除标本中的杂质;将标本加热煮沸使抑制因子与DNA分离。
对于来自标本中的细胞和细胞器的崩解、核酸酶的激活均可使待检的DNA降解,降解的DNA是Taq DNA聚合酶作用良好底物,能与靶DNA竞争,从而扩增大量的非特异性DNA,这种非特异性DNA会使背景干扰超过了前景信号影响PCR循环扩增效率,减少特异性DNA扩增产量。
(三)Taq DNA聚合酶 Taq DNA聚合酶扩增的特异性受PCR循环次数及延伸时间与温度的影响循环次数太多使延伸时间延长和Taq DNA聚合酶单位用量增长可能导致非特异性扩增;循环次数太少,则不能得到充足的扩增产物,温度不适宜会影响扩增产物数量,延伸温度一般高于复性温度。
(四)复性温度与时间引物与变性DNA的复性温度对PCR 的特异性有影响,复性温度由引物的碱基成分决定。
在低温度(37℃)下复性可出现比扩增DNA长的非特异性扩增带;而在55~60℃复性的扩增带一般是特异的,复性时间过长或过短都会增加非特异性扩增。

.PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低.6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。


PCR实验常见问题、原因分析及其解决方案!PCR产物的电泳检测时间,一般为48h以内,有些最好于当日进行检查,大于48h后带型不规章甚至消逝。
但有时仍会与到这样那样的问题,影响检测结果的推断,详细归类为以下常见的4点,描述如下:问题一:无扩增产物现象:正对比有条带,而样品则无。
缘由:1、模板:含有抑制物,含量低。
2、Buffer对样品不合适。
3、引物设计不当或者发生降解。
4、反应条件:退火温度太高,延长时间太短。
对策:1、纯化模板或者使用试剂盒提取模板DNA或加大模板的用量。
2、更换Buffer或调整浓度。
3、重新设计引物(避开链间二聚体和链内二级结构)或者换一管新引物。
4、降低退火温度、延长延长时间。
问题二:非特异性扩增现象:条带与估计的大小不全都或者非特异性扩增带。
缘由:1、引物特异性差。
2、模板或引物浓度过高。
3、酶量过多。
4、Mg2+浓度偏高。
5、退火温度偏低。
6、循环次数过多。
对策:1、重新设计引物或者使用巢式PCR。
2、适当降低模板或引物浓度。
3、适当削减酶量。
4、降低镁离子浓度。
5、适当提高退火温度或使用二阶段温度法。
6、削减循环次数。
问题三:拖尾现象:产物在凝胶上呈Smear状态。
缘由:1、模板不纯。
2、Buffer不合适。
3、退火温度偏低。
4、酶量过多。
5、dNTP、Mg 2+浓度偏高。
6、循环次数过多。
对策:1、纯化模板。
2、更换Buffer。
3、适当提高退火温度。
4、适量用酶。
5、适当降低dNTP和镁离子的浓度。
6、削减循环次数。
问题四:假阳性现象:空白对比消失目的扩增产物。
缘由:靶序列或扩增产物的交叉污染。
对策:1、操作时应当心轻柔,防止将靶序列吸入加样枪内或溅出离心管外。
2、除酶及不能耐高温的物质外,全部试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3、各种试剂最好先进行分装,然后低温贮存。
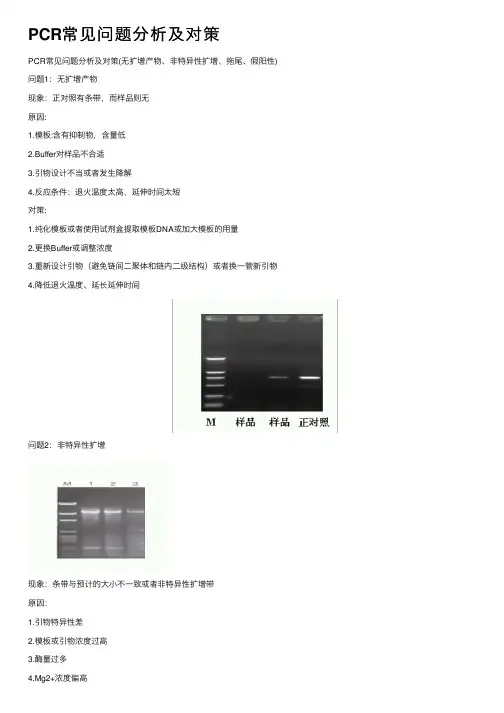
PCR常见问题分析及对策PCR常见问题分析及对策(⽆扩增产物、⾮特异性扩增、拖尾、假阳性)问题1:⽆扩增产物现象:正对照有条带,⽽样品则⽆原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发⽣降解4.反应条件:退⽕温度太⾼,延伸时间太短对策:1.纯化模板或者使⽤试剂盒提取模板DNA或加⼤模板的⽤量2.更换Buffer或调整浓度3.重新设计引物(避免链间⼆聚体和链内⼆级结构)或者换⼀管新引物4.降低退⽕温度、延长延伸时间问题2:⾮特异性扩增现象:条带与预计的⼤⼩不⼀致或者⾮特异性扩增带原因:1.引物特异性差2.模板或引物浓度过⾼3.酶量过多4.Mg2+浓度偏⾼5.退⽕温度偏低6.循环次数过多对策:1.重新设计引物或者使⽤巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离⼦浓度5.适当提⾼退⽕温度或使⽤⼆阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退⽕温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏⾼6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提⾼退⽕温度4.适量⽤酶5.适当降低dNTP和镁离⼦的浓度6.减少循环次数问题4:假阳性现象:空⽩对照出现⽬的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应⼩⼼轻柔,防⽌将靶序列吸⼊加样枪内或溅出离⼼管外;2.除酶及不能耐⾼温的物质外,所有试剂或器材均应⾼压消毒。
所⽤离⼼管及加样枪头等均应⼀次性使⽤。
3.各种试剂最好先进⾏分装,然后低温贮存琼脂糖凝胶电泳回收PCR产物⼀.原理DNA⽚断的分离与回收是基因⼯程操作中的⼀项重要技术,例如可收集特定酶切⽚断⽤于克隆或制备探针,回收PCR产物⽤于再次鉴定等。
回收实验中两个最重要的技术指标是纯度和回收率:前者未达标时会严重影响以后的酶切、连接、标记等酶参与的反应;后者不理想时往往会⼤⼤增加前期的⼯作量。

PCR常见问题及解决方法PCR常见问题及解决方法1)、不出现扩增条带a)、引物设计有误:核对引物设计方案。
b)、扩增体系配制错误:重复实验。
c)、扩增反应条件不优化:调整Mg2+浓度、酶量、扩增程序。
d)、模板质粒质量偏差:长期放置、反复冻融会导致模板质粒断裂、开环或降解,应使用新鲜制备的质粒作为模板。
e)、模板的GC含量:GC含量过高会导致DNA的双链无法完全打开,此时加入Vazyme(诺唯赞生物)的PCR Enhancer(货号P021)可以有效降低解链温度;GC 含量过低会导致扩增效率较差,可适当延长引物长度或通过TD PCR摸索合适的反应条件。
2)、出现非特异性扩增带a)、引物设计不够优化:引物与靶序列有非特异性互补或自身聚合成二聚体,可降低引物浓度进行优化,必要时重新设计引物。
b)、模板不纯:模板被污染,需重新制备模板。
c)、试验条件不够优化:如果出现比目的条带小的杂带,可通过提高退火温度、降低循环数调整;如果出现比目的条带大的杂带,可缩短延伸时间、降低循环数;另外,可降低Mg2+及酶的浓度。
3)、条带弥散或拖尾a)、模板降解或过量:可通过电泳检查模板完整性及浓度,必要时重新纯化模板,对于简单模板(例如质粒、λDNA),每50ul反应使用1pg-10ng DNA;对于复杂模板(例如基因组、cDNA),每50ul反应使用1ng-1ug DNA。
b)、酶量加太多:如Vazyme(诺唯赞生物)的高保真系列:50ul反应体系加1U,Taq系列:50ul体系加2U。
4)、条带很暗a)、增加模板量,提高循环数。
b)、多扩几管,胶回收浓缩。
5)、产物有错配a)、检查原始模板是否原本就是突变或错配的。
b)、少量序列存在非严谨序列,有相似重组序列,导致重组错位。
PCR常见问题分析与对策PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
⑤模板核酸变性不彻底。
在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改。
酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性。
需注意的是有时忘加Taq酶或溴乙锭。
引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因。
有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位。
②引物的浓度不仅要看OD值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR有可能失败,应和引物合成单位协商解决。
如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度。
③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效。
④引物设计不合理,如引物长度不够,引物之间形成二聚体等。
Mg2+浓度:Mg2+离子浓度对PCR扩增效率影响很大,浓度过高可降低PCR扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR扩增失败而不出扩增条带。
反应体积的改变:通常进行PCR扩增采用的体积为20ul、30ul、50ul。
或100ul,应用多大体积进行PCR扩增,是根据科研和临床检测不同目的而设定,在做小体积如20ul后,再做大体积时,一定要模索条件,否则容易失败。
PCR 常见问题及解决方案1没有扩展条带可能的原因及对应的解决方案如下:酶失活或在反应体系中未加入酶。
Taq DNA 聚合酶因保存或运输不当而失活,往往通过更换新酶或用另一来源的酶以获得满意的结果。
模板含有杂质。
特别是对甲醛固定及石蜡包埋的组织常含甲酸,造成DNA 脱嘌呤而影响PCR 的结果。
变性温度是否准确:PCR 仪指示温度与实际温度是否相符,过高酶在前几个循环就迅速失活;过低则模板变性不彻底。
反应系统中污染了蛋白酶及核酸酶,应在未加Taq 酶以前,将反应体系95℃加热5~10 分钟。
引物变质失效。
人工合成的引物是否正确。
是否纯化,或因储存条件不当而失活。
引物错误。
利用BLAST 检查引物特异性或重新设计引物。
DNA 凝胶电泳时加入阳性对照,确保不是DNA 凝胶和PCR 程序的问题。
2PCR 产物量过少可能的原因和对应的解决方案如下:退火温度不合适。
以 2 度为梯度设计梯度PCR 反应优化退火温度。
DNA 模板量太少。
增加DNA 模板量。
PCR 循环数不足。
增加反应循环数。
引物量不足。
增加体系中引物含量。
延伸时间太短。
以 1 kb/分钟的原则设置延伸时间。
变性时间过长。
变性时间过长会导致DNA 聚合酶失活。
DNA 模板中存在抑制剂。
确保DNA 模板干净3扩增产物跑电泳条带弥散可能的原因和对应的解决方案如下:酶量过高。
减少酶量;酶的质量差,调换另一来源的酶。
dNTP 浓度过高。
减少dNTP 的浓度。
MgCl₂浓度过高。
可适当降低其用量。
模板量过多。
质粒DNA 的用量应<50 ng,而基因组DNA 则应<200 ng。
引物浓度不够优化。
对引物进行梯度稀释重复PCR 反应。
循环次数过多;增加模板量减少循环次数至30,缩短退火时间及延伸时间,或改用二种温度的PCR 循环。
退火温度过低。
电泳体系有问题:①凝胶中缓冲液和电泳缓冲液浓度相差太大;②凝胶没有凝固好;③琼脂糖质量差。
若为PCR 试剂盒则可能:①由于运输储存不当引起试剂盒失效;②试剂盒本身质量有问题,如引物选择、循环参数等选择不当。
问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存。
PCR检测常见问题与解决途径利用PCR方法检测转基因成分时,经常出现假阳性、假阴性、非特异性扩增和涂抹带;尤其是假阳性和假阴性可使检测结果得出错误结论,有时可造成严重后果;为了提高转基因检测的准确性和可靠性,PCR检测应尽量减少假阳性、假阴性、非特异性扩增和涂抹带现象的发生;一个好的PCR方法不但要求特异性好、灵敏度高、还要求具有高的可重复性、重现性、鲁棒性,尽量减少假阳性、假阴性和非特异性扩增;本文对PCR检测中出现的假阳性、假阴性、非特异性扩增和涂抹带的原因及其解决方法予以综述;一、假阳性:一假阳性现象假阳性是指检测阴性材料得到阳性结果;如果一次实验中的几个阴性对照中出现一个或几个阳性结果,提示本次实验中其它标本的检测结果可能有假阳性;实验中设立的阴性对照可提示有无假阳性结果出现;二造成假阳性的原因1. 样品间交叉污染:样本污染主要有收集样本的容器被污染,或样本放置时,由于密封不严溢于容器外,或容器外粘有样本而造成相互间交叉污染;样本核酸模板在提取过程中,由于吸样枪污染导致标本间污染;2. PCR试剂的污染:主要是由于在PCR试剂配制过程中,由于加样枪、容器、双蒸水及其它溶液被PCR核酸模板污染;3. PCR扩增产物污染:这是PCR反应中最主要最常见的污染问题;因为PCR产物拷贝量大一般为1013拷贝/ml,远远高于PCR检测数个拷贝的极限,所以极微量的PCR产物污染,就可形成假阳性;4. 气溶胶污染:在空气与液体面摩擦时就可形成气溶胶,在操作时比较剧烈地摇动反应管,开盖时、吸样时及污染进样枪的反复吸样都可形成气溶胶而污染;据计算一个气溶胶颗粒可含48000拷贝,因而由其造成的污染是一个值得特别重视的问题;5. 实验室中克隆质粒的污染:由于克隆质粒在单位容积内含量相当高,另外在纯化过程中需用较多的用具及试剂,而且在活细胞内的质粒,由于活细胞的生长繁殖的简便性及具有很强的生命力,其污染可能性也很大;在分子生物学实验室及某些用克隆质粒做阳性对照的检验室,这个问题比较常见;三假阳性问题的试验控制在每次PCR检测时,一定设立阴性对照样品和阳性对照样品;阴性对照样品检测为阴性时,表明试验全部过程的试剂没有受到污染;阳性对照样品检测为阳性时,表明DNA提取RNA提取、RNA反转录、DNA扩增和电泳鉴定工作体系正常;在阴性对照样品和阳性对照样品检测结果成立的前提下,才能对检测样品进行判定;只有设立试验全程的对照,才能证明试验结果成立;造成假阴性的原因可以通过设置试验对照来查找;试验对照包括:1、DNA阳性对照:以含有目的片段的DNA或质粒作为模板进行扩增,证明PCR试剂是否有效、扩增过程是否正确及待测样品中是否含有目的片段;注意:阳性样品扩增效率高,应严格控制,避免其成为潜在的污染源;2、DNA阴性对照:以不含有目的片段的阴性样品作为模板进行扩增,用于证明扩增过程中无假阳性现象;3、空白对照:以纯水作为模板进行扩增,用于证明扩增过程中无假阳性现象;4、PCR抑制物对照:在与阳性对照相同的反应体系中,加入相同数量的待测样品DNA,如果未扩增出目的片段,证明此待测样品DNA中存在PCR抑制物;5、空白提取对照:空白提取对照扩增结果为阳性,说明DNA提取试剂可能受到污染;6、阳性提取对照:阳性提取对照扩增结果为阴性,说明提取过程可能有误;如果DNA阳性对照扩增结果为阴性,或者DNA阴性对照和空白对照扩增结果为阳性,则说明PCR试剂或扩增过程存在问题;四假阳性解决途径由于PCR 的敏感性和效率特别高,所以少量的扩增产物污染标本或反应管即可出现假阳性;尤其是PCR扩增产物和质粒分子很容易造成实验室的污染,导致假阳性现象发生;1、规范实验室设计实验室设置上分配液区、DNA提取区、扩增区、电泳区;物流应按分配液区、模板提取区、扩增区、电泳区顺序,严禁倒流;在连续而独立的空间中完成不同实验步骤;不同工作区域相互隔离,通过传递仓传递;PCR前处理区样品制备室、DNA提取室和PCR准备室设置正压通风系统,并设置通风柜或生物反应柜造成局部负压;后PCR室PCR室及电泳室为高度污染区设置负压通风系统,防止大量游离分子及气溶胶,对其它区域造成环境污染;配制PCR反应体系配备冰箱及生物安全柜,此实验室要求无模板DNA存在和向PCR 反应体系中加入模板DNA配备生物安全柜及冰箱要求在不同区域进行;2、规范试剂耗材管理1验证:新购买的试剂需进行实验前验证;2分装:双蒸水、引物和dNTP均应分装储存,并标明日期,以防污染;试剂的分装应在装有紫外灯的超净工作台上进行;试剂分装成小份一次使用后弃去;3消毒:除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒;必要时,在加样本前,反应管和试剂用紫外线照射,以破坏存在的核酸;3、规范实验室操作1控制污染源:PCR产物和质粒操作空间是最大的污染源,应严格防止将这个空间的物品带出;2一次性用具:使用实验服和一次性手套,使用带有滤膜的移液器枪头,一次性反应管和离心管;3定期消毒:定期对实验室进行紫外照射,用10%漂白剂、3%双氧水或专用商业产品清理实验室台面及死角;4定期通风:对实验室定期进行正压、负压通风处理;5小心操作:操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;加样时,最后加阳性对照;4、技术处理1在DNA 模板和多聚酶加入前,紫外线照射反应管内容物以破坏污染的PCR 产物;一般选用波长254nm 照射30min Nature , 1990 , 34:27 ;2PCR 实验中使用dUTP ,而不用dTTP ;在扩增前使用UraciI N 一g1ycosylase 尿嘧啶糖基化酶处理可降解交叉污染的PCR 产物,而不降解基困组DNA 模板,然后热灭活此酶,再进行扩增反应Gene,1990,93:125;美国PE 公司提供此类试剂盒;3在PCR 反应前加入一种光化学试剂,反应完成后激活该试剂,光化学试剂可交联DNA 链,使之不能再扩增Nucleic Acids Res,1991,19 :99;二、假阴性一假阴性现象与判断方法如果实验中设置的阳性对照未能扩增成阳性结果,提示本次实验中可能有假阴性结果;但这里应注意,许多国产PCR试剂盒中阳性对照采用质粒DNA,和标本相比来说,不需纯化提取核酸的步骤,因此,如果在标本核酸纯化提取步骤有问题,即使阳性对照均呈阳性,标本检测中还可能有假阴性;设置内标准基因对照是判断假阴性较好的指示系统;在每一反应管中同时对内标准基因对照进行扩增,若内标准基因对照未能扩增出来,说明该反应管的结果可能有问题;二造成假阴性的原因1.仪器因素PCR实验对仪器的依赖性是很高的,离心机、扩增仪都是造成PCR假阴性的因素;扩增仪的主要问题是孔间差,引起扩增失败或扩增效率降低;而离心机的影响则更容易被忽视;国内使用离心机很少使用离心加速度XXXg作为参数指标,而常使用转数作为参数指标,这里就存在着一个问题,由于离心机的大小不同,有效跳心半径也不相同,因此同样的转速所产生的离心力相差很大有的在数倍以上,所以在相同的离心时间下,有可能模板并没有离心下来,造成PCR假阴性;这个问题在其他实验也有,但因其他实验都是测定大分子蛋白沉淀,对离心的速度要求较低所以不太明显;建议使用小型台式离心机的实验要注意一下这个问题;2.试剂质量问题PCR实验的成功与否试剂的质量至关重要,试剂的质量问题涉及多个方面:细胞的裂解;模板的抽提;引物位点的选择;Taq酶的活性等等;其中任一环节出了问题都会引起结果的假阴性;这些都是试剂质量的问题,因此选用高质量的PCR试剂非常重要;酶失活:需更换新酶,或新旧两种酶同时使用,以分析是否因酶的活性丧失或不够而导致假阴性;需注意的是有时忘加Taq 酶或溴乙锭;引物:引物质量、引物的浓度、两条引物的浓度是否对称,是PCR失败或扩增条带不理想、容易弥散的常见原因;有些批号的引物合成质量有问题,两条引物一条浓度高,一条浓度低,造成低效率的不对称扩增,对策为:①选定一个好的引物合成单位;②引物的浓度不仅要看OD 值,更要注重引物原液做琼脂糖凝胶电泳,一定要有引物条带出现,而且两引物带的亮度应大体一致,如一条引物有条带,一条引物无条带,此时做PCR 有可能失败,应和引物合成单位协商解决;如一条引物亮度高,一条亮度低,在稀释引物时要平衡其浓度; ③引物应高浓度小量分装保存,防止多次冻融或长期放冰箱冷藏部分,导致引物变质降解失效;3.核酸模板问题1模板中含有杂蛋白质;2模板中含有Taq 酶抑制剂;3模板中蛋白质没有消化除净,特别是染色体中的组蛋白;4在提取制备模板时丢失过多,或吸入酚;5模板核酸变性不彻底;在酶和引物质量好时,不出现扩增带,极有可能是标本的消化处理,模板核酸提取过程出了毛病,因而要配制有效而稳定的消化处理液,其程序亦应固定不宜随意更改;4、物理原因:PCR仪控温不准,也是PCR 失败的原因之一;有时还有必要用标准的温度计,检测一下扩增仪内的变性、退火和延伸温度;5、靶序列变异:如靶序列发生突变或缺失,影响引物与模板特异性结合,或因靶序列某段缺失使引物与模板失去互补序列,其PCR 扩增是不会成功的;6.操作人员素质问题PCR实验的环节很多,而且对每一环节的质量要求都很高,例如少加、漏加试剂、离心不充分、循环参数设计错误等等都能造成结果的假阴性;三假阴性问题的试验控制在每次PCR检测时,一定设立阴性对照样品和阳性对照样品;阴性对照样品检测为阴性时,表明试验全部过程的试剂没有受到污染;阳性对照样品检测为阳性时,表明DNA提取RNA提取、RNA反转录、DNA扩增和电泳鉴定工作体系正常;在阴性对照样品和阳性对照样品检测结果成立的前提下,才能对检测样品进行判定;造成假阴性的原因可以通过设置试验对照来查找;试验对照包括:1、DNA阳性对照:以含有目的片段的DNA或质粒作为模板进行扩增,证明PCR试剂是否有效、扩增过程是否正确及待测样品中是否含有目的片段;注意:阳性样品扩增效率高,应严格控制,避免其成为潜在的污染源;2、DNA阴性对照:以不含有目的片段的阴性样品作为模板进行扩增,用于证明扩增过程中无假阳性现象;3、空白对照:以纯水作为模板进行扩增,用于证明扩增过程中无假阳性现象;4、PCR抑制物对照:在与阳性对照相同的反应体系中,加入相同数量的待测样品DNA,如果未扩增出目的片段,证明此待测样品DNA中存在PCR抑制物;5、空白提取对照:空白提取对照扩增结果为阳性,说明DNA提取试剂可能受到污染;6、阳性提取对照:阳性提取对照扩增结果为阴性,说明提取过程可能有误;如果DNA阳性对照扩增结果为阴性,或者DNA阴性对照和空白对照扩增结果为阳性,则说明PCR试剂或扩增过程存在问题;四假阴性解决方案1.反应体系不灵敏:1检查PCR试剂是否失效;2检验引物是否降解:3优化PCR 扩增体系与程序;2、PCR反应存在抑制物:1稀释模板DNA,进行扩增分析;2纯化模板DNA,除去蛋白质、多酚、多糖等抑制物;3检测PCR体系中是否含有扩增抑制物;3、DNA提取失败:1选择与优化样品DNA提取方法;2验证DNA提取试剂是否失效;三.非特异扩增一现象PCR 扩增后出现的条带与预计的大小不一致,或大或小,或者同时出现特异性扩增带与非特异性扩增带;非特异性条带的出现,二原因:1. 引物设计与浓度问题引物设计:引物碱基的G+C含量以40-60%为宜,G+C太少扩增效果不佳,G+C过多易出现非特异条带;ATGC最好随机分布,避免5个以上的嘌呤或嘧啶核苷酸的成串排列;避免引物内部出现二级结构,避免两条引物间互补,特别是3'端的互补,否则会形成引物二聚体,产生非特异的扩增条带;引物3'端的碱基,特别是最末及倒数第二个碱基,应严格要求配对,以避免因末端碱基不配对而导致PCR失败;引物应与核酸序列数据库的其它序列无明显同源性;引物浓度:每条引物的浓度0.1~1umol或10~100pmol,以最低引物量产生所需要的结果为好,引物浓度偏高会引起错配和非特异性扩增,且可增加引物之间形成二聚体的机会;2. Mg2+离子浓度过高:在一般的PCR反应中,各种dNTP浓度为200umol/L时,Mg2+浓度为1.5~2.0mmol/L为宜;Mg2+浓度过高,反应特异性降低,出现非特异扩增,浓度过低会降低Taq DNA聚合酶的活性,使反应产物减少;3. 退火温度过低:变性后温度快速冷却至40℃~60℃,可使引物和模板发生结合;由于模板DNA 比引物复杂得多,引物和模板之间的碰撞结合机会远远高于模板互补链之间的碰撞;退火温度与时间,取决于引物的长度、碱基组成及其浓度,还有靶基序列的长度;对于20个核苷酸,G+C含量约50%的引物,55℃为选择最适退火温度的起点较为理想;引物的复性温度可通过以下公式帮助选择合适的温度:Tm值解链温度=4G+C+2A+T复性温度=Tm值-5~10℃在Tm值允许范围内, 选择较高的复性温度可大大减少引物和模板间的非特异性结合, 提高PCR反应的特异性;复性时间一般为30~60sec,足以使引物与模板之间完全结合;4. PCR循环次数过多:当其它参数确定之后,循环次数主要取决于DNA 浓度;一般而言25-30轮循环已经足够;循环次数过多,会使PCR 产物中非特异性产物大量增加;通常经25-30 轮循环扩增后,反应中Taq DNA 聚合酶已经不足, 如果此时产物量仍不够,需要进一步扩增,可将扩增的DNA 样品稀释103-105倍作为模板,重新加入各种反应底物进行扩增,这样经60 轮循环后,扩增水平可达109-1010;扩增产物的量还与扩增效率有关,扩增产物的量可用下列公式表示:C=Co1+P n;其中:C 为扩增产物量,C0 为起始DNA 量, P 为增效率, n 为循环次数;在扩增后期,由于产物积累,使原来呈指数扩增的反应变成平坦的曲线,产物不再随循环数而明显上升,这称为平台效应;平台期会使原先由于错配而产生的低浓度非特异性产物继续大量扩增,达到较高水平;因此,应适当调节循环次数,在平台期前结束反应,减少非特异性产物;5. 酶的质和量,催化一典型的PCR反应约需酶量2.5U指总反应体积为100ul时,浓度过高可引起非特异性扩增,浓度过低则合成产物量减少; 往往一些来源的酶易出现非特异条带而另一来源的酶则不出现,酶量过多有时也会出现非特异性扩增;四.PCR扩增出现涂抹带1、原因:往往由于酶量过多或酶的质量差,dNTP浓度过高,Mg2+浓度过高,退火温度过低,循环次数过多引起;2、对策:1 减少酶量,或调换另一来源的酶;2减少dNTP的浓度;3适当降低Mg2+浓度;4增加模板量,减少循环次数;五、标准问题转基因成分检测一般按照标准方法进行,引物和PCR反应体系一般都经过了严格的循环验证;有时标准方法可能存在问题,导致假阳性、假阴性、非特异性扩增和涂抹带的产生;标准方法可能存在的问题有:1.引物设计不合适:选择的扩增序列与非目的扩增序列有同源性,因而在进行PCR 扩增时,扩增出的PCR 产物为非目的性的序列;靶序列太短或引物太短,容易出现假阳性;2. Mg2+ 浓度不合理:Mg2+ 离子浓度对PCR 扩增效率影响很大,浓度过高可降低PCR 扩增的特异性,浓度过低则影响PCR扩增产量甚至使PCR 扩增失败而不出扩增条带;3. 反应体积的改变:通常进行PCR 扩增采用的体积为20ul 、30ul 、50ul ;或100ul ,应用多大体积进行PCR 扩增,是根据检测不同目的而设定,在做小体积如20ul 后,再做大体积时,一定要模索条件,否则容易失败;4.PCR温度设置不合理:变性对PCR 扩增来说相当重要,如变性温度低,变性时间短,极有可能出现假阴性;退火温度过低,可致非特异性扩增而降低特异性扩增效率退火温度过高影响引物与模板的结合而降低PCR 扩增效率;六、检测极限问题当样品中转基因成分很低时,反应体系内可能不含有扩增模版,因而容易造成假阴性结果;PCR理论检测极限是在反应体系中存在一个拷贝的目标DNA分子,由于人的判读能力限制和PCR效率等原因,定性检测实际极限值一般是理论检测极限值的10-30倍;也就是说,如果转基因成分低到检测极限时,检测不到转基因成分的可能性会很大,或者说出现假阴性的概率很大;出现假阴性的原因是由于抽样误差,反应体系中不存在有效扩增的模版分子;此时是不适合做PCR检测的;根据作物基因组的大小,可以计算出不同作物的理论检测极限并估计出实际检测极限;例如在100微升的反应体系中,小麦基因组有0.58万个拷贝,一个转基因拷贝的重量比理论检测极限是0.0174%,玉米的理论检测极限是0.003,其他作物的理论检测极限一般在0.001%-0.01%;如果反应体系是20微升,理论检测极限值将提高5倍,小麦为0.085%,玉米为0.015%, 其他作物将在0.005-0.05%之间;反应体系是20微升的定性检测实际极限值一般是在0.05-0.5%;低于这个含量时,反应体系中有时不含扩增模版DNA,因此很难得到正确的检测结果;七.怎样查找污染源如果不慎发生污染情况,应从下面几条出发,逐一分析,排除污染;一设立阴阳性对照:有利于监测反应体系各成分的污染情况;选择阳性对照时,应选择扩增弱,且重复性好的样品,因强阳性对照可产生大量不必要的扩增序列,反而可能成为潜在的污染源;如果以含靶序列的重组质粒为对照,100 个拷贝之内的靶序列就足以产生阳性扩增;阴性对照的选择亦要慎重,因为PCR 敏感性极高,可以从其它方法Sourthern 印迹或点杂交等检测阴性的标本中检测出极微量的靶分子;此外,每次扩增均应包括PCR 体系中各试剂的时机对照,即包括PCR 反应所需的全部成分,而不加模板DNA,这对监测试剂中PCR 产物残留污染是非常有益的;如果扩增结果中试剂对照为阳性结果,就是某一种或数种试剂被污染了;此时,要全部更换一批新的试剂进行扩增,扩增时设立不同的反应管,每一管含有一种被检测试剂,在检出污染试剂后,应马上处理;二环境污染:在排除试剂污染的可能性外,更换试剂后,若不久又发现试剂被污染了,如果预防措施比较严密,则考虑可能为环境污染;环境污染中常见的污染源主要有:1. 模板提取时真空抽干装置;2. 凝胶电泳加样器;3. 电泳装置;4. 紫外分析仪;5. 切胶用刀或手术刀片;6. 离心机;7. 冰箱门把手,冷冻架,门把手或实验台面等;此时可用擦拭实验来查找可疑污染源:1用无菌水浸泡过的灭菌棉签擦拭可疑污染源;20.1ml 去离子水浸泡;3取5ml 做PCR 实验;4电泳检测结果;8. 气溶胶;如果经过上述追踪实验,仍不能查找到确切污染源,则污染可能是由空气中PCR 产物的气溶胶造成的,此时就应该更换实验场所,若条件不允许,则重新设计新的引物与原引物无相关性;八.污染处理一环境污染1. 稀酸处理法:对可疑器具用1mol/L 盐酸擦拭或浸泡,使残余DNA 脱嘌呤;2. 紫外照射UV法:紫外波长nm一般选择254/300nm,照射30min 即可;需要注意的是,选择UV 作为消除残留PCR 产物污染时,要考虑PCR 产物的长度与产物序列中碱基的分布,UV 照射仅对500bp 以上长片段有效,对短片段效果不大;UV 照射时,PCR产物中嘧啶碱基会形成二聚体,这些二聚体可使延伸终止,但并不是DNA 链中所有嘧啶均能形成二聚体,且UV 照射还可使二聚体断裂;形成二聚体的程度取决于UV 波长,嘧啶二聚体的类型及与二聚体位点相邻核苷酸的序列;在受照射的长DNA 链上,形成二聚体缺陷的数量少于0.065/碱基,其他非二聚体的光照损伤如环丁烷型嘧啶复合体,胸腺嘧啶乙二醇,DNA 链间与链内的交联和DNA 断裂等均可终止Taq DNA 聚合酶的延伸;这些位点的数量与二聚体位点相当;如果这些位点0.13/碱基在DNA 分子上随机分布,一个500bp片段的DNA 分子链上将有32 处损伤位点,那么,105个这样的分子中每个分子中会至少有一处损伤;相反,如果100bp 的片段,每条链上仅有 6 处损伤,105个拷贝分子中将有许多分子没有任何损伤;这就是UV 照射有一定的片段长度限制的原因;二反应液污染可采用下列方法之一处理:1. DNase I 法:PCR 混合液未加模板和Taq 聚合酶加入0.5U DNase I,室温反应30min 后加热灭活,然后加入模板和Taq 聚合酶进行正常PCR 扩增;该方法的优点是不需要知道污染DNA 的序列;2. 内切酶法:选择识别4 个碱基的内切酶如Msp I 和Taq I 等,可同时选择几种,以克服用一种酶只能识别特定序列的缺陷,室温作用1h 后加热灭活进行PCR;3. 紫外照射法:未加模板和Taq 聚合酶的PCR 混合液进行紫外照射,注意事项与方法同上述UV 照射法;4. g 射线辐射法:1.5kGy 的辐射可完全破坏0.1ng 基因组DNA,2.0 kGy 可破坏104 拷贝的质粒分子,4.0 kGy 仍不影响PCR,但高于此限度会使PCR 扩增效率下降;引物可受照射而不影响PCR,g 射线是通过水的离子化产生自由基来破坏DNA 的;三尿嘧啶糖苷酶UNG法由于UV 照射的去污染作用对500bp 以下的片段效果不好,而临床用于检测的PCR 扩增片段通常为300bp 左右,因此UNG 的预防作用日益受到重视和肯定;1. 原理:在PCR 产物或引物中用dU 代替dT;这种dU 化的PCR 产物与UNG 一起孵育,因UDG 可裂解尿嘧啶碱基和糖磷酸骨架间的N-糖基键,可除去dU 而阻止TaqDNA 聚合酶的延伸,从而失去被再扩增的能力;UNG 对不含dU 的模板无任何影响;UNG 可从单或双链DNA 中消除尿嘧啶,而对RNA 中的尿嘧啶和单一尿嘧啶分子则无任何作用;. dUTP 法:用dUTP 代替dTTP,使产物中掺入大量dU;在再次进行PCR 扩增前,用UNG 处理PCR 混合液即可消除PCR 产物的残留污染;由于UNG 在PCR 循环中的变性一步便可被灭活,因此不会影响含dU 的新的PCR 产物;3. dU 引物法:合成引物时以dU 代dT,这样PCR 产物中仅5ˊ端带dU;UNG 处理后,引物失去了结合位点而不能扩增;对长片段1-2kb 以上的扩增用dUTP 法效率较用dTTP 低,而用dU 法就可克服这一缺点;dU 引物最好将dU 设计在3ˊ端或近ˊ端;该法仅能用于引物以外试剂的处理;4. 优点:可以去除任何来源的污染;UNG 处理可以和PCR 扩增在同一个反应管内进行;由于扩增产物中有大量dU 存在,可彻底消除污染源;。
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性) 问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR产物的电泳检测时间一般为48h以内,有些最好于当日电泳检测,大于48h后带型不规则甚致消失。
假阴性,不出现扩增条带PCR反应的关键环节有①模板核酸的制备,②引物的质量与特异性,③酶的质量及,④PCR循环条件。
寻找原因亦应针对上述环节进行分析研究。
模板:①模板中含有杂蛋白质,②模板中含有Taq酶抑制剂,③模板中蛋白质没有消化除净,特别是染色体中的组蛋白,④在提取制备模板时丢失过多,或吸入酚。
PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30碱基之间。
引物长度(primer length)常用的是18-27 bp,但不应大于38,因为过长会导致其延伸温度大于74℃,不适于Taq DNA 聚合酶进行反应。
3.引物GC含量在40%~60%之间,Tm值最好接近72℃。
GC含量(composition)过高或过低都不利于引发反应。
上下游引物的GC含量不能相差太大。
另外,上下游引物的Tm值(melting temperature)是寡核苷酸的解链温度,即在一定盐浓度条件下,50%寡核苷酸双链解链的温度。
有效启动温度,一般高于Tm值5~10℃。
若按公式Tm= 4(G+C)+2(A+T)估计引物的Tm值,则有效引物的Tm为55~80℃,其Tm值最好接近72℃以使复性条件最佳。
4.引物3′端要避开密码子的第3位。
如扩增编码区域,引物3′端不要终止于密码子的第3位,因密码子的第3位易发生简并,会影响扩增的特异性与效率。
5.引物3′端不能选择A,最好选择T。
引物3′端错配时,不同碱基引发效率存在着很大的差异,当末位的碱基为A时,即使在错配的情况下,也能有引发链的合成,而当末位链为T时,错配的引发效率大大降低,G、C错配的引发效率介于A、T之间,所以3′端最好选择T。
6. 碱基要随机分布。
引物序列在模板内应当没有相似性较高,尤其是3’端相似性较高的序列,否则容易导致错误引发(False priming)。
降低引物与模板相似性的一种方法是,引物中四种碱基的分布最好是随机的,不要有聚嘌呤或聚嘧啶的存在。
尤其3′端不应超过3个连续的G或C,因这样会使引物在GC富集序列区错误引发。
7. 引物自身及引物之间不应存在互补序列。
引物自身不应存在互补序列,否则引物自身会折叠成发夹结构(Hairpin)使引物本身复性。
这种二级结构会因空间位阻而影响引物与模板的复性结合。
引物自身不能有连续4个碱基的互补。
两引物之间也不应具有互补性,尤其应避免3′ 端的互补重叠以防止引物二聚体(Dimer与Cross dimer)的形成。
引物之间不能有连续4个碱基的互补。
引物二聚体及发夹结构如果不可避免的话,应尽量使其△G值不要过高(应小于4.5kcal/mol)。
否则易导致产生引物二聚体带,并且降低引物有效浓度而使PCR 反应不能正常进行。
8. 引物5′ 端和中间△G值应该相对较高,而3′ 端△G值较低。
△G值是指DNA 双链形成所需的自由能,它反映了双链结构内部碱基对的相对稳定性,△G值越大,则双链越稳定。
应当选用5′ 端和中间△G值相对较高,而3′ 端△G值较低(绝对值不超过9)的引物。
引物3′ 端的△G 值过高,容易在错配位点形成双链结构并引发DNA 聚合反应。
(不同位置的△G值可以用Oligo 6软件进行分析)9.引物的5′端可以修饰,而3′端不可修饰。
引物的5′ 端决定着PCR产物的长度,它对扩增特异性影响不大。
因此,可以被修饰而不影响扩增的特异性。
引物5′ 端修饰包括:加酶切位点;标记生物素、荧光、地高辛、Eu3+等;引入蛋白质结合DNA序列;引入点突变、插入突变、缺失突变序列;引入启动子序列等。
引物的延伸是从3′ 端开始的,不能进行任何修饰。
3′ 端也不能有形成任何二级结构可能。
10. 扩增产物的单链不能形成二级结构。
某些引物无效的主要原因是扩增产物单链二级结构的影响,选择扩增片段时最好避开二级结构区域。
用有关软件(比如RNAstructure)可以预测估计mRNA的稳定二级结构,有助于选择模板。
实验表明,待扩区域自由能(△G°)小于58.6l kJ/mol时,扩增往往不能成功。
若不能避开这一区域时,用7-deaza-2′-脱氧GTP取代dGTP对扩增的成功是有帮助的。
11. 引物应具有特异性。
引物设计完成以后,应对其进行BLAST检测。
如果与其它基因不具有互补性,就可以进行下一步的实验了。
值得一提的是,各种模板的引物设计难度不一。
有的模板本身条件比较困难,例如GC含量偏高或偏低,导致找不到各种指标都十分合适的引物;用作克隆目的的PCR,因为产物序列相对固定,引物设计的选择自由度较低。
在这种情况只能退而求其次,尽量去满足条件。
做Real Time时,用于SYBR Green I法时的一对引物与一般PCR的引物,在引物设计上所要求的参数是不同的。
引物设计的要求:1)避免重复碱基,尤其是G.2)Tm=58-60度。
3)GC=30-80%.4)3'端最后5个碱基内不能有多于2个的G或C.5)正向引物与探针离得越近越好,但不能重叠。
6)PCR扩增产物长度:引物的产物大小不要太大,一般在80-250bp之间都可;80~150 bp最为合适(可以延长至300 bp)。
7)引物的退火温度要高,一般要在60度以上;要特别注意避免引物二聚体和非特异性扩增的存在。
而且引物设计时应该考虑到引物要有不受基因组DNA污染影响的能力,即引物应该跨外显子,最好是引物能跨外显子的接头区,这样可以更有效的不受基因组DNA污染的影响。
至于设计软件,PRIMER3,PRIMER5,PRIMER EXPRESS都应该可以的。
做染料法最关键的就是寻找到合适的引物和做污染的预防工作。
对于引物,你要有从一大堆引物中挑出一两个能用的引物的思想准备---寻找合适的引物非常不容易。
关于BLAST的作用应该是通过比对,发现你所设计的这个引物,在已经发现并在GENEBANK中公开的不物种基因序列当中,除了和你的目标基因之外,还有没有和其他物种或其他序列当中存在相同的序列,如和你的目标序列之外的序列相同的序列,则可能扩出其他序列的产物,那么这个引物的特异性就很差,从而不能用。
PCR操作规程PCR与定量PCR反应最大的魅力是扩增能力与高灵敏度,但易污染一直是困扰各实验室的大问题,极微量的污染就可能造成假阳性反应,破坏实验结果。
如何监测与防止PCR污染,是现在各实验室的重要课题。
一、污染监测一个好的PCR实验室,必须要时刻注意污染的监测,考虑是否受到污染,如有污染,是何原因造成的。
通过有效地监测,采取正确的相应措施,防止或消除污染。
对照实验是监测PCR污染的重要手段。
1. 阴性对照:阴性对照是每次PCR实验都必须做的。
它包括了标本对照与试剂对照,通过对照确认样本和试剂是否受到感染。
2. 阳性对照:它是PCR反应是否成功、产物条带位置及大小是否合乎理论要求的一个重要的参考标志。
阳性对照要选择扩增度中等、重复性好、经鉴定是该产物的标本。
但阳性对照其对检测或扩增样品污染的可能性很大。
因而当某一PCR试剂已经使用稳定,检验人员完全掌握时,在之后的实验中应尽可能免设阳性对照。
来减小污染概率。
3. 选择不同区域的引物进行PCR扩增。
4. 重复性试验。
二、防止污染的方法1. 合理分隔实验室:将样品的处理、配制PCR反应液、PCR循环扩增以及PCR产物的鉴定等步骤进行分区或者分室,尤其要将样本处理和PCR产物的鉴定与其它步骤严格分开。
理想的分区为,标本处理区、PCR 反应液制备区、PCR循环扩增区、PCR产物鉴定区。
Real-time PCR实验攻略实验中必须坚持的一些好习惯1. 加入试剂之前,把它混匀一下,以免放置时间长了浓度不均。
2. 移液枪用完之后要归到最大计量的位置,防止久而久之弹簧失去弹性。
3. 所有的试剂都自己配,出了问题才好找原因一. 防止RNA酶污染的措施。
一、防止RNA酶污染的措施1. 所有的玻璃器皿均应在使用前于180 ℃的高温下干烤6 h或更长时间。
2. 塑料器皿可用0.1% DEPC水浸泡或用氯仿冲洗(注意:有机玻璃器具因可被氯仿腐蚀,故不能使用)。
3. 有机玻璃的电泳槽等,可先用去污剂洗涤,双蒸水冲洗,乙醇干燥,再浸泡在3% H2O2室温10 min,然后用0.1% DEPC水冲洗,晾干。
4. 配制的溶液应尽可能的用0.1% DEPC,在37 ℃处理12 h以上。
然后用高压灭菌除去残留的DEPC。
不能高压灭菌的试剂,应当用DEPC处理过的无菌双蒸水配制,然后经0.22 μm滤膜过滤除菌。
5. 操作人员戴一次性口罩. 帽子. 手套,实验过程中手套要勤换。
6. 设置RNA操作专用实验室,所有器械等应为专用。
动植物总RNA提取-Trizol法Trizol法适用于人类. 动物. 植物. 微生物的组织或培养细菌,样品量从几十毫克至几克。
用Trizol法提取的总RNA绝无蛋白和DNA污染。
RNA可直接用于Northern斑点分析,斑点杂交, Poly(A)+分离,体外翻译,RNase封阻分析和分子克隆。
在收集到生物材料之后,最好能即刻进行RNA制备工作。
若需暂时储存,则应以液氮将生物材料急速冷冻后,储存于-80 ℃冷冻柜。
在制备RNA时,将储存于冷冻柜的材料取出,立即以加入液氮研磨的方式打破细胞,不可以先行解冻,以避免RNase的作用。