硝酸还原酶的测定方法
- 格式:doc
- 大小:63.50 KB
- 文档页数:7


一、原理硝酸还原酶是植物氮素作用中的关键性酶,与作物吸收和利用N肥有关的不同品种,年龄、器官组织以及环境条件对硝酸还原活性都有影响,硝酸还原酶作用于NO3使还原为NO2NO3-+NADH+H→NO2- +NAD+H2O产生的NO2- 可以从组织内渗到外界溶液中,并积累在溶液中因此测定反应溶液中NO2- 的含量的增加,即表明酶活性的大小。
NO2- 含量的测定用对氨基苯磺酸化比色法,亚硝酸对氨基苯磺酸和α-萘胺在酸性条件下生成红色化合物,颜色在2-3小时稳定,可用比色法定量,该法非常灵敏,能测定每毫升0.5微克的Na NO2。
二、仪器和药品721型分光光度计(或其他型号比色计),剪刀,真空泵(或注射器),小天平,温箱,烧杯,移液管,小烧杯(50ml)0.2MKNO3:将20、22克KNO3溶于100ml蒸馏水中。
0.1M磷酸缓冲液(PH=7.5):将85.2%ml 1/15M磷酸氢二钠与14.8ml 1/15M磷酸二氢钾混合均匀。
1/15MNa2HPO4溶液:1000ml中含Na2HPO4•2H2O11.878克。
1/15M溶液:1000ml中含KH2PO49.078克。
对氨基苯磺酸试剂:1克对氨基苯硝酸加加25ml浓HCl,用蒸馏稀释至100ml.。
α–萘胺试剂,0.2克α–萘胺加25ml浓HCl,用蒸馏稀释至100ml。
NaNO2标准溶液:1克NaNO2用蒸馏水溶解至1000ml,然后吸取5ml,再加蒸馏水稀释成1000ml,该溶液每毫升含有NaNO2 5微克,用时稀释之。
三、实验步骤:1、将新鲜叶片(蓖麻、向日葵、小麦、棉花等),用水冲洗净,并用吸水纸吸干,用剪刀剪成小块(注意块小为宜),然后在小天平上称取等重的两份叶片,每份约0.5克。
分别置于含有下列溶液的小烧杯中。
(1)1M磷酸缓冲溶液5ml+蒸馏水5ml(2)0.1M磷酸缓冲溶液5ml+0.2M KNO35ml然后将小烧杯置于真空干燥器中,接上真空泵抽气,放气后叶片便沉于底部(如没有真空泵,也可以20ml注射器代替,将反应液及叶片一起倒入注射器使之真空,如此进行抽气、放气反复多次,溶液即可渗入叶组织内取代了叶片内的空气,叶片便沉于溶液底部),取出小烧杯置于30℃温箱中,使不见光保温作用30分钟。

硝酸还原酶活性测定实验报告硝酸还原酶活性测定实验报告引言:硝酸还原酶是一种重要的酶类,在生物体内负责将硝酸盐还原为亚硝酸盐。
硝酸还原酶活性的测定对于研究生物体对硝酸盐的代谢和环境污染物的检测具有重要意义。
本实验旨在探究硝酸还原酶的活性测定方法,并通过实验验证其可行性和准确性。
材料与方法:1. 实验材料:- 0.1 mol/L 磷酸盐缓冲液(pH 7.0)- 0.1 mol/L 硝酸钠溶液- 0.1 mol/L 硫酸铵溶液- 1% 硫胺素溶液- 10% 硝酸盐还原酶提取液- 10% 硝酸盐还原酶抑制剂- 2% 硝酸盐还原酶底物溶液- 0.1 mol/L 硫酸铵铵铁硫氰化物溶液- 0.1 mol/L 醋酸溶液- 蒸馏水2. 实验仪器:- 分光光度计- 定量移液器- 离心机- 恒温水浴槽- 试管架- 显微镜实验步骤:1. 提取硝酸盐还原酶:a. 取一定量的样品(如细胞或组织),加入磷酸盐缓冲液,用搅拌器充分破碎。
b. 将破碎后的样品转移至离心管中,以12000 rpm离心10分钟。
c. 取上清液,即为硝酸盐还原酶提取液。
2. 硝酸还原酶活性测定:a. 准备一组空白对照组,加入相同体积的磷酸盐缓冲液代替硝酸盐还原酶提取液。
b. 准备一组实验组,加入一定体积的硝酸盐还原酶提取液。
c. 分别加入一定体积的硝酸钠溶液、硫酸铵溶液、硫胺素溶液和硝酸盐还原酶底物溶液。
d. 在恒温水浴槽中,将反应体系恒温30分钟。
e. 加入硝酸盐还原酶抑制剂停止反应。
f. 加入硫酸铵铵铁硫氰化物溶液,使反应产生红色沉淀。
g. 加入醋酸溶液,混匀后离心10分钟。
h. 取上清液,以分光光度计测定其吸光度。
结果与讨论:通过实验测定,我们得到了一组吸光度数据。
根据吸光度与硝酸还原酶活性之间的关系,我们可以计算出样品中硝酸还原酶的活性。
在本实验中,我们采用了硫酸铵铵铁硫氰化物法测定硝酸还原酶活性。
该方法利用硝酸还原酶将硝酸盐还原为亚硝酸盐,再与硫酸铵铵铁硫氰化物反应生成红色沉淀。


硝酸还原酶的测定一、实验目的和要求掌握体内法测定植物组织中硝酸还原酶的原理和方法,阐明诱导酶的含义。
2、实验内容与原则硝酸还原酶(nr)是植物氮素同化的关键酶,与作物吸收和利用氮肥有关。
它催化植物体内的硝酸盐还原为亚硝酸盐:--产生的NO2可以从组织渗透到外部溶液中,并在溶液中累积。
NO2含量的增加表明酶的活性增加。
装no2含量的测定用磺胺比色法。
在酸性溶液中产生的亚硝酸盐与对c氨基苯磺酸(或对c氨基苯磺酰-订线(胺)反应生成重氮,然后与αC萘胺(或萘基乙二胺)反应生成紫红色偶氮化合物。
生成的红色偶氮化合物在540nm波长处有最大吸收峰,可通过分光光度法测定。
溶液中NO2-的含量可用标准曲线测定。
3、主要仪器设备1、实验仪器分光光度计,真空泵,温箱,天平,2个烧杯,移液管若干,试管3支,剪刀。
2、实验试剂0.1mol/lph7.5的磷酸缓冲液,对-氨基苯磺酸溶液,α-萘胺溶液,亚硝酸钠标准液3.两组大麦幼苗在15-25℃的蒸馏水中培养一周。
一组用硝酸钾治疗,另一组用氯化铵治疗。
四、操作方法和实验步骤1.切两组新鲜叶片。
一组为0.51g处理苗,另一组为0.50g对照苗。
将叶片分别切成0.5~1cm的碎片并压实。
2、两组中各加入15ml的酶促反应液。
3.真空提取10min,充分交换细胞内外液。
4.盖上盖子,在30℃的培养箱中保存20分钟。
5、去除材料,用移液管取4ml反应液,加入2ml磺胺,加入2ml苯基,放置15min。
6、比色:在540nm的波长下分光光度测定亚硝酸的od值。
7.空白管:4ml H2O+2ml磺酰胺溶液+2ml萘乙二胺溶液?在室温下放置15分钟后,在540nm处用分光光度法测定亚硝酸的OD值。
五、实验数据记录和处理称重:处理过的幼苗0.51g;对照苗0.50god值:处理苗0.513a;对照苗0.050aNO2含量标准曲线:y=257.29x-4.8262(x=OD值;y=NO2含量(nmol))。
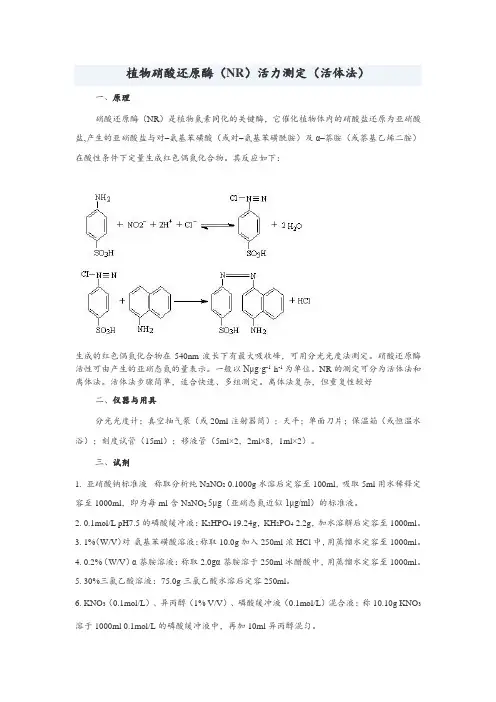
植物硝酸还原酶(NR)活力测定(活体法)一、原理硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α–萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。
其反应如下:生成的红色偶氮化合物在540nm波长下有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以Nμg·g-1·h-1为单位。
NR的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好二、仪器与用具分光光度计;真空抽气泵(或20ml注射器筒);天平;单面刀片;保温箱(或恒温水浴);刻度试管(15ml);移液管(5ml×2,2ml×8,1ml×2)。
三、试剂1. 亚硝酸钠标准液称取分析纯NaNO2 0.1000g水溶后定容至100ml,吸取5ml用水稀释定容至1000ml,即为每ml含NaNO2 5μg(亚硝态氮近似1μg/ml)的标准液。
2. 0.1mol/L pH7.5的磷酸缓冲液:K2HPO4 19.24g,KH2PO4 2.2g,加水溶解后定容至1000ml。
3. 1%(W/V)对-氨基苯磺酸溶液:称取10.0g加入250ml浓HCl中,用蒸馏水定容至1000ml。
4. 0.2%(W/V)α-萘胺溶液:称取2.0gα-萘胺溶于250ml冰醋酸中,用蒸馏水定容至1000ml。
5. 30%三氯乙酸溶液:75.0g三氯乙酸水溶后定容250ml。
6. KNO3(0.1mol/L)、异丙醇(1% V/V)、磷酸缓冲液(0.1mol/L)混合液:称10.10g KNO3溶于1000ml 0.1mol/L的磷酸缓冲液中,再加10ml异丙醇混匀。
四、方法1. 标准曲线制作取7支洁净烘干的15ml刻度试管按表13-1顺序加试剂,即配成0-2.0μg的系列标准亚硝态氮溶液。

硝酸还原酶原理:以KNO3为基质,土壤样品置于封闭的试管中,在淹水条件下25℃培养24h。
硝酸还原酶被2,4-DNP抑制。
培养后,释放的亚硝态氮被氯化钾提取,用分光光度计在520nm测定。
试剂:2,4-DNP溶液(0.9mM)称取166.6mg 2,4-DNP溶解于蒸馏水中,加热使之完全溶解,定容为1L。
每种土样的最适抑制剂2,4-DNP的量为5-300ug。
基质液(25 mM)溶解2.53g KNO3于蒸馏水中,定容为1L。
氯化钾溶液(4M)溶解298.24g KCl于蒸馏水,定容为1L。
氯化铵缓冲液(0.19M,pH 8.5)溶解10g NH4Cl溶解于900ml蒸馏水中,用NH4OH调节pH为8.5,用蒸馏水定容为1L。
显色液溶解2g 磺胺和0.1g N-(1-萘基)乙二胺盐酸盐于150ml蒸馏水中,加入20ml 磷酸。
冷却至室温,定容到200ml。
溶液应该是无色的,且需在实验当天制备。
标准贮备液(1000 ugNO2--N·ml-1)溶解4.9257 Na NO2于蒸馏水中,定容为1L。
4℃可保存数周。
标准工作液(10 ugNO2--N·ml-1)取标准贮备液5ml 定容至500ml。
标准曲线吸取0,2,4,8,10ml 标准工作液于100ml 容量瓶中,加入50ml KCl溶液中,用蒸馏水定容。
标准曲线NO2--N的浓度分别为0,0.2,0.4,0.8和1.0 ug·ml-1。
实验步骤:称取5g 鲜土于三个刻度试管中,加入4ml 2,4-DNP溶液,1ml KNO3基质液和5ml 蒸馏水,混匀,盖上塞子。
将其中两个试管在25℃培养24h,另外一个在-20℃培养24h(对照),培养结束后在室温解冻。
每个试管中加入10ml KCl溶液,混匀,迅速过滤。
取5ml 滤液,加入3ml NH4Cl缓冲液,2ml 显色液,混匀,室温下显色15min。
以试剂空白为对照,在520nm测定样品和对照的吸光度,标准曲线分别取5ml,操作同滤液。

硝酸还原酶活性的测定一.试验原理:硝酸还原酶是植物氮素代谢作用中的关键酶,与作物吸收和利用硝态氮的能力相关。
它催化NO3-还原为NO2-的反应:NO3-+NADH+H+→NO2-+NAD++H2O反应产生的NO2-可从组织内渗透到外界溶液中,定时测定一定的反应溶液中NO2-含量的变化情况则可了解此酶的活性大小。
NO2-的定量测定是用磺胺比色法。
此法简单易行而又非常灵敏,可测出0.5微克/ml NaNO2含量的变化。
二.试剂:磷酸缓冲液(Na2HPO4.12H2O NaH2PO4.2H2O) KNO3溶液磺胺试剂α-萘胺试剂 NaNO2标准溶液1. 0.1molpH7.5的磷酸缓冲液:Na2HPO4.12H2O 30.0905g与NaH2PO4.2H2O2.4965g加去离子水溶解后定容至1000ml;2. 0.2 mol/L KNO3:称取 KNO3 20.22 g,用蒸馏水溶解,移入100 mL 容量瓶中,用水定容至刻度,摇匀。
3.磺胺(对氨基苯磺酸胺)试剂:1克磺胺溶于25毫升浓盐酸后再用蒸馏水稀释至100 ml 。
4.α-萘胺试剂:0.2克α萘胺溶于25 ml 浓盐酸中,再用蒸馏水稀释至100 ml 。
5.NaNO2标准溶液:1克NaNO2溶于1000ml 蒸馏水中配成NaNO2母液。
实验时按处理稀释成要求浓度。
如1微克/ ml :取母液1ml ,用蒸馏水稀释成1000 ml 。
三.仪器721型分光光度计真空泵保温箱天平真空干燥器打孔器三角瓶移液管烧杯四.试验步骤1.将新鲜取回的材料叶片用水清洗后用吸水纸吸干水份。
用打孔器取下直径为1厘米的圆片,再用蒸馏水洗2-3次,将蒸馏水吸干。
在天平上称取等重的叶子园片两份:每份0.4克左右(或每份取50个圆片)。
将两份圆片分别置于下列两种溶液中,容器使用50ml 三角瓶。
(1)0.1 M 磷酸缓冲液5 ml +蒸馏水5 ml 。
(2)0.1 M 磷酸缓冲液5 ml +0.2 M KNO3溶液5 ml 。

硝酸还原酶测定方法
硝酸还原酶是一种广泛存在于细菌、真菌、植物和动物等生物体中的酶类,具有催化硝酸还原生成亚硝酸的作用。
亚硝酸可进一步催化生成氮气或氨,参与到氮循环中。
硝酸还原酶测定方法是用来量化硝酸还原酶的活性,以便研究和评价生物体中氮代谢的过程和生态系统中的氮循环。
直接测定法是通过测定硝酸还原酶催化硝酸还原生成亚硝酸的速率来评价其活性。
其中较常用的方法是通过测定硝酸盐浓度的变化来间接测定亚硝酸的含量,进而计算硝酸还原酶的活性。
具体方法如下:
1.取一定量的细胞提取液或组织,加入含有硝酸钠的反应溶液。
2.在一定的时间内,将反应溶液分别加入苯磺酰胺和二甲基苯胺的混合液中,生成偶氮染料,并在550nm波长下测定其吸光度。
3.利用已知浓度的硝酸盐标准曲线,计算出样品中硝酸盐的浓度。
4.根据硝酸还原酶反应硝酸盐生成亚硝酸的速率,计算出硝酸还原酶的活性。
间接测定法是通过测定硝酸还原酶催化还原剂(如戊二醛、甲醇、NADH等)的还原速率来评价其活性。
具体方法如下:
1.取一定量的细胞提取液或组织,加入含有硝酸钠和还原剂的反应溶液。
2.在一定的时间内,测定反应溶液中还原剂的消耗量或其产生的氧化产物(如NAD+)的生成量。
3.根据还原剂的消耗量或产生的氧化产物的生成量,计算硝酸还原酶的活性。
此外,还有一些特殊的测定方法,如溶液散射法、电化学法等,可以根据实验需要进行选择。
总结起来,硝酸还原酶测定方法是通过不同的分析手段测量硝酸还原酶的活性,从而研究和评价氮代谢的过程和生态系统中的氮循环。
不同的测定方法适用于不同的实验需求,科研人员可以根据具体情况选择合适的方法进行研究。

硝酸还原酶活性的测定一、原理硝酸还原酶是植物氮素作用中的关键性酶,与作物吸收和利用N肥有关的不同品种,年龄、器官组织以及环境条件对硝酸还原活性都有影响,硝酸还原酶作用于NO3使还原为NO2NO3⎯+NADH+H→NO2⎯+NAD+H2O产生的NO2⎯可以从组织内渗到外界溶液中,并积累在溶液中因此测定反应溶液中NO2⎯的含量的增加,即表明酶活性的大小。
NO2⎯含量的测定用对氨基苯磺酸化比色法,亚硝酸对氨基苯磺酸和α-萘胺在酸性条件下生成红色化合物,颜色在2-3小时稳定,可用比色法定量,该法非常灵敏,能测定每毫升0.5微克的Na NO2。
二、仪器和药品721型分光光度计(或其他型号比色计),剪刀,真空泵(或注射器),小天平,温箱,烧杯,移液管,小烧杯(50ml)0.2MKNO3:将20、22克KNO3溶于100ml蒸馏水中。
0.1M磷酸缓冲液(PH=7.5):将85.2%ml 1/15M磷酸氢二钠与14.8ml 1/15M磷酸二氢钾混合均匀。
1/15MNa2HPO4溶液:1000ml中含Na2HPO4•2H2O11.878克。
1/15M溶液:1000ml中含KH2PO49.078克。
对氨基苯磺酸试剂:1克对氨基苯硝酸加加25ml浓HCl,用蒸馏稀释至100ml.。
α–萘胺试剂,0.2克α–萘胺加25ml浓HCl,用蒸馏稀释至100ml。
NaNO2标准溶液:1克NaNO2用蒸馏水溶解至1000ml,然后吸取5ml,再加蒸馏水稀释成1000ml,该溶液每毫升含有NaNO2 5微克,用时稀释之。
三、实验步骤:1、将新鲜叶片(蓖麻、向日葵、小麦、棉花等),用水冲洗净,并用吸水纸吸干,用剪刀剪成小块(注意块小为宜),然后在小天平上称取等重的两份叶片,每份约0.5克。
分别置于含有下列溶液的小烧杯中。
(1)1M磷酸缓冲溶液5ml+蒸馏水5ml(2)0.1M磷酸缓冲溶液5ml+0.2M KNO35ml然后将小烧杯置于真空干燥器中,接上真空泵抽气,放气后叶片便沉于底部(如没有真空泵,也可以20ml注射器代替,将反应液及叶片一起倒入注射器使之真空,如此进行抽气、放气反复多次,溶液即可渗入叶组织内取代了叶片内的空气,叶片便沉于溶液底部),取出小烧杯置于30℃温箱中,使不见光保温作用30分钟。

植物生理研究技术实验报告实验二硝酸还原酶活性的测定硝酸还原酶的诱导与活体测定硝酸还原酶的诱导与活体测定一、实验目的硝酸还原酶是一种诱导酶,广泛地存在于高等植物的根、茎、叶等组织中,它是植物氮素代谢中一个非常重要的酶,此酶还直接影响到土壤中无机氮的利用率,从而对植物的生长、发育以及产量和品质产生影响。
所以,作物栽培中,有人认为此酶活性的大小,可作为作物产量的生理指标。
本实验通过磺胺(或对氨基苯磺酸)比色法测定硝酸还原酶的活性,来了解植物生长发育期间氮素的营养水平,为合理施肥提供科学依据。
二、实验原理硝酸还原酶是植物氮素代谢作用中的关键性酶,与作物吸收和利用氮肥有关。
它作用于N03-使之还原为NO2-:N03-+NADH+H+→NO2-+NAD++H20产生的NO2-可以从组织内渗透到外界溶液中,并积累在溶液中,测定反应溶液中NO2-含量的增加,即表现该酶活性的大小。
这种方法简单易行,在一般条件下都能做到。
NO2-含量的测定用磺胺比色法。
在酸性条件下,对氨基苯磺酰胺与NO2-形成重氮盐,再与a一萘胺形成红色的偶氮染料化合物。
反应液的酸度大则增加重氮化作用的速度,但降低偶联作用的速度,颜色比较稳定。
增加温度可以增加反应速度,但降低重氮盐的稳定度,所以反应需要在相同条件下进行。
这种方法非常灵敏,能测定每毫升含0.5µg的NaNO2。
硝酸还原酶活性的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
本次实验学习活体法对硝酸还原酶进行测定。
三、实验材料、设备和试剂1.实验材料小麦叶片2.设备(1)分光光度计(2)真空泵(或注射器) (3)天平(4)移液管(5)试管(6)离心管3.试剂(1)0.1 mol·L-1磷酸缓冲液,pH7.5。
贮备液A:称分析纯磷酸二氢钠(NaH2PO4)2.78 g,配成100mL,即成0.2 mol·L-1NaH2P04溶液;贮备液B:称Na2HPO4·12H2O 7.17 g,配成100 mL,即成0.2 mol·L-1 Na2HPO4溶液;用时取贮备液A 16 mL,贮备液B 84 mL混合,用蒸馏水稀释至200 mL,即成为0.1 mol·L-1的磷酸缓冲液。
实验5 硝酸还原酶活性的测定【实验目的】掌握硝酸还原酶活性测定的两种方法,加深对硝酸还原酶在植物体氮素代谢中作用的理解。
【实验原理】硝酸还原酶(nitrate reductase,NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,(NO3-+NADH + H+→NO2-+NAD ++H2O)。
产生的亚硝酸盐与对-氨基苯磺酸(or 对-氨基苯磺酰胺)及α-萘胺(or 萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。
其反应如下:生成的红色偶氮化合物在540nm有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般单位鲜重以Nμg/(g﹒h)为单位。
NR的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
Ⅰ离体法【材料设备】(三)试剂1、NaNO2标准溶液:准确称取分析纯NaNO20.1g溶于无离子水后定容至100ml,然后再吸取1ml用蒸馏水稀释成1000ml,该溶液每毫升含有NaNO21μg,用时稀释之。
2、0.1mol/L PH7.5的磷酸缓冲液,Na2HPO4·12H2O 30.0905g与NaH2PO4·2H2O 2.4965g加去离子水溶解后定容至1000mL。
3、1%(m/V)对氨基苯磺酸(磺胺酸)溶液:1.0g 对氨基苯磺酸溶于100ml 3 mol/L的HCL中(25ml浓盐酸加水定容至100ml 即为 3 mol/LHCL)。
4、0.02%(m/V)萘基乙烯胺溶液:0.0200g萘基乙烯胺溶于100mL 去离子水中,贮于棕色瓶中。
5、0.1mol/L KNO3溶液:2.5275g KNO3溶于250mL 0.1mol/L Ph7.5的磷酸缓冲液中.6、0.025mol/L Ph 8.7 的磷酸缓冲液:8.8640g Na2HPO4·12H2O,0.0570g KH2PO4.3H2O,溶于1 000ml去离子水中。
实验二、硝酸还原酶活性的测定-活体法[原理]:硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对-氨基苯磺酸(或对-氨基苯磺酰胺)及α-萘胺(或萘基乙烯胺)在酸性条件下定量生成红色偶氮化合物。
生成的红色偶氮化合物在540nm有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以每克鲜重含氮量表示,即以ug.g-1.h-1为单位。
NR 的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
[试剂]1.亚硝酸钠标准溶液:准确称取分析纯NaNO20.9857g溶于去离子水后定容至1 000ml,然后再吸取5ml定容至1000ml,即为含亚硝态氮1ug.ml-1的标准液;2.0.1molpH7.5的磷酸缓冲液:Na2HPO4.12H2O30.0905g与NaH2PO4.2H2O 2.4965g加去离子水溶解后定容至1 000ml;3.1%(W/V)溶液:1.0g 对氨基苯磺酸溶于100ml 3 mol.L-1HCL中(25ml浓盐酸加水定容至100ml 即为 3 mol.L-1HCL);4.0.02%(W/V)萘基乙烯胺溶液:0.020g萘基乙烯胺溶于100ml 去离子水中,贮于棕色瓶中;5.0.1mol.L-1KNO3溶液:2.5275g KNO3溶于250Ml 0.1mol.L-1Ph7.5的磷酸缓冲液中;6.0.025mol.L-1Ph 8.7 的磷酸缓冲液:8.864 0g Na2HPO4.12H2O,0.0570g KH2OP4.3H2O,溶于1 000ml去离子水中;7.30%三氯乙酸溶液:30g三氯乙酸。
水溶后定容至100ml。
[方法]摇匀后在25度下保温30min,然后在540nm下比色测定。
以亚硝态氮(ug)为横坐标(X),吸光值为纵坐标(Y)建立回归方程。
2.样品中硝酸还原酶活力测定1.在取材的前一天加50mmol/L KNO3或NaNO3到培养苗的水中就可以诱导酶的产生。
硝酸还原酶(NR)活性的测定硝酸还原酶(NR)活性的测定主要采用光度法和荧光法。
光度法测定硝酸还原酶活性的步骤如下:1. 准备0.1 M磷酸盐缓冲液(pH 7.5)。
2. 准备硝酸钠(NaNO3)的不同浓度标准溶液。
3. 取一定量的细胞提取物,加入适量的磷酸盐缓冲液,使得体积总量达到一定的体积。
4. 在一条白色或透明的96孔板中,分别加入相同体积的磷酸盐缓冲液和不同浓度的NaNO3标准溶液。
5. 加入适量的细胞提取物到每一孔中,混匀。
6. 在适当的温度下孵育一定的时间。
7. 加入 Griess 试剂(硫酸铁铵与草酰胺的混合溶液)到每个孔中。
8. 在深色环境下,测量每个孔的吸光度值。
9. 利用吸光度值与所加入的NaNO3标准溶液浓度之间的关系,绘制标准曲线。
10. 根据待测样品的吸光度值及标准曲线,计算出硝酸还原酶活性。
荧光法测定硝酸还原酶活性的步骤如下:1. 准备0.1 M磷酸盐缓冲液(pH 7.5)。
2. 准备硝酸钠(NaNO3)的不同浓度标准溶液。
3. 取一定量的细胞提取物,加入适量的磷酸盐缓冲液,使得体积总量达到一定的体积。
4. 在一条黑色的96孔板中,分别加入相同体积的磷酸盐缓冲液和不同浓度的NaNO3标准溶液。
5. 加入适量的细胞提取物到每一孔中,混匀。
6. 在适当的温度下孵育一定的时间。
7. 加入荧光探针(如草酰胺二乙酸盐,DAF-FM DA)到每个孔中。
8. 在荧光酶标仪中,设置适当的激发波长和发射波长,测量每个孔的荧光强度。
9. 利用荧光强度与所加入的NaNO3标准溶液浓度之间的关系,绘制标准曲线。
10. 根据待测样品的荧光强度及标准曲线,计算出硝酸还原酶活性。
硝酸还原酶活性的测定试剂:1、亚硝酸钠标准溶液:称取分析纯亚硝酸钠0.1000克,水溶后定容至100毫升。
吸取此液5毫升用水喜事定容至1000毫升,即为每毫升含亚硝酸钠5微克的标准液体。
2、0.1M pH7.5磷酸缓冲液:0.2M磷酸氢二钠溶液84.0毫升,加0.2M磷酸二氢钠溶液16.0毫升,混匀即可。
3、0.2M硝酸钾:称10.11克硝酸钾溶于水定容至500毫升。
4、1%对氨基苯磺酸:称1克对氨基苯磺酸加25ml浓盐酸,用水定溶至100毫升。
5、0.2%α—萘胺:称0.2克α—萘胺加25毫升冰乙酸,水定容至100毫升。
6、30%三氯乙酸:75.0克三氯乙酸水溶后定容至250毫升。
操作步骤:1、标准曲线的制作:取6支洗净烘干的试管,按下表加入各种试剂,即配成浓度为0—5.0微克/毫升将试管中溶液充分混合摇匀,向每个试管中加入4毫升对氨基苯磺酸,摇匀,再加4毫升α—萘胺,摇匀后在35℃水浴中保温20分钟。
然后在520nm波长下测其消光值。
以亚硝酸钠含量(微克)为横坐标,以消光值为纵坐标绘制标准曲线。
2、酶反应和酶活性的测定:将取回的材料(材料可以选用小麦、玉米、白菜、油菜、烟叶等作物的叶片)用水洗净,再用蒸馏水冲洗,然后用纱布和滤纸吸干。
将材料剪成0.5cm2左右的小块,混合均匀后分别称取三份,每份0.5—1.0克,然后分别放入三只50ml 的三角瓶中,编号后按下表加入各种试剂:然后将三角瓶置于真空干燥器中,接上真空泵抽气10分钟。
放气后叶片变软并沉入溶液。
将三角瓶取出放入恒温箱,在30℃、暗条件下保温30分钟。
取出后向2、3号瓶分别加入1毫升三氯乙酸以终止酶反应。
将各瓶中的反应液离心(3000转/分,10分钟),然后分别吸取反应液2毫升测定其NO2—含量。
结果与计算亚硝酸娜微克数×稀释倍数(10)酶活性(亚硝酸钠微克/克鲜重·小时)=样品重(克)×时间(小时)。
硝酸还原酶的测定试剂:1、亚硝酸钠标准液:称取分析纯NaNO2 0.1000g水溶后定容至100毫升,吸取5毫升用水稀释定容至1000毫升。
2、0.1mol/lpH7.5的磷酸缓冲液K2HPO419.24g,KH2PO42.2g,加水溶解后定容至1000毫升。
3、1% 对氨基苯磺酸溶液:称取1.0g加入25毫升浓盐酸中,用蒸馏水定容至100毫升。
4、0.2% α—萘胺溶液:称取0.2g α—萘胺溶于25毫升冰醋酸中,用蒸馏水定容至100毫升。
5、30%三氯乙酸溶液:75.0g三氯乙酸,水溶后定容至250毫升。
6、KNO3·异丙醇·磷酸缓冲液混合液:称3.03g KNO3溶于300毫升0.1mol/l 的磷酸缓冲液中,再加3毫升异丙醇混匀。
方法1、标准曲线的制作:取7支干洁的15毫升刻度试管按下表顺序加试剂,摇匀蒸馏水 2.0 1.8 1.6 1.2 0.8 0.4 0.0 摇匀4 4 4 4 4 4 4 摇匀1% 对氨基苯磺酸4 4 4 4 4 4 4 摇匀0.2% α—萘胺溶液每管含亚硝酸态0 0.2 0.1 0.8 1.2 1.3 2.02、酶反应和酶活性测定:①取样:将材料洗净,用蒸馏水冲洗,滤纸吸干,剪成0.5-1.0平方厘米的小块,混匀后每个样品称0.5-1.0克3份,放入试管并编号。
②反应:向各试管中加入KNO3·异丙醇·磷酸缓冲液混合液9毫升,其中一管立即加1毫升30%三氯乙酸溶液,混匀(作对照)。
然后将所有试管置真空干燥器中接真空泵抽气,反复几次直至叶片沉在管底。
将各试管置30度下于黑暗中保温30分钟,分别向处理管加1毫升30%三氯乙酸溶液,摇匀终止酶活性。
③:比色:将各试管静止2分钟吸取上清液2毫升加入另一组试管,分别加入1% 对氨基苯磺酸溶液4毫升和0.2% α—萘胺溶液4毫升,摇匀显色30分钟,以对照为空白,在540nm波长比色,并计算酶活性。
硝酸还原酶
原理:
脱氢作用强度
在存在H的供体时及厌气条件下,测定反映前后硝酸态氮与酚二磺酸作用的蓝色反应差数,用于表示硝酸还原酶活性测定。
试剂:
1.1% KNO3:1g溶于100ml纯水中
2.1%葡萄糖溶液:1g溶于100ml纯水中
3.铝钾矾饱和溶液
4.酚二磺酸:取3g 熏蒸酚与37g(20.1ml)浓硫酸混合,在沸水浴上回流加热6h即成,
若有结晶析出,加热,但不可加水。
5.10% 氢氧化钠
6.KNO3标准溶液:
精确称取分析纯KNO3 0.7218g溶于1L水中(1L含有100mg NO3-N)。
NO3-N工作标准溶液:取100 mg/L NO3-N母液10ml用水定容到100ml即可。
标曲:
吸取10mg/L NO3-N工作标准溶液分别为0 ,1,3,5,7,9,11ml,用纯水稀释定容到50ml,浓度分别为0,0.2 ,0.6,1.0 ,1.4,1.8 ,2.2、
过程:
取1g过1mm筛风干土置于100ml减压三角牌中加20mg碳酸钙和1ml 1%硝酸钾,充分混合后,加1ml 1%葡萄糖(作为H的供体)将此混合液抽气3min(并不是决定的3min,抽气气压达到15-20mmhg柱3min),稍微摇晃三角瓶,置于30度恒温箱中培养24h,培养结束后,加入50ml水和1ml硫酸铝钾饱和溶液后,过滤后(慢速定量7cm滤纸)再吸取溶液1ml用水定容到50ml,用紫外双波分光光度计进行比色。
计算:。
硝酸还原酶的测定方法硝酸还原酶活性的测定原理硝酸还原酶是植物氮素代谢作用中关键性酶,与作物吸收和利用氮简单易行,在一般条件下都能做到。
红色的偶氮染料。
反应液的酸度大则增加重氮化作用的速度,但降低偶联作用的速度,颜色比较稳定。
增加温度可以增加反应速度,但降低重氮盐的稳定度,所以反应需要在相同条件下进行。
这种方法非常灵敏,能测定每ml含0.5μg的NaNO2。
仪器药品721型分光光度计真空泵(或注射器)保温箱天平真空干燥器钻孔器三角烧瓶移液管烧杯0.1mol/L磷酸缓冲液,pH7.5(见附表2)。
0.2mol/L KNO3:溶解20.22g KNO3于1000ml 蒸馏水器中。
磺胺试剂:1g磺胺加25ml浓盐酸,用蒸馏水器稀释至100ml。
α—萘胺试剂:0.2gα—萘胺溶于含1ml浓盐酸的蒸馏水器中,稀释至100ml。
NaNO2标准溶液:1g NaNO2用蒸馏水器溶解成1000ml。
然后吸取5ml,再加稀释成1000ml,此溶液每ml含有NaNO2 5μg,用时稀释之。
操作步骤 1. .将新鲜取回的叶片(蓖麻、烟草、向日葵、油菜、小麦、棉花等均可)水洗,用吸水纸吸干,然后用钻孔器钻成直径约1cm的圆片,用洗涤2梍3次,吸干水分,然后于台天平上称取等重的叶子圆片两份,每份约0.3—0.4g(或每份取50个圆片),分别置于含有下列溶液的50ml三角烧瓶中:(1)0.1mol/L磷酸缓冲溶液(pH7.5)5ml 5ml;(2)0.1mol/L磷酸缓冲溶液(pH7.5)5ml 0.2mol/L KNO3 5ml。
然后将三角烧瓶置于真空干燥器中,接上真空泵抽气,放气后,圆片即沉于溶液中(如果没有真空泵,也可以用20ml注射器代替,将反应液及叶子圆片一起倒入注射器中,用手指堵住注射器出口小孔,然后用力拉注射器使真空,如此抽气放气反复进行多次,即可使圆片中的空气抽去而沉于溶液中)。
将三角烧瓶置于30℃温箱中,使不见光,保温作用30分钟,然后分别吸注意取样前叶子要进行一段时间的光合作用,以积累碳水化合物,如果组织中的碳水化合物含量低,会使得酶的活性降低,此时则可于反应溶液中加入30μg3—磷酸甘油醛或1,6—二磷酸果糖,能显著增加保温30分钟结束时,吸取反应溶液1ml于一试管中,加入磺胺试剂2ml及α—萘胺试剂2ml,混合摇匀,静置30分钟,用比色计进行比色测 3. .绘制标准曲线与重氮化作用及偶联作用的速度有关,温度、酸浓度等都影响显色速度,同时也影响灵敏度,但如果标准与样品的测定都在相同条件下进行,则显色速度相同,彼此可以比较。
吸取不同浓度的NaNO2溶液(例如5、4、3、2、1、0.5μg/ml)1ml于试管中,加入磺胺试剂2ml及α—萘胺试剂2ml,混合摇匀,静置30分钟(或于一定温度的水俗中保温30分钟),立即于分光光度计中进行测定,测定时的波长为520nm,比色,读取吸光度或透光率。
然后,以吸光度为纵坐标,NaNO2浓度为横坐标。
于毫米方格纸上绘制吸光度—浓度曲线。
实验作业1.试比较不同植物的酶活性。
2.试比较取样前植物处于照光或黑暗条件下酶活性的不同。
参考文献1.陈薇、张德颐:1980。
植物组织中硝酸还原酶的提取测定和纯化,植物生理学通讯,1980(4):45—49。
2.周树、郑相穆:1985。
硝酸还原酶体内分析方法的探讨,植物生理学通讯,1985(1):47—49。
3.Hageman,R.H.and D.P. .Hucklesby:1971.Methods in Enzymology,23A:491—503. 4.Radin.J.W.:1973.Plant Physiology,51:332—336. 5.Snell,F.D.and C.T.Snell:1949.Colorimetric Methods of Analysis,Vol.II,802—807 (华东师范大学张志良)参考资料:硝酸还原酶活性的测定一、材料用具及仪器药品木茨叶或菠菜叶子、蓖麻叶、721型分光光度计、真空泵(或注射器)、保温箱、天平、真空干燥器、钻孔器、三角瓶、移液管、烧杯、洗耳球0.1mol/L磷酸缓冲液(pH7.5)、0.2mol/L KNO3);磺胺试剂、a-苯胺试剂,NaNO2 标准溶液:a—萘胺试剂配制:0.2克a—萘胺加25ml浓盐酸,用稀释至100ml。
磺胺试剂配制:取1克磺胺加25ml浓盐酸,用稀释至100ml. NaNO2标准溶液:1克NaNO2用溶解,定量至1000ml,然后吸取5ml,再加定量至1000ml,该溶液每ml含有NaNO25ug,用时稀释之。
磷酸缓冲液:贮备液A:0.2mol/L NaH2PO4溶液(27.8g NaH2PO4·H2O配成1000ml)。
贮备液B:0.2 mol/L Na2HPO4溶液(53.65g Na2HPO4·7H2O或Na2HPO4·12H2O 配成1000ml)取A液16ml B液84ml,用水稀释至200ml 二、原理硝酸还原酶是植物氮素代谢作用中关键性酶,与作物吸收和利用氮肥有关,它作用于NO—3还原于NO—2 NO—3 NADH NO—2 NAD H2O 产生的NO-2可以从组织内渗透到外界溶液中,并积累在溶液中,测定反应溶液中NO-2的含量的高低,即表明酶活性的大小。
NO-2含量的测定用磺胺(对氨基苯磺酸胺sulfanil—amide)比色法,这种方法非常灵敏,能测定每m10.5ug的NaNO2。
三、方法步骤1.将新鲜叶片(蓖麻、烟草、木茨叶等)水洗,用吸水纸吸干水分,然后用1cm 的钻孔器钻取的圆片,在天平上称取等量的叶圆片两份,每份0.5克,(或每份取50个叶圆片),分别置于含有下列溶液的三角瓶中,(1)0.1mol/L磷酸缓冲溶液5ml 5ml。
(2)0.1mol/L磷酸缓冲溶液5ml 0.2mol/L KNO3 5ml。
然后将三角瓶置于真空干燥器中,接上真空泵抽气,放气后,叶圆片即沉于溶液中,(如果没有真空瓶,也可以用20ml注射器代替,将反应液及叶片一起倒入注射器内,,用手指堵住注射器出口小孔,然后用力拉注射器使之真空,如此抽气放气反复进行多次,即可使叶圆片中的空气抽去,并沉于溶液中),将三角瓶置于30℃温箱中,使不见光,保温作用30分钟,然后分别吸取反应溶液1ml,以测定NO-2含量。
注意取样前叶子要进行一段时间的光合作用,以积累碳水化合物,如果组织中的碳水化合物含量低,会使得酶的活性降低,此时则可在反应溶液中加入30μmol/L 的3—磷酸甘油醛或1.6——二磷酸果糖,能显著增加NO-2的产生。
2.NO-2含量的测定保温30分钟结束时,吸取反应溶液1ml于一试管中,先加入磺胺试剂2ml,后加入一萘胺试剂2ml,混合摇匀,静置30分钟,用分光光计进行比色测定,比色时用520nm波长,记下光密度,从标准曲线上查得NO-2含量,然后计算酶活性,以每小时每克鲜重产生的NO-2表示之。
3.绘制标准曲线测定NO-2的磺胺比色法很灵敏,可以检出低于1ug/ml的NaNO2含量,可于0~5ug/ml浓度范围内绘制标准曲线。
吸取不同浓度的溶液(例如5、4、3、2、1、0.5ug/ml)1ml于试管中,加入磺胺试剂2ml及一萘胺试剂2ml。
混合摇匀,静置30分钟(或于一定温度的水浴中保温30分钟)立即于分光光色计下进行比色,(波长520nm),读取光密度,然后,以光密度为纵坐标,NO-2浓度为横坐标,于毫米方格纸上绘制光密度——浓度曲线。
五、实验报告计算所测材料硝酸还原酶的活性。
六、思考题1、试比较不同植物的硝酸还原酶活性。
2、试比较取样前植物处于光照或黑暗条件下酶活性有什么不同。
附表:xmlA ymlB.稀释至200ml PH x Y pH x Y 5.75.85.96.06.16.26.36.46.56.66.76.8 93.592.090.087.785.081.577.573.568.562.556.551.06.58.010.012.315.018.522.526.531.537.543.549.06.97.07.17.27.37.47.57.67.77.87.98.045.039.033.028.023.019.016.013.010.58.57.05.355.061.067.072.077.081.084.087.089.591.593.094.7 (北京大学单良)Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current Sensor Magnet DC Current SensorMagnet DC Current Sensor Hall Open-loop current sensor Magnet DC Current Sensor Hall Open-loop current sensor Hall Open-loop current sensor LED显示屏LED显示屏LED显示屏计量检测仪器设备实验 6 植物体内硝酸还原酶活力的测定硝酸还原酶(nitrate reductase,NR ),是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐(NO 3 ˉ+NADH+H +→NO 2 ˉ+NAD ++H 2 O )。
产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α- 萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物生成的红色偶氮化合物在 540 nm 有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般单位鲜重以 N μg /( g · h )为单位。
NR 的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
Ⅰ离体法二、实验材料、试剂与仪器设备(一)实验材料水稻、小麦叶片、幼穗等。
(二)试剂1 .亚硝酸钠标准溶液:准确称取分析纯 NaNO2 0.9857 g 溶于无离子水后定容至 1000 mL ,然后再吸取 5 mL 定容至 1000 mL ,即为含亚硝态氮的 1 μg / mL 的标准液。
2 . 0.1 mol/L pH 7.5 的磷酸缓冲液: Na 2 HPO 4 · 12H 2 O 30.0905g 与 NaH 2 PO 4 · 2H 2 O 2.4965 g 加无离子水溶解后定容至 1000 mL 。