实验9 硝酸还原酶活性的测定
- 格式:doc
- 大小:37.00 KB
- 文档页数:4


首都师范大学生命科学学院实验报告实验题目硝酸还原酶活性的测定一、实验原理硝酸还原酶是植物氮素作用中的关键性酶,硝酸还原酶作用于NO 使之还原为NO 。
NO -+ NADH + H +— NO 2- + NAD ++ H 2O产生的NO 可以从植物组织渗透到外界溶液中,积累在溶液中。
因此,测定反 应液中NO 含量的增加即表明酶活性的大小。
NO 含量的测定----磺胺法NO 2-与磺胺和-萘胺在酸性条件下生成粉红色化合物,用比色法在520nm 下读 取光密度值。
—、实验用品1. 材料:完全营养的小麦苗,缺氮培养的小麦苗2. 仪器和用具:722型分光光度计,剪刀,真空泵,电子天平,温箱,烧杯,移液 枪,tip 头(两种规格:1000卩I ,200卩I ) 三、实验步骤1. 分别配制反应液于小烧杯中(1) 0.1M 磷酸缓冲液5ml +蒸馏水5ml(2) 0.1M 磷酸缓冲液 5ml + 0.2MKNQ 5ml 2. NO 2-的获得(1) 称取新鲜叶片0.5g 共四份,剪成小片,分别置于小烧杯内的反应液中。
(2) 在真空干燥器中抽气20min,使叶片沉于溶液底部,溶液即可渗入组织内取代其 中的空气,内部产生的NO 可渗透到外部溶液中。
3.将小烧杯转到30 r 温箱,使其不见光,保温20min 。
4.用5卩g/ml NaNQ 母液配制标准梯度溶液 5、4、3、2、1、0.5、0.1、 0 卩 g/ml 。
5.吸取不同浓度的NaNOmI 于试管中,加入磺胺试剂2ml 及a -萘胺试剂2ml ,混 合均匀,在60r 水浴中保温20min ,于比色杯中,在520nm 下进行比色,读取光 密度,然后做出光密度一浓度曲线,以光密度为纵坐标, 体步骤及结果如下表和下图所示。
课程名称植物生理实验 实验时间2010331成绩姓名唐倪文班级_3学号 1090800032NaNO 浓度为横坐标。
具试剂管号12 3 4 5 6 7 8 NaNO 母液(ml)0 0.02 0.1 0.2 0.4 0.6 0.8 1.0 蒸馏水(ml ) 1 0.98 0.9 0.8 0.6 0.4 0.2 0 1%磺胺(ml)22 2 2 2 2 2 2 0.2 %a -萘胺 (ml) 22 2 2 2 2 2 2 每管亚硝酸氮含 量(卩g ) 0 0.1 0.5 1.0 2.0 3.0 4.0 5.0 每管NaNO 浓度 (卩 g/ml ) 0 0.1 0.5 1.02.03.04.05.0 光密度0.0150.0520.1040.2020.3020.3960.493小麦幼苗完全培养液缺N 培养液KNOHO KNO HO 小麦鲜重(g ) 0.51 0.51 0.49 0.48 光密度0.178 0.176 0.065 0.039 亚硝酸钠浓度 (卩 g/ml ) 1.791 1.7710.6540.392亚硝态氮含量 (卩g ) 1.791 1.771 0.654 0.392 酶活性105.39104.1840.0424.505.吸取反应液各1 ml 于试管中加入磺胺和粉红色化合物.用比色法在520nm 下读取光密度值,从标准曲线上查得NO 的含量, 结果如下表。

硝酸还原酶测定方法
硝酸还原酶是一种广泛存在于细菌、真菌、植物和动物等生物体中的酶类,具有催化硝酸还原生成亚硝酸的作用。
亚硝酸可进一步催化生成氮气或氨,参与到氮循环中。
硝酸还原酶测定方法是用来量化硝酸还原酶的活性,以便研究和评价生物体中氮代谢的过程和生态系统中的氮循环。
直接测定法是通过测定硝酸还原酶催化硝酸还原生成亚硝酸的速率来评价其活性。
其中较常用的方法是通过测定硝酸盐浓度的变化来间接测定亚硝酸的含量,进而计算硝酸还原酶的活性。
具体方法如下:
1.取一定量的细胞提取液或组织,加入含有硝酸钠的反应溶液。
2.在一定的时间内,将反应溶液分别加入苯磺酰胺和二甲基苯胺的混合液中,生成偶氮染料,并在550nm波长下测定其吸光度。
3.利用已知浓度的硝酸盐标准曲线,计算出样品中硝酸盐的浓度。
4.根据硝酸还原酶反应硝酸盐生成亚硝酸的速率,计算出硝酸还原酶的活性。
间接测定法是通过测定硝酸还原酶催化还原剂(如戊二醛、甲醇、NADH等)的还原速率来评价其活性。
具体方法如下:
1.取一定量的细胞提取液或组织,加入含有硝酸钠和还原剂的反应溶液。
2.在一定的时间内,测定反应溶液中还原剂的消耗量或其产生的氧化产物(如NAD+)的生成量。
3.根据还原剂的消耗量或产生的氧化产物的生成量,计算硝酸还原酶的活性。
此外,还有一些特殊的测定方法,如溶液散射法、电化学法等,可以根据实验需要进行选择。
总结起来,硝酸还原酶测定方法是通过不同的分析手段测量硝酸还原酶的活性,从而研究和评价氮代谢的过程和生态系统中的氮循环。
不同的测定方法适用于不同的实验需求,科研人员可以根据具体情况选择合适的方法进行研究。

硝酸还原酶活性的测定一、原理硝酸还原酶是植物氮素作用中的关键性酶,与作物吸收和利用N肥有关的不同品种,年龄、器官组织以及环境条件对硝酸还原活性都有影响,硝酸还原酶作用于NO3使还原为NO2NO3⎯+NADH+H→NO2⎯+NAD+H2O产生的NO2⎯可以从组织内渗到外界溶液中,并积累在溶液中因此测定反应溶液中NO2⎯的含量的增加,即表明酶活性的大小。
NO2⎯含量的测定用对氨基苯磺酸化比色法,亚硝酸对氨基苯磺酸和α-萘胺在酸性条件下生成红色化合物,颜色在2-3小时稳定,可用比色法定量,该法非常灵敏,能测定每毫升0.5微克的Na NO2。
二、仪器和药品721型分光光度计(或其他型号比色计),剪刀,真空泵(或注射器),小天平,温箱,烧杯,移液管,小烧杯(50ml)0.2MKNO3:将20、22克KNO3溶于100ml蒸馏水中。
0.1M磷酸缓冲液(PH=7.5):将85.2%ml 1/15M磷酸氢二钠与14.8ml 1/15M磷酸二氢钾混合均匀。
1/15MNa2HPO4溶液:1000ml中含Na2HPO4•2H2O11.878克。
1/15M溶液:1000ml中含KH2PO49.078克。
对氨基苯磺酸试剂:1克对氨基苯硝酸加加25ml浓HCl,用蒸馏稀释至100ml.。
α–萘胺试剂,0.2克α–萘胺加25ml浓HCl,用蒸馏稀释至100ml。
NaNO2标准溶液:1克NaNO2用蒸馏水溶解至1000ml,然后吸取5ml,再加蒸馏水稀释成1000ml,该溶液每毫升含有NaNO2 5微克,用时稀释之。
三、实验步骤:1、将新鲜叶片(蓖麻、向日葵、小麦、棉花等),用水冲洗净,并用吸水纸吸干,用剪刀剪成小块(注意块小为宜),然后在小天平上称取等重的两份叶片,每份约0.5克。
分别置于含有下列溶液的小烧杯中。
(1)1M磷酸缓冲溶液5ml+蒸馏水5ml(2)0.1M磷酸缓冲溶液5ml+0.2M KNO35ml然后将小烧杯置于真空干燥器中,接上真空泵抽气,放气后叶片便沉于底部(如没有真空泵,也可以20ml注射器代替,将反应液及叶片一起倒入注射器使之真空,如此进行抽气、放气反复多次,溶液即可渗入叶组织内取代了叶片内的空气,叶片便沉于溶液底部),取出小烧杯置于30℃温箱中,使不见光保温作用30分钟。

硝酸还原酶活性的测定实验报告硝酸还原酶活性的测定实验报告引言:硝酸还原酶是一种重要的酶类,在生物体内起着关键的作用。
它能够将硝酸根离子还原为亚硝酸根离子,参与到氮代谢中。
本实验旨在通过测定硝酸还原酶活性的方法,探究其在不同条件下的变化规律,从而深入了解这一酶的功能及其对生物体的重要性。
材料与方法:1. 实验材料:- 萝卜组织样品- 硝酸还原酶提取液- 硝酸还原酶底物溶液- 甲酚硫酸溶液- 氨水溶液- 高锰酸钾溶液- 氯化亚铁溶液- 硝酸铜溶液- 硫酸亚铁溶液- 硫酸铵铁溶液- 蒸馏水2. 实验方法:- 提取硝酸还原酶:将萝卜组织样品切碎并加入硝酸还原酶提取液,搅拌均匀后离心,取上清液作为硝酸还原酶提取液。
- 测定硝酸还原酶活性:将硝酸还原酶提取液与硝酸还原酶底物溶液混合,反应一段时间后,加入甲酚硫酸溶液停止反应。
然后,分别加入氨水溶液和高锰酸钾溶液,测定吸光度。
- 构建标准曲线:分别取一系列浓度的硝酸铜溶液,加入硫酸亚铁溶液和硫酸铵铁溶液,测定吸光度。
根据吸光度与浓度的关系,绘制标准曲线。
结果与讨论:通过实验测定,我们得到了硝酸还原酶活性的数据,并根据标准曲线计算了不同样品中硝酸还原酶的活性。
首先,我们观察到在不同温度条件下,硝酸还原酶活性的变化。
结果显示,在较低的温度下,硝酸还原酶活性较低,随着温度的升高,酶活性逐渐增加,但在一定温度范围内,酶活性会达到峰值后开始下降。
这表明硝酸还原酶对温度敏感,适宜的温度能够促进酶的活性,但过高的温度则会导致酶的变性和失活。
其次,我们研究了不同pH值对硝酸还原酶活性的影响。
结果显示,在中性pH范围内,硝酸还原酶活性较高,而在酸性或碱性条件下,酶活性明显下降。
这说明硝酸还原酶对于酸碱度有一定的适应范围,过高或过低的pH值都会影响酶的活性。
此外,我们还研究了不同浓度的底物对硝酸还原酶活性的影响。
结果显示,在一定范围内,随着底物浓度的增加,硝酸还原酶活性呈现出增加的趋势。
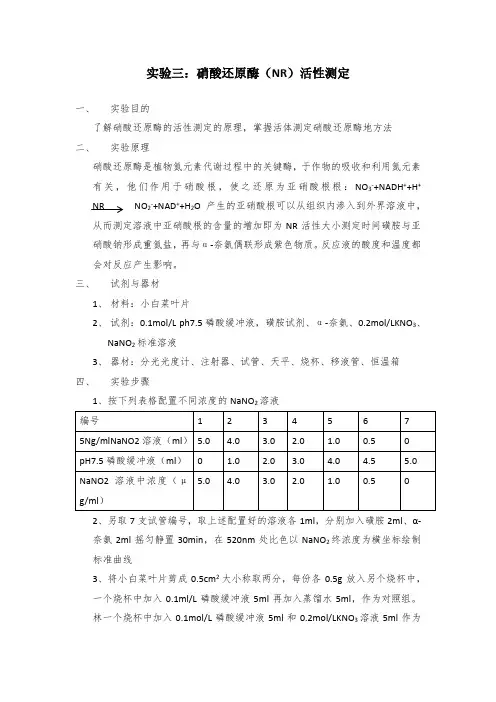
实验三:硝酸还原酶(NR)活性测定一、实验目的了解硝酸还原酶的活性测定的原理,掌握活体测定硝酸还原酶地方法二、实验原理硝酸还原酶是植物氮元素代谢过程中的关键酶,于作物的吸收和利用氮元素有关,他们作用于硝酸根,使之还原为亚硝酸根根:NO3-+NADH++H+ NR NO2-+NAD++H2O产生的亚硝酸根可以从组织内渗入到外界溶液中,从而测定溶液中亚硝酸根的含量的增加即为NR活性大小测定时间磺胺与亚硝酸钠形成重氮盐,再与α-奈氨偶联形成紫色物质。
反应液的酸度和温度都会对反应产生影响。
三、试剂与器材1、材料:小白菜叶片2、试剂:0.1mol/L ph7.5磷酸缓冲液,磺胺试剂、α-奈氨、0.2mol/LKNO3、NaNO2标准溶液3、器材:分光光度计、注射器、试管、天平、烧杯、移液管、恒温箱四、实验步骤1、按下列表格配置不同浓度的NaNO2溶液2、另取7支试管编号,取上述配置好的溶液各1ml,分别加入磺胺2ml、α-奈氨2ml摇匀静置30min,在520nm处比色以NaNO2终浓度为横坐标绘制标准曲线3、将小白菜叶片剪成0.5cm2大小称取两分,每份各0.5g放入另个烧杯中,一个烧杯中加入0.1ml/L磷酸缓冲液5ml再加入蒸馏水5ml,作为对照组。
林一个烧杯中加入0.1mol/L磷酸缓冲液5ml和0.2mol/LKNO3溶液5ml作为实验组。
将材料与溶液混合置于射器中抽气至材料沉入溶液。
4、将含材料的烧杯置于30℃恒温箱中30min,之后分别取1ml溶液按第二步进行NO2-含量测定5、结果分析:酶活性(NO2- μg g-1h-1)=(实验组NO2-含量-对照组NO2-含量)/材料重量(g)/时间(h)五、实验结果实验分析及感悟:由于实验过程中,移液管的混用可能会导致部分溶液污染导致实验产生误差。
叶片剪切的由于抽气不够是结果偏小。
本次试验经历了很长时间,我们从上午10点一直做到下午一点才做完。
当然经过努力的数据分析我们最终得到了我们所渴求的实验结果。

硝酸还原酶活力的测定一、试剂:(1)亚硝态氮标准溶液称取1 g分析纯NaNO2溶于无离子水并定容至1000mL,然后再吸取1mL定容至1000mL,即为1μg/mL亚硝态氮的标准液。
(2)0.1mol/L pH 7.5的磷酸缓冲液称取30.0905 g Na2HPO4·12H2O与2.4965 g NaH2PO4·2H2O,加无离子水溶解后定容至1000mL。
(3)10 g/L磺胺溶液称取1.00 g磺胺溶于100mL 3mol/L HCl中(取25mL浓盐酸加无离子水定容至100mL,即为3mol/L HCl)。
(4)0.2 g/L萘基乙烯胺溶液称取0.0200 g 萘基乙烯胺溶于100mL无离子水中,贮于棕色瓶中。
(5)0.1mol/L KNO3溶液称取2.5275 g KNO3溶于250mL 0.1mol/L pH 7.5的磷酸缓冲液。
(6)0.025mol/L pH 8.7的磷酸缓冲液称取8.864 g Na2HPO4·12H2O和0.057 g K2HPO4·3H2O,溶于1000mL 无离子水中。
(7)提取缓冲液称取0.1211 g半胱氨酸和0.0372 g EDTA,溶于100mL 0.025mol/L pH 8.7的磷酸缓冲液。
(8)2 mg/mL NADH溶液称取2 mg NADH溶于1mL 0.1mol/L pH7.5的磷酸缓冲液(临用前配制)。
二.实验步骤(一)标准曲线制作取7支15mL干净的试管按表1顺序加入试剂,配成每管含0~2.0μg 亚硝态氮的系列标准溶液,摇匀后在25℃下保温30 min,然后在540nm下比色测定,以每管中亚硝态氮的量(μg)为横坐标(x),吸光度值(y)为纵坐标绘制标准曲线或建立回归方程。
(二)硝酸还原酶活力测定1.酶液提取取10mL藻液,在4500r/min离心15分钟,去掉上清液,加4mL酶提取液,超声波破碎10min,4℃,4000r/min离心15min,上清液即为粗酶提取液2.酶反应取粗酶液0.4mL加入10mL试管中,再加入1.2mL 0.1mol/L KNO3磷酸缓冲液和0.4mL NADH溶液,在25℃水浴中准确保温30 min。

硝酸还原酶(NR)活性的测定硝酸还原酶是一种重要的酶,参与植物的氮代谢和植物的抗逆能力等生理过程。
硝酸还原酶的活性可以反映出植物对外界环境变化的适应能力和生长发育状态。
因此,硝酸还原酶活性的测定具有重要的生物学意义。
一、实验目的本实验主要目的是通过测定植物中硝酸还原酶活性的变化,探究外界环境对硝酸还原酶活性的影响。
另外,本实验还旨在掌握硝酸还原酶活性的检测方法。
二、实验原理硝酸还原酶 (NR) 是一种能将 NO3- 还原为 NO2- 的酶。
其催化反应的速率与硝酸还原酶的活性密切相关。
因此,硝酸还原酶活性的测定,是利用一定体系中 NO3- 还原成NO2- 的速率或反应产物的含量,来评价細胞內硝酸还原酶活性大小的一种生化方法。
实验中通常采用光度法来测定硝酸还原酶的活性。
光度法是将产生的 NO2- 与苯磺酸二苯胺 ( sulfanilamide) 反应生成硝基苯偶氮苯磺酸 (N-(1-naphthyl) ethylenediamine dihydrochloride,NED) ,然后用紫外可见分光光度计测定产生的吸光度。
三、实验步骤3.1 实验前准备1)制备显色液:将 1g 苯磺酸二苯胺和 0.02 g NED 加入 10mL 硫酸中,用水稀释至100 mL 。
2)制备反应液:在无氧条件下,将浓硝酸滴入 50mL 去离子水中,制备100μM 硝酸钾溶液。
3)制备酶提取液:将新鲜植物组织(如叶片、幼芽等)用磨汁机研磨成细胞浆,加入0.05M 磷酸盐缓冲液 (PH=7.5) 中,按 1:5 的比例(即 1g 组织加 5mL 缓冲液) 收集悬液,离心 15 分钟,将上清液称取至 1mL,即为酶提取液。
3.2 检测方法1)在96孔板中加入100μL 酶提取液,40℃孵育20分钟。
2)加入100 μL 反应液,制备最终反应物质的浓度应为:10mM NaNO3、2mM Na2S2O4、0.05M 磷酸盐缓冲液 (pH 7.5)。

硝酸还原酶活力的测定1、试剂:(1)亚硝态氮标准溶液称取1 g分析纯NaNO2溶于无离子水并定容至1000mL,然后再吸取1mL定容至1000mL,即为1μg/mL亚硝态氮的标准液。
(2)0、1mol/L pH7、5的磷酸缓冲液称取30、0905 g Na2HPO412H2O与2、4965 g NaH2PO42H2O,加无离子水溶解后定容至1000mL。
(3)10 g/L磺胺溶液称取1、00 g 磺胺溶于100mL3mol/L HCl中(取25mL浓盐酸加无离子水定容至100mL,即为3mol/L HCl)。
(4)0、2 g/L萘基乙烯胺溶液称取0、0200 g 萘基乙烯胺溶于100mL无离子水中,贮于棕色瓶中。
(5)0、1mol/L KNO3溶液称取2、5275 g KNO3 溶于250mL 0、1mol/L pH7、5的磷酸缓冲液。
(6)0、025mol/L pH8、7的磷酸缓冲液称取8、864 g Na2HPO412H2O和0、057 g K2HPO43H2O,溶于1000mL无离子水中。
(7)提取缓冲液称取0、1211 g半胱氨酸和0、0372 gEDTA,溶于100mL 0、025mol/L pH8、7的磷酸缓冲液。
(8)2 mg/mL NADH溶液称取2 mg NADH溶于1mL 0、1mol/L pH7、5的磷酸缓冲液(临用前配制)。
2.实验步骤(1)标准曲线制作取7支15mL干净的试管按表1顺序加入试剂,配成每管含0~2、0μg亚硝态氮的系列标准溶液,摇匀后在25℃下保温30 min,然后在540nm下比色测定,以每管中亚硝态氮的量(μg)为横坐标(x),吸光度值(y)为纵坐标绘制标准曲线或建立回归方程。
试剂管号1234567亚硝酸钠标准液/mL00、20、40、81、21、62、0蒸馏水/mL2、01、81、61、20、80、40、010g/L磺胺/mL44444440、2g/L萘基乙烯胺/mL4444444每管含亚硝态氮量/μg00、20、40、81、21、62、0(2)硝酸还原酶活力测定1、酶液提取取10mL藻液,在4500r/min离心15分钟,去掉上清液,加4mL酶提取液,超声波破碎10min,4℃,4000r/min离心15min,上清液即为粗酶提取液2、酶反应取粗酶液0、4mL加入10mL试管中,再加入1、2mL 0、1mol/L KNO3磷酸缓冲液和0、4mL NADH溶液,在25℃水浴中准确保温30 min。


硝酸还原酶活性的测定实验报告一、实验目的硝酸还原酶(NR)是植物氮代谢中的关键酶之一,其活性的高低与植物氮素利用效率密切相关。
本实验旨在掌握硝酸还原酶活性的测定方法,了解不同植物材料或不同处理条件下硝酸还原酶活性的差异,为进一步研究植物氮代谢机制和氮素营养调控提供依据。
二、实验原理硝酸还原酶能够催化植物体内的硝酸盐还原为亚硝酸盐。
在一定条件下,产生的亚硝酸盐量与硝酸还原酶活性成正比。
通过测定反应体系中亚硝酸盐的含量,可以间接反映硝酸还原酶的活性。
本实验采用磺胺比色法测定亚硝酸盐含量。
在酸性条件下,亚硝酸盐与磺胺发生重氮化反应,生成重氮盐,再与 N(1-萘基)乙二胺盐酸盐(NED)偶联,形成红色偶氮化合物。
该化合物在 540nm 波长处有最大吸收峰,其吸光度与亚硝酸盐含量成正比。
三、实验材料、仪器与试剂1、实验材料选取新鲜的植物叶片,如小麦、玉米、大豆等。
2、仪器分光光度计、离心机、恒温水浴锅、移液器、研钵、容量瓶、刻度试管等。
3、试剂(1)01mol/L pH 75 的磷酸缓冲液;(2)02mol/L KNO₃溶液;(3)1%磺胺溶液(磺胺溶于 30%乙酸中);(4)002% N(1-萘基)乙二胺盐酸盐溶液(NED);(5)5μg/mL 亚硝酸钠标准溶液。
四、实验步骤1、酶液提取称取新鲜植物叶片 05g,剪碎后放入研钵中,加入 5mL 01mol/L pH 75 的磷酸缓冲液,在冰浴中研磨成匀浆。
将匀浆转移至离心管中,在4℃下以 10000r/min 离心 15min,上清液即为酶提取液。
2、反应体系设置取两支刻度试管,分别标记为对照管(CK)和测定管(T)。
对照管:加入 1mL 01mol/L pH 75 的磷酸缓冲液和 1mL 02mol/L KNO₃溶液。
测定管:加入 1mL 酶提取液和 1mL 02mol/L KNO₃溶液。
将两支试管置于 30℃恒温水浴锅中保温 30min。
3、终止反应保温结束后,向对照管和测定管中分别加入 1mL 磺胺溶液和 1mL NED 溶液,摇匀,以终止反应。
实验报告-硝酸还原酶活性的测定实验目的:通过测定差示分光光度法下重铬酸钾氧化还原的反应,间接测定硝酸还原酶的活性。
实验原理:硝酸还原酶是一种以二价铁离子为电子受体的酶,能将NO2-还原为NO,是硝化作用的逆反应。
硝酸还原酶活性含量的测定常用于土壤、水环境等环境污染的检测。
本实验采用差示分光光度法来测定硝酸还原酶活性。
本实验中的差示分光光度法,利用重铬酸钾通过氧化还原反应,证明硝酸还原酶活性的存在。
重铬酸钾可以与硫酸铵和硝酸根离子反应,生成过氧化双铬离子和金属铵盐,同时溶液中的硝酸根离子被还原成氨氮产生气体释放出来。
通过测定溶液中氨氮的浓度,就可以计算出硝酸还原酶的活性含量。
实验步骤:1.准备A、B、C三个样品液。
A液:葡萄糖酸钙0.2g、1.5ml缓冲溶液、0.3ml菌液,加水至50ml。
B液:A液中再加菌液0.1ml。
C液:A液中再加无菌蒸馏水0.1ml代替菌液。
2.分别在三个位于水浴中的试管中加入A、B、C液各5ml并在水浴中孵育30分钟。
3.在孵育A液和C液试管的时间中,用硫酸铵和硝酸铵配制1%的硝酸根离子的溶液,重铬酸钾以及0.05%的草酸铁溶液。
4.在孵育后立即对A、B、C液各加入10ml配制好的硝酸根离子溶液。
5.再依次加入相同体积的重铬酸钾、草酸铁溶液,灵敏管测定氨氮的相对吸收值。
实验结果:样品重铬酸钾溶液的吸光度草酸铁溶液的吸光度比值氨氮浓度(mg/L)A 0.87 0.28 3.11 4.7B 0.77 0.25 3.08 4.6C 0.05 0.03 1.67 2.5实验分析:由上表可知,A、B两个样品的吸光度比值相差不太明显,说明A液中添加的0.1ml菌液对硝酸还原酶的活性没有显著的提高作用,而C液则比较显著地破坏了硝酸还原酶的活性,其氨氮浓度只有A、B两个样品的一半。
通过本次实验的差示分光光度法测定硝酸还原酶活性的方法,我们发现添加微生物菌液可以提高硝酸还原酶的活性,而加入无菌蒸馏水则会对其产生损害。
实验二、硝酸还原酶活性的测定-活体法[原理]:硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对-氨基苯磺酸(或对-氨基苯磺酰胺)及α-萘胺(或萘基乙烯胺)在酸性条件下定量生成红色偶氮化合物。
生成的红色偶氮化合物在540nm有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以每克鲜重含氮量表示,即以ug.g-1.h-1为单位。
NR 的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
[试剂]1.亚硝酸钠标准溶液:准确称取分析纯NaNO20.9857g溶于去离子水后定容至1 000ml,然后再吸取5ml定容至1000ml,即为含亚硝态氮1ug.ml-1的标准液;2.0.1molpH7.5的磷酸缓冲液:Na2HPO4.12H2O30.0905g与NaH2PO4.2H2O 2.4965g加去离子水溶解后定容至1 000ml;3.1%(W/V)溶液:1.0g 对氨基苯磺酸溶于100ml 3 mol.L-1HCL中(25ml浓盐酸加水定容至100ml 即为 3 mol.L-1HCL);4.0.02%(W/V)萘基乙烯胺溶液:0.020g萘基乙烯胺溶于100ml 去离子水中,贮于棕色瓶中;5.0.1mol.L-1KNO3溶液:2.5275g KNO3溶于250Ml 0.1mol.L-1Ph7.5的磷酸缓冲液中;6.0.025mol.L-1Ph 8.7 的磷酸缓冲液:8.864 0g Na2HPO4.12H2O,0.0570g KH2OP4.3H2O,溶于1 000ml去离子水中;7.30%三氯乙酸溶液:30g三氯乙酸。
水溶后定容至100ml。
[方法]摇匀后在25度下保温30min,然后在540nm下比色测定。
以亚硝态氮(ug)为横坐标(X),吸光值为纵坐标(Y)建立回归方程。
2.样品中硝酸还原酶活力测定1.在取材的前一天加50mmol/L KNO3或NaNO3到培养苗的水中就可以诱导酶的产生。
硝酸还原酶(NR)活性的测定硝酸还原酶(NR)活性的测定主要采用光度法和荧光法。
光度法测定硝酸还原酶活性的步骤如下:1. 准备0.1 M磷酸盐缓冲液(pH 7.5)。
2. 准备硝酸钠(NaNO3)的不同浓度标准溶液。
3. 取一定量的细胞提取物,加入适量的磷酸盐缓冲液,使得体积总量达到一定的体积。
4. 在一条白色或透明的96孔板中,分别加入相同体积的磷酸盐缓冲液和不同浓度的NaNO3标准溶液。
5. 加入适量的细胞提取物到每一孔中,混匀。
6. 在适当的温度下孵育一定的时间。
7. 加入 Griess 试剂(硫酸铁铵与草酰胺的混合溶液)到每个孔中。
8. 在深色环境下,测量每个孔的吸光度值。
9. 利用吸光度值与所加入的NaNO3标准溶液浓度之间的关系,绘制标准曲线。
10. 根据待测样品的吸光度值及标准曲线,计算出硝酸还原酶活性。
荧光法测定硝酸还原酶活性的步骤如下:1. 准备0.1 M磷酸盐缓冲液(pH 7.5)。
2. 准备硝酸钠(NaNO3)的不同浓度标准溶液。
3. 取一定量的细胞提取物,加入适量的磷酸盐缓冲液,使得体积总量达到一定的体积。
4. 在一条黑色的96孔板中,分别加入相同体积的磷酸盐缓冲液和不同浓度的NaNO3标准溶液。
5. 加入适量的细胞提取物到每一孔中,混匀。
6. 在适当的温度下孵育一定的时间。
7. 加入荧光探针(如草酰胺二乙酸盐,DAF-FM DA)到每个孔中。
8. 在荧光酶标仪中,设置适当的激发波长和发射波长,测量每个孔的荧光强度。
9. 利用荧光强度与所加入的NaNO3标准溶液浓度之间的关系,绘制标准曲线。
10. 根据待测样品的荧光强度及标准曲线,计算出硝酸还原酶活性。
植物硝酸还原酶(NR)活力测定(活体法)一、原理硝酸还原酶(NR)是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐,产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α–萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。
其反应如下:生成的红色偶氮化合物在540nm波长下有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般以Nμg·g-1·h-1为单位。
NR的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好二、仪器与用具分光光度计;真空抽气泵(或20ml注射器筒);天平;单面刀片;保温箱(或恒温水浴);刻度试管(15ml);移液管(5ml×2,2ml×8,1ml×2)。
三、试剂1. 亚硝酸钠标准液称取分析纯NaNO2 0.1000g水溶后定容至100ml,吸取5ml用水稀释定容至1000ml,即为每ml含NaNO2 5μg(亚硝态氮近似1μg/ml)的标准液。
2. 0.1mol/L pH7.5的磷酸缓冲液:K2HPO4 19.24g,KH2PO4 2.2g,加水溶解后定容至1000ml。
3. 1%(W/V)对-氨基苯磺酸溶液:称取10.0g加入250ml浓HCl中,用蒸馏水定容至1000ml。
4. 0.2%(W/V)α-萘胺溶液:称取2.0gα-萘胺溶于250ml冰醋酸中,用蒸馏水定容至1000ml。
5. 30%三氯乙酸溶液:75.0g三氯乙酸水溶后定容250ml。
6. KNO3(0.1mol/L)、异丙醇(1% V/V)、磷酸缓冲液(0.1mol/L)混合液:称10.10g KNO3溶于1000ml 0.1mol/L的磷酸缓冲液中,再加10ml异丙醇混匀。
四、方法1. 标准曲线制作取7支洁净烘干的15ml刻度试管按表13-1顺序加试剂,即配成0-2.0μg的系列标准亚硝态氮溶液。
实验9 硝酸还原酶活性的测定一、目的学会植物组织中硝酸还原酶活性的测定方法。
二、材料用具及仪器药品木茨叶或菠菜叶子、蓖麻叶、721型分光光度计、真空泵(或注射器)、保温箱、天平、真空干燥器、钻孔器、三角瓶、移液管、烧杯、洗耳球0.1mol/L磷酸缓冲液(pH7.5)、0.2mol/L KNO3);磺胺试剂、a-苯胺试剂,NaNO2标准溶液:a—萘胺试剂配制:0.2克a—萘胺加25ml浓盐酸,用蒸馏水稀释至100ml。
磺胺试剂配制:取1克磺胺加25ml浓盐酸,用蒸馏水稀释至100ml.NaNO2标准溶液:1克NaNO2用蒸馏水溶解,定量至1000ml,然后吸取5ml,再加蒸馏水定量至1000ml,该溶液每ml含有NaNO25ug,用时稀释之。
磷酸缓冲液:贮备液A:0.2mol/L NaH2PO4溶液(27.8g NaH2PO4·H2O配成1000ml)。
贮备液B:0.2 mol/L Na2HPO4溶液(53.65g Na2HPO4·7H2O或Na2HPO4·12H2O 配成1000ml)取A液16ml+B液84ml,用水稀释至200ml三、原理硝酸还原酶是植物氮素代谢作用中关键性酶,与作物吸收和利用氮肥有关,它作用于NO—3还原于NO—2NO—3+NADH+NO—2+NAD++H2O产生的NO-2可以从组织内渗透到外界溶液中,并积累在溶液中,测定反应溶液中NO-2的含量的高低,即表明酶活性的大小。
NO-2含量的测定用磺胺(对氨基苯磺酸胺sulfanil—amide)比色法,这种方法非常灵敏,能测定每m10.5ug的NaNO2。
四、方法步骤1.将新鲜叶片(蓖麻、烟草、木茨叶等)水洗,用吸水纸吸干水分,然后用1cm的钻孔器钻取的圆片,在天平上称取等量的叶圆片两份,每份0.5克,(或每份取50个叶圆片),分别置于含有下列溶液的三角瓶中,(1)0.1mol/L磷酸缓冲溶液5ml+蒸馏水5ml。
硝酸还原酶活力的测定1原理硝酸还原酶( nitrate reductase,NR ),是植物氮素同化的关键酶,它催化植物体内的硝酸盐还原为亚硝酸盐(NO3ˉ+NADH+H +→ NO2ˉ+NAD++H 2 O )。
产生的亚硝酸盐与对–氨基苯磺酸(或对–氨基苯磺酰胺)及α- 萘胺(或萘基乙烯二胺)在酸性条件下定量生成红色偶氮化合物。
其反应如下:生成的红色偶氮化合物在 540 nm 有最大吸收峰,可用分光光度法测定。
硝酸还原酶活性可由产生的亚硝态氮的量表示。
一般单位鲜重以ug/(g·h) 为单位。
NR 的测定可分为活体法和离体法。
活体法步骤简单,适合快速、多组测定。
离体法复杂,但重复性较好。
药品配制1)0.1mol/L pH为7.5的磷酸缓冲液: 称取Na2HPO4·12H2O 30.0905g, NaH2 PO4·2H2O2.4965g, 溶解并定容至1000ml.2)0.2 mol/L KNO3溶液: 2.5275g KNO3用pH为7.5的磷酸缓冲液溶解并定容至100 ml.3)30%三氯乙酸:75.0g 三氯乙酸用水定容至250mL。
4)硝酸试剂的配制: 0.5g α-萘胺加水煮沸1-2分钟,趁热加入1.25g 对氨基苯磺酸,再加250 ml冰醋酸,加水定容至500mL.保存于暗处.2酶活性测定1)称样: 从田间取回新鲜叶片,用水洗净,吸干水份,用打孔器打出直径 0.5cm 的叶圆片,用蒸馏水冲洗叶圆片 1 ~ 2 次,用吸水纸把水吸干后,称取等重叶圆片4份,每份重 0.5 g ,放入50mL的三角瓶中。
2)抽提: 正常处理—→向每个三角瓶中先后加入5mL磷酸缓冲液溶和5mL硝酸溶液;对照处理—→先加1mL三氯乙酸,再加其它两种溶液。
在黑暗的条件下用真空泵反复抽提30分钟.3)放置: 在黑暗,25℃条件下放置30分钟.4)终止反应: 正常处理—→向三角瓶中加入1mL三氯乙酸;对照处理—→不加三氯乙酸。
实验9 硝酸还原酶活性的测定
一、目的
学会植物组织中硝酸还原酶活性的测定方法。
二、材料用具及仪器药品
木茨叶或菠菜叶子、蓖麻叶、721型分光光度计、真空泵(或注射器)、保温箱、天平、真空干燥器、钻孔器、三角瓶、移液管、烧杯、洗耳球
0.1mol/L磷酸缓冲液(pH7.5)、0.2mol/L KNO3);磺胺试剂、a-苯胺试剂,NaNO2
标准溶液:
a—萘胺试剂配制:0.2克a—萘胺加25ml浓盐酸,用蒸馏水稀释至100ml。
磺胺试剂配制:取1克磺胺加25ml浓盐酸,用蒸馏水稀释至100ml.
NaNO2标准溶液:1克NaNO2用蒸馏水溶解,定量至1000ml,然后吸取5ml,再加蒸馏水定量至1000ml,该溶液每ml含有NaNO25ug,用时稀释之。
磷酸缓冲液:
贮备液A:0.2mol/L NaH2PO4溶液(27.8g NaH2PO4·H2O配成1000ml)。
贮备液B:0.2 mol/L Na2HPO4溶液(53.65g Na2HPO4·7H2O或Na2HPO4·12H2O 配成1000ml)取A液16ml+B液84ml,用水稀释至200ml
三、原理
硝酸还原酶是植物氮素代谢作用中关键性酶,与作物吸收和利用氮肥有关,它作用于NO—3还原于NO—2
NO—3+NADH+NO—2+NAD++H2O
产生的NO-2可以从组织内渗透到外界溶液中,并积累在溶液中,测定反应溶液中NO-2的含量的高低,即表明酶活性的大小。
NO-2含量的测定用磺胺(对氨基苯磺酸胺sulfanil—amide)比色法,这种方法非常灵敏,能测定每m10.5ug的NaNO2。
四、方法步骤
1.将新鲜叶片(蓖麻、烟草、木茨叶等)水洗,用吸水纸吸干水分,然后用1cm的钻孔器钻取的圆片,在天平上称取等量的叶圆片两份,每份0.5克,(或每份取50个叶圆片),分别置于含有下列溶液的三角瓶中,(1)0.1mol/L磷酸缓冲溶液5ml+蒸馏水5ml。
(2)0.1mol/L磷酸缓冲溶液5ml+0.2mol/L KNO3 5ml。
然后将三角瓶置于真空干燥器中,接上真空泵抽气,放气后,叶圆片即沉于溶液中,(如果没有真空瓶,也可以用20ml注射器代替,将反应液及叶片一起倒入注射器内,,用手指堵住注射器出口小孔,然后用力拉注射器使之真空,如此抽气放气反复进行多次,即可使叶圆片中的空气抽去,并沉于溶液中),将三角瓶置于30℃温箱中,使不见光,保温作用30分钟,然后分别吸取反应溶液1ml,以测定NO-2含量。
注意取样前叶子要进行一段时间的光合作用,以积累碳水化合物,如果组织中的碳水化合物含量低,会使得酶的活性降低,此时则可在反应溶液中加入30μmol/L 的 3—磷酸甘油醛或1.6——二磷酸果糖,能显著增加NO-2的产生。
2.NO-2含量的测定
保温30分钟结束时,吸取反应溶液1ml于一试管中,先加入磺胺试剂2ml,后加入一
萘胺试剂2ml,混合摇匀,静置30分钟,用分光光计进行比色测定,比色时用520nm波长,记下光密度,从标准曲线上查得NO-2含量,然后计算酶活性,以每小时每克鲜重产生的NO-2表示之。
3.绘制标准曲线
测定NO-2的磺胺比色法很灵敏,可以检出低于1ug/ml的NaNO2含量,可于0~5ug/ml 浓度范围内绘制标准曲线。
吸取不同浓度的溶液(例如5、4、3、2、1、0.5ug/ml)1ml于试管中,加入磺胺试剂2ml及一萘胺试剂2ml。
混合摇匀,静置30分钟(或于一定温度的水浴中保温30分钟)立即于分光光色计下进行比色,(波长520nm),读取光密度,然后,以光密度为纵坐标,NO-2浓度为横坐标,于毫米方格纸上绘制光密度——浓度曲线。
五、实验报告
计算所测材料硝酸还原酶的活性。
六、思考题
1、试比较不同植物的硝酸还原酶活性。
2、试比较取样前植物处于光照或黑暗条件下酶活性有什么不同。
附表:。