几种重要含氧有机化合物设计鉴别
- 格式:doc
- 大小:52.00 KB
- 文档页数:4

有机化学鉴别方法总结有机化学鉴别方法指的是通过特定的实验方法和化学分析手段,对有机化合物进行鉴别和分析。
有机化学鉴别方法主要包括物理性质鉴别、燃烧反应鉴别、溶解性鉴别、酸碱性鉴别、还原性和氧化性鉴别、结构确认和谱学分析等。
以下是有机化学鉴别方法的详细总结。
一、物理性质鉴别物理性质鉴别是通过观察和检测有机化合物的外观、物理状态、熔点、沸点、密度、折光率等性质,推测和判断有机化合物的结构和性质。
例如,通过观察有机化合物的颜色、形状、结晶形态等外观性质,可以初步了解有机化合物的种类;通过测定有机化合物的熔点和沸点,可以推测有机化合物的结构;通过测定有机化合物的密度和折光率,可以对有机化合物的性质进行初步判断。
二、燃烧反应鉴别燃烧反应鉴别是通过将有机化合物进行燃烧反应,观察和检测燃烧反应的现象和产物,从而推测有机化合物的结构和性质。
例如,通过观察有机化合物的燃烧现象,如燃烧时是否有火焰、燃烧是否发生爆炸等,可以初步判断有机化合物的饱和度和含氧量;通过检测燃烧产生的气体,如二氧化碳、水蒸气、一氧化碳等,可以推测有机化合物的结构和性质。
三、溶解性鉴别溶解性鉴别是通过将有机化合物溶解在不同的溶剂中,观察和检测溶解的过程和结果,从而推测有机化合物的结构和性质。
例如,通过观察有机化合物在水中的溶解性,可以初步判断有机化合物是否含有极性官能团;通过观察有机化合物在有机溶剂中的溶解性,可以初步判断有机化合物的极性和溶液的稳定性。
四、酸碱性鉴别酸碱性鉴别是通过将有机化合物与酸或碱进行酸碱反应,观察和检测反应的过程和结果,推测有机化合物的结构和性质。
例如,通过观察有机化合物与酸反应后产生的气体和沉淀,可以初步判断有机化合物是否含有酸性官能团;通过观察有机化合物与碱反应后产生的气体和溶液颜色的变化,可以初步判断有机化合物是否含有碱性官能团。
五、还原性和氧化性鉴别还原性和氧化性鉴别是通过将有机化合物进行还原反应或氧化反应,观察和检测反应的过程和结果,推测有机化合物的结构和性质。

含氧化合物的有机化学反应机理有机化学是研究碳元素和氢元素以及它们与其他元素之间的化学反应的科学。
在有机化学中,含氧化合物的反应机理是一个重要的研究领域。
本文将探讨几种常见的含氧化合物反应机理,并分析其应用和意义。
一、醇的氧化反应机理醇的氧化反应是有机化学中常见的反应之一。
醇可以通过氧化剂被氧化为醛或酮。
常用的氧化剂包括酸性高锰酸钾、酸性过氧化氢和酸性铬酸等。
以酸性高锰酸钾为例,其反应机理如下:首先,醇与高锰酸钾反应生成醛或酮和锰酸盐。
反应中,高锰酸钾被还原为锰酸盐,同时醇被氧化为醛或酮。
反应的速率取决于醇的结构和反应条件。
醇的氧化反应机理对于有机合成和药物研发具有重要意义。
通过氧化反应,可以将醇转化为具有更高化学活性的醛或酮,进而进行进一步的官能团转化。
这为有机合成提供了重要的方法和途径。
二、醛和酮的还原反应机理醛和酮的还原反应是有机化学中常见的反应之一。
醛和酮可以通过还原剂被还原为醇。
常用的还原剂包括金属氢化物如氢化钠和氢化铝锂等,以及氧化还原酶等。
以氢化钠为例,其反应机理如下:首先,醛或酮与氢化钠反应生成醇和钠盐。
反应中,氢化钠被氧化为钠盐,同时醛或酮被还原为醇。
反应的速率取决于醛或酮的结构和反应条件。
醛和酮的还原反应机理在有机合成和药物研发中也具有重要意义。
通过还原反应,可以将醛和酮转化为具有更多化学活性的醇,进而进行进一步的官能团转化。
三、醇的脱水反应机理醇的脱水反应是有机化学中常见的反应之一。
醇可以通过脱水剂被脱水生成烯烃。
常用的脱水剂包括浓硫酸、浓磷酸和磷酸三甲酯等。
以浓硫酸为例,其反应机理如下:首先,醇与浓硫酸反应生成醚和水。
反应中,醇中的羟基被硫酸脱水生成醚,同时硫酸被还原为硫酸氢根离子。
反应的速率取决于醇的结构和反应条件。
醇的脱水反应机理在有机合成中具有重要意义。
通过脱水反应,可以将醇转化为具有烯烃结构的化合物,进而进行进一步的官能团转化。
总结:含氧化合物的有机化学反应机理是有机化学中的重要研究领域。


有机化学鉴别方法的总结1烷烃与烯烃,炔烃的鉴别方法就是酸性高锰酸钾溶液或溴的ccl4溶液(烃的含氧衍生物均可以使高锰酸钾褪色,只就是快慢不同)2烷烃与芳香烃就不好说了,但芳香烃里,甲苯,二甲苯可以与酸性高锰酸钾溶液反应,苯就不行3另外,醇的话,显中性4酚:常温下酚可以被氧气氧化呈粉红色,而且苯酚还可以与氯化铁反应显紫色5可利用溴水区分醛糖与酮糖6醚在避光的情况下与氯或溴反应,可生成氯代醚或溴代醚。
醚在光助催化下与空气中的氧作用,生成过氧化合物。
7醌类化合物就是中药中一类具有醌式结构的化学成分,主要分为苯醌,萘醌,菲醌与蒽醌四种类型,具体颜色不同反应类型较多一.各类化合物的鉴别方法1、烯烃、二烯、炔烃:(1)溴的四氯化碳溶液,红色腿去 (2)高锰酸钾溶液,紫色腿去。
2.含有炔氢的炔烃:(1) 硝酸银,生成炔化银白色沉淀(2) 氯化亚铜的氨溶液,生成炔化亚铜红色沉淀。
3.小环烃:三、四元脂环烃可使溴的四氯化碳溶液腿色4.卤代烃:硝酸银的醇溶液,生成卤化银沉淀;不同结构的卤代烃生成沉淀的速度不同,叔卤代烃与烯丙式卤代烃最快,仲卤代烃次之,伯卤代烃需加热才出现沉淀。
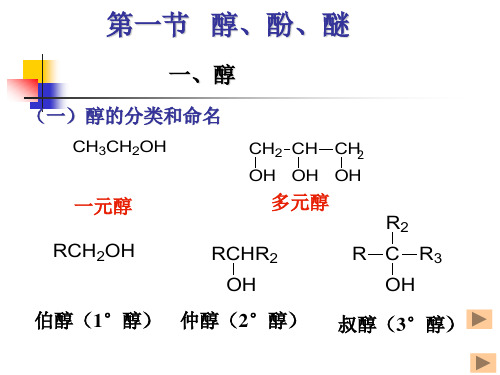
5.醇:(1) 与金属钠反应放出氢气(鉴别6个碳原子以下的醇);(2) 用卢卡斯试剂鉴别伯、仲、叔醇,叔醇立刻变浑浊,仲醇放置后变浑浊,伯醇放置后也无变化。
6.酚或烯醇类化合物:(1) 用三氯化铁溶液产生颜色(苯酚产生兰紫色)。
(2) 苯酚与溴水生成三溴苯酚白色沉淀。
7.羰基化合物:(1) 鉴别所有的醛酮:2,4-二硝基苯肼,产生黄色或橙红色沉淀; (2) 区别醛与酮用托伦试剂,醛能生成银镜,而酮不能;(3) 区别芳香醛与脂肪醛或酮与脂肪醛,用斐林试剂,脂肪醛生成砖红色沉淀,而酮与芳香醛不能;(4) 鉴别甲基酮与具有结构的醇,用碘的氢氧化钠溶液,生成黄色的碘仿沉淀。
8.甲酸:用托伦试剂,甲酸能生成银镜,而其她酸不能。
9.胺:区别伯、仲、叔胺有两种方法(1)用苯磺酰氯或对甲苯磺酰氯,在NaOH溶液中反应,伯胺生成的产物溶于NaOH;仲胺生成的产物不溶于NaOH溶液;叔胺不发生反应。

实验十一、鉴别几种重要含氧有机物
设计十种含氧有机化合物的鉴别方案
十种化合物分别为:
甲醛、乙醛、丙酮、苯甲醛、苯乙酮、无水乙醇、乙二醇、苯酚、正丁醇、乙酸
提供鉴定用试剂:
乙醇(95%),无水乙醇,正丁醇,乙二醇(10%),1%苯酚,对苯二酚(1%),三氯化铁(1%),甲醛,乙醛,苯甲醛,丙酮,苯乙酮,硝酸银溶液(1%),CuSO4 (5%),浓盐酸,HCl (5%),Na2CO3 (5%),2,4-二硝基苯肼,Fehling I,Fehling II,Schiff试剂,AgNO3 (0.2mol·L-1),NH3·H2O (2mol·L-1),浓硫酸,碘液,NaOH (2.5 mol·L-1),碘化钾—淀粉试纸,苯肼试剂(新配制),NaHSO3,氨基脲盐酸盐,乙酸,刚果红试纸, 饱和溴水, 碳酸钠
实验方案与安全注意
要求: 方案合理, 试剂普通无毒, 价格低, 操作简单不繁琐, 符合环保要求, 现象明显, 可操作性强, 区分度好
实验要求
1 预习醇、酚、醛、酮和羧酸的有关知识
2 参考有机实验书中醇、酚、醛、酮和羧酸化学性质实验内容
3 写出给定的十种含氧有机化合物的鉴别方案。
预习实验4-6: 醇和酚的性质(P169)
预习实验4-7: 醛和酮的性质(P171)
预习实验4-7:羧酸及其衍生物的性质(P174)。
有机物是有机化合物的简称,所有的有机物都含有碳元素。
但是并非所有含碳的化合物都是有机化合物,比如CO,CO2。
除了碳元素外有机物还可能含有其他几种元素。
如H、N、S等。
虽然组成有机物的元素就那么几种(碳最重要),但到现在人类却已经发现了超过3000万种有机物。
而它们的特性更是千变万化。
因此,有机化学是化学中一个相当重要的研究范畴。
甲烷甲烷分子式CH4。
最简单的有机化合物。
甲烷是没有颜色、没有气味的气体,沸点-161.4℃,比空气轻,它是极难溶于水的可燃性气体。
甲烷和空气成适当比例的混合物,遇火花会发生爆炸。
化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。
在适当条件下会发生氧化、热解及卤代等反应。
甲烷在自然界分布很广,是天然气、沼气、坑气及煤气的主要成分之一。
它可用作燃料及制造氢、一氧化碳、炭黑、乙炔、氢氰酸及甲醛等物质的原料。
413kJ/mol、109°28′,甲烷分子是正四面体空间构型,上面的结构式只是表示分子里各原子的连接情况,并不能真实表示各原子的空间相对位置。
甲烷对人基本无毒,但浓度过高时,使空气中氧含量明显降低,使人窒息。
当空气中甲烷达25%-30%时,可引起头痛、头晕、乏力、注意力不集中、呼吸和心跳加速、共济失调。
若不及时脱离,可致窒息死亡。
皮肤接触液化本品,可致冻伤。
烯烃烯烃是指含有C=C键(碳-碳双键)(烯键)的碳氢化合物。
属于不饱和烃,分为链烯烃与环烯烃。
按含双键的多少分别称单烯烃、二烯烃等。
链单烯烃分子通式为CnH2n,常温下C2—C5为气体,是非极性分子,不溶或微溶于水。
双键基团是烯烃分子中的功能基团,具有反应活性,可发生氢化、卤化、水合、卤氢化、次卤酸化、硫酸酯化、环氧化、聚合等加成反应,还可氧化发生双键的断裂,生成醛、羧酸等。
可由卤代烷与氢氧化钠反应制得:RCH2CH2X + NaOH —— RHC=CH2 + NaX + H2O (X为氯、溴、碘)也可由醇失水或由邻二卤代烷与锌反应制得。
几种重要含氧有机化合物设计鉴别
一、实验目的
1.比较醇、酚、醛、酮和羧酸化学性质上的差别;加深对醇、酚、醛、酮和 羧酸化学性质的认识;
2.掌握鉴别醇、酚、醛、酮和羧酸的化学方法;
3. 设计十种含氧有机化合物的鉴别方案并实施注意强调“通过本实验的学习,使学生了解或掌握什么知识,训练或培养什么技能,为今后继续哪方面的学习奠定基础”,等等。
二、实验原理
苯酚与FeCl 3作用, 苯酚与溴水作用, 苯酚的酸性, 羧酸与碳酸钠的反应 X
(1)邻位多羟基醇与某些二价金属氢氧化物生成类似盐的化合物,如与Cu(OH)2生成蓝紫色配合物。
CH
OH 2OH CH 2
OH Cu(OH)2CH O CH
2OH CH 2
O Cu O H 2
甘油铜(深蓝色)
在浓盐酸作用下,配合物能被分解成原来的醇和铜盐。
(2)醛、酮同属羰基化合物,都能与羰基试剂2,4-二硝基苯肼等发生亲核反应,例如:
C O H CH 3+NH 2NH 2
C H CH 3
NO 2NO 2
NNH NO 2
NO 2
黄色
(3)醛能被一些弱氧化剂如吐伦试剂、费林溶液和西佛试剂等氧化
醛易氧化成酸,都能与托伦(Tollens )试剂——硝酸银氨溶液反应生成银镜;与西佛(Schiff )试剂结合成紫红色的化合物。
RCHO RCOONH 4+
Ag
3)2]OH ++3+O H 2 RCHO +2(HSO 2HNC 6H 5)2C
NH 3Cl +-SO 3H _23
西佛(Schiff )试剂
(R-C-SO 2NHC 6H 5)2C
OH
H NH 2Cl +-
紫红色
在醛与西佛(Schiff )试剂结合成紫红色的化合物中加入无机酸时,这种紫红色的化合物发生分解,
从而褪色。
只有甲醛与西佛(Schiff )试剂结合成紫红色的化合物加入无机酸时不褪色。
酮类不发生此类反应。
醛类的进一步鉴别可通过斐林(Fehling
)反应。
Fehling 试剂呈深蓝色,当与脂肪醛共热时,溶液颜色依次发生蓝→绿→黄→砖红色沉淀的变化。
甲醛还可能进一步将氧化亚铜
还原为暗红色的金属铜。
芳香醛与Fehling 试剂无此反应,借此可与脂肪醛区别。
RCHO RCOOH +Cu 2Cu(OH)2++O 2
与亚硫酸氢钠的加成: 大多数醛、脂肪族甲基酮及八个碳以下的脂环酮能与亚硫酸氢钠(NaHSO 3)饱和溶液(40%)发生加成反应,生成不溶于40% NaHSO 3的α-羟基磺酸钠白色结晶。
此晶体溶于水,难溶于有机溶剂,并且此反应为可逆反应,生成的α-羟基磺酸钠与稀酸或稀Na 2CO 3溶液共热时,则分解为原来的醛或酮。
因此,这一反应可用来区别和纯化醛、脂肪族甲基酮或碳原子数少于8的脂环酮。
C O SO 3Na R H
H
(CH 3)
H
HSO 3Na (CH 3)α-羟基磺酸钠
C
O SO 3Na R
H H (CH 3)C R H (CH 3)
C R
H (CH 3)++SO 2SO 32+O O -
(4)碘仿反应 羰基化合物的另一重要反应是α-碳原子上活泼氢的反应。
α-碳氢的σ键与碳氧间π键发生σ-π共轭,因此,醛、酮α-氢具有一定的活性。
能进行α-卤代或卤仿反应,对具有
CH 3C O 结构的羰基化合物,常用碘的碱性溶液与之反应(碘仿反应),生成具有特殊气味的黄色碘仿结晶进行鉴定。
由于碘的碱液同时是氧化剂,可以使醇氧化成相应的醛、酮。
因此,具有结构
CH 3CH
OH
的醇也能进行碘仿反应。
+CH 32CH 3CH 3CH 2COONa CHI 32O
碘仿
三、实验方案与安全注意
要求: 方案合理, 试剂普通无毒, 价格低, 操作简单不繁琐, 符合环保要求, 现象明显, 可操作性强, 区分度好
四、主要仪器及试剂
1. 器材 烧杯,试管,试管夹,长滴管,量筒,药勺,pH 试纸,玻璃棒,点滴板,温度计。
2. 药品 乙醇(95%),无水乙醇,正丁醇,乙二醇(10%), 1%苯酚,对苯二酚(1%),三氯化铁(1%),甲醛,乙醛,苯甲醛,丙酮,苯乙酮,硝酸银溶液(1%), CuSO 4(5%),浓盐酸,HCl(5%),Na 2CO 3(5%),KMnO 4(0.5%),2,4-二硝基苯肼,Fehling I ,Fehling II ,Schiff 试剂,AgNO 3(0.2mol ·L-1),NH 3·H 2O(2mol ·L-1),浓硫酸,碘液,NaOH(2.5 mol ·L-1),
碘化钾—淀粉试纸,苯肼试剂(新配制),NaHSO 3,氨基脲盐酸盐,乙酸,刚果红试纸, 饱和溴水, 碳酸钠
五、实验要求
1 预习醇、酚、醛、酮和羧酸的有关知识
2 参考有机实验书中醇、酚、醛、酮和羧酸化学性质实验内容
3 写出给定的十种含氧有机化合物的鉴别方案。
六、思考题
1.Tollen 试验和Fehling 试验的反应为什么不能在酸性溶液中进行?
2. 醋酸分子式含有结构
CH 3C O
,能发生碘仿反应吗?
七、实验报告 包括实验目的,实验方案步骤,实验结果并讨论分析在实验中出现的问题,实验中的特殊现象、实验操作的成败、实验的关键点等内容进行整理、解释、分析总结,回答思考题,提出实验结论或提出自己的看法等。