玻尔的原子模型问题一
- 格式:ppt
- 大小:290.50 KB
- 文档页数:16

玻尔模型是如何解释原子结构的在探索物质的微观世界中,原子结构一直是科学家们努力研究的重要课题。
而玻尔模型的提出,为我们理解原子结构提供了关键的理论框架。
要理解玻尔模型如何解释原子结构,首先得明白在此之前人们对原子的认识。
最初,人们认为原子就像一个实心的小球,内部结构无从知晓。
随着科学技术的发展,人们发现原子是由带正电的原子核和带负电的电子组成。
但新的问题来了,电子围绕原子核运动的方式究竟是怎样的呢?这时,玻尔模型登场了。
玻尔模型的核心观点是,电子在原子中的运动并不是随意的,而是处于一系列特定的、稳定的轨道上。
这些轨道就像是一条条特定的“高速公路”,电子只能在这些“高速公路”上运行,而不能处于轨道之间的空间。
而且,每个轨道都对应着一个特定的能量值。
当电子处于不同的轨道时,原子就具有不同的能量状态。
为什么电子会这样运动呢?玻尔提出了一个重要的概念——定态。
定态意味着电子在这些特定轨道上运动时,不会向外辐射能量,因此能够保持稳定。
这与经典物理学中加速运动的电荷会辐射能量的观点截然不同。
当电子从一个能量较高的轨道跃迁到一个能量较低的轨道时,就会释放出一定频率的光子,其能量等于两个轨道之间的能量差。
反过来,如果电子吸收了特定频率的光子,就能够从能量较低的轨道跃迁到能量较高的轨道。
举个例子,当我们给一个原子提供适当频率的光时,电子会吸收光子的能量,跃迁到更高的轨道;而当电子自发地从高能轨道回到低能轨道时,就会放出特定频率的光。
这也就解释了为什么原子会发出特定频率的光谱线。
玻尔模型还成功地解释了氢原子的光谱。
在实验中,我们可以观察到氢原子发出的一系列不连续的光谱线。
而玻尔模型通过计算不同轨道之间的能量差,得出的结果与实验观测到的氢原子光谱频率完美吻合。
然而,玻尔模型并不是完美无缺的。
它虽然能够很好地解释氢原子这样的简单原子结构,但对于更复杂的原子,其解释能力就显得有些不足。
比如,玻尔模型无法解释电子在轨道上的运动细节,也不能解释为什么电子会选择特定的轨道。

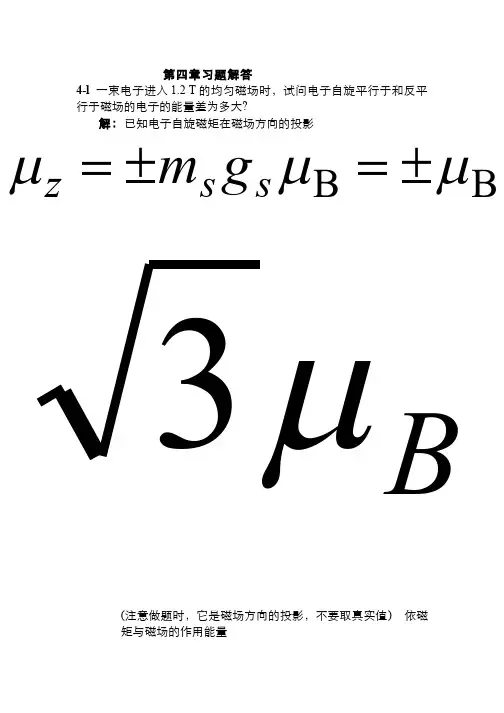
第四章习题解答4-l 一束电子进入1.2 T 的均匀磁场时,试问电子自旋平行于和反平行于磁场的电子的能量差为多大?解:已知电子自旋磁矩在磁场方向的投影(注意做题时,它是磁场方向的投影,不要取真实值) 依磁矩与磁场的作用能量BB μμμ±=±=s s z gm Bμ3自旋与磁场平行时 自旋与磁场反平行时则θμμcos B B E =⋅= B B B E B s s μμμ==⋅= 0cos 1B B B E B s s μμμ-==⋅= 180cos 1eV 101.389eV 105788.02.122Δ44B 12--⨯=⨯⨯⨯==-=B E E E μ4-2 试计算原子处于 状态的磁矩及投影的可能值.解法一:已知:j =3/2, 2s +1=2 s =1/2, l =2则依据磁矩计算公式:依据磁矩投影公式:∴ 232D μ z μ544156432123=⎪⎪⎪⎪⎫ ⎝⎛-+=j g ()B B 15521μμμ-=+-=j j g j j Bμμj j z g m -=56,52±±=j j g m B B 56,52μμμ±±=z解法二:因为电子具有自旋,则存在与自旋相联系的磁矩,他在磁场作用下的能量为电子自旋方向与磁场平行和反平行,则有μB Us ⋅-=μ(其中,)所以电子自旋平行于和反平行于磁场的电子的能量为则电子自旋平行于和反平行于磁场的电子的能量差为Bm g B B UB s s sz s μμμ=-=⋅-=2=s g 21±=s m BU B μ±=eV 104.1T 2.1T eV 105788.022Δ414---⨯=⨯⋅⨯⨯==B U B μ4-3 试证实:原子在状态的磁矩等于零,并根据原子矢量模型对这一事实作出解释.解:依题意有236G所以综上得出,多电子耦合系统中,相互作用产生的总效果为零,说明多电子作用有相抵消的情况。

高考物理专题复习:氢原子光谱和波尔的原子模型一、单选题1.氢原子的能级图如图所示。
如果大量氢原子处于n=3能级的激发态,则下列说法正确的是()A.这群氢原子只可能辐射1种频率的光子B.氢原子从n=3能级跃迁到n=1能级,辐射光子的波长最长C.这群氢原子辐射光子的最小能量为1.89eVD.处于n=3能级的氢原子至少需吸收13.6eV能量的光子才能电离n 激发态的氢原子跃迁到n=1基态过程中,下面说法正确的是()。
2.大量处于3A.可能放出能量为13.6eV的光子B.可能检测到4种频率不同的光子C.核外电子的电势能一定减少D.核外电子的动能一定减少3.处于激发状态的原子,在入射光的电磁场的影响下,从高能态向低能态跃迁,两个状态之间的能量差以辐射光子的形式发射出去,这种辐射叫做受激辐射。
原子发生受激辐射时,发出的光子频率、发射方向等都跟入射光子完全一样,这样使光得到加强,这就是激光产生的机理。
那么,发生受激辐射时,产生激光的原子的总能量E、电势能E p、电子动能E k的变化情况是()A.E p增大、E k减小,E减小B.E p减小、E k增大,E减小C.E p增大、E k增大,E增大D.E p减小、E k增大,E不变ν的光照射大量处于基态的氢原子,在所发射的光谱中仅能观测到频率分别为4.用频率为1ν、2ν和3ν的三条谱线,且321ννν>>,则( )A . 01νν<B . 321ννν=+C . 0123νννν=++D .123111ννν=+5.图中画出了氢原子的4个能级,并注明了相应的能量E 。
处在n =3能级的一群氢原子向低能级跃迁时,能够发出几种不同频率的光波。
( )A .两种B .三种C .四种D .五种6.如图,大量处于4n =能级的氢原子向低能级跃迁辐射出光子,已知可见光光子能量在1.64eV ~3.19eV 范围内,则氢原子在向低能级跃迁的过程中,放出几种频率的可见光( )A .2B .3C .6D .157.如图所示为氢原子能级结构示意图,下列说法正确的是( )A .一群处于5n =能级的氢原子在向低能量状态跃迁时最多可以发出10种不同频率的光B .氢原子光谱是连续谱C .处于1n =能级的氢原子可以吸收能量为12eV 的光子跃迁到高能级D .氢原子的电离能为13.6eV -8.如图所示为氢原子能级图,A 、B 、C 分别表示电子处于三种不同能级跃迁时放出的光子,其中( )A .频率最高的是B B .波长最短的是C C .频率最高的是AD .波长最长的是B 二、多选题9.如图为氢原子的能级示意图,一群氢原子处于3n =的激发态,在向较低能级跃迁的过程中向外发出光子,用这些光照射逸出功为2.49eV 的金属钠,下列说法正确的是( )A .这群氢原子能发出3种频率不同的光,其中从3n =跃迁到2n =所发出的光波长最长B .这样氢原子能发出3种频率不同的光,其中从3n =跃迁到1n =所发出的光频率最小C .金属钠表面所发出的光电子的最大初动能为11.1leVD .金属钠表面所发出的光电子的最大初动能为9.60eV10.氢原子的能级图如图甲所示,一群处于第4能级的氢原子,向低能级跃迁过程中能发出6种不同频率的光,其中只有频率为a ν、b ν的两种光可让图乙所示的光电管阴极K 发生光电效应.分别用频率为a ν、b ν的两种光照射光电管阴极K ,测得电流随电压变化的图像如图丙所示.下列说法中正确的是()A.图丙中的图线b所表示的光的光子能量为12.09eVB.图乙研究阴极K的遏止电压与照射光频率关系时,电源左侧为负极C.处于第4能级的氢原子可以吸收一个能量为0.95eV的光子并电离D.用图丙中的图线a所表示的光照射阴极K时,光电子的最大初动能比用图线b所表示的光照射时小11.如图所示是根据玻尔原子模型求得的氢原子能级图,下列说法正确的是()A.氢原子从高能级向低能级跃迁时,可能辐射出γ射线n=能级的氢原子发生电离B.能量为5eV的光子可使处于2n=能级的氢原子向低能级跃迁时,最多可辐射出3种频率的光子C.一个处于3n=能级跃迁到基态时释放的光子,可使逸出功为4.54eV的金属钨发生光电D.氢原子从3效应,产生的光电子最大初动能为7.55eV12.如图所示,一群处于基态的氢原子吸收某种光子后,向外辐射ν1、ν2、ν3三种频率的光子,且ν1>ν2>ν3,则()A .被氢原子吸收的光子的能量为hν1B .被氢原子吸收的光子的能量为hν2C .ν2=ν1+ν3D .hν1=hν2+hν3 三、填空题13.氢原子光谱的实验规律(1)许多情况下光是由原子内部电子的运动产生的,因此光谱是探索_______的一条重要途径。


导练案玻尔的原子模型'的轨道,辐射出波长E1根据玻尔理论,某原子的电子从能量为E的轨道跃迁到能量为表示真空中的光速,则E'等于()h为λ的光。
以表示普朗克常量,c??cc+h -h D.Eh B.E + C A.E -h.E ??cc、ν、2.用光子能量为E的光束照射容器中的氢气,氢原子吸收光子后,能发射频率为ν21)ν的三种光子,且ν<ν<ν.入射光束中光子的能量应是(3213+v)h(v+v) D.h(v+v.BA.hv.h(v+ν) C3212 3 321.氢原子发光时,能级间存在不同的跃迁方式,其中①②③三种跃迁方式对应的光谱线3(图光谱图中,DA、与三种跃迁方式对应的光谱图应当是B、C、分别为Ⅰ、Ⅱ、Ⅲ,下列)中下方的数值和短线是波长的标尺)().对于基态氢原子,下列说法正确的是(4B、它能吸收11eV的光子A、它能吸收的光子D、它能吸收具有11eV动能的电子的部分动能14eV的光子、它能吸收C【课后练习】),下列四个能级图,正确代表氢原子的是(1氢原子的基态能量为E 1)2.氢原子辐射出一个光子后,根据玻尔理论,下列判断正确的是(.电子的动能减少BA.电子绕核旋转的轨道半径增大D.氢原子的能级减小C.氢原子的电势能增大跃迁到A时,吸收频率为3.按氢原子若能从能级A跃迁到能级Bv的光子,若从能级1()则>v时,能级C释放频率为v的光子.己知v,而氢原子从能级C跃迁到能级B时,122ν+的光子v-v的光子B.释放频率为V.释放频率为A1212E/eV n n C.吸收频率为v-ν的光子D.吸收频率为V+V的光子1221∞044.图为氢原子n=1,2,3,4的各个能级示意图。
处于n=4能321)量状态的氢原子,当它向较低能级发生跃迁时,发出的光子能量可能为(B、A、、DC、=5n=4的激发态直接跃迁到n=2的激发态时,发出蓝色光,则当氢原子从5.氢原子从n)的激发态直接跃迁到n=2的激发态时,可能发出的是(?D、射线C、紫光A、红外线B、红光已知基态的氦离子能量为E =-6 氦原子被电离一个核外电子,形成类氢结构的氦离子.1被基态氦离子吸收而发.在具有下列能量的光子中,不能eV,氦离子能级的示意图如图所示..)生跃迁的是(E0∞V4 e E-3.4V0e E-6.3Ve E-13.62-54.4eV eV Ev eV eV E1-10 m,基态的能级值为E =-eV.107已知处于基态的氢原子的电子轨道半径r=×1(1)有一群氢原子处在量子数n=3的激发态,画一能级图,在图上用箭头标明这些氢原子能发出几种光谱线(2)计算这几条光谱线中最短的波长.8氢原子处于基态时,原子能量E= ,(1)若要使处于n=2的氢原子电离,至少要用频114Hz,今用一群处于n=4的率多大的电磁波照射氢原子(2)若已知钠的极限频率为×10激发态的氢原子发射的光谱照射钠,试通过计算说明有几条谱线可使钠发生光电效应9原子从一个能级跃迁到一个较低的能级时,有可能不发射光子,例如在某种条件下,铬原子的n=2能级上的电子跃迁到n=1能级上时并不发射光子,而是将相应的能量转交给n=4能级上的电子,使之能脱离原子,这一现象叫做俄歇效应,以这种方式脱离了原2,式中n=1E已知铬原子的能级公式可简化表示为=-A/n,2,子的电子叫做俄歇电子,n3……表示不同能级,A是正的已知常数,上述俄歇电子的动能是()/16A13 D /16A 11 C /16A 7 B /16A 3 A的能级的一群氢原处在n=4并注明了相应的能量E。

1.氢原子从基态跃迁到激发态时,下列论述中正确的是(B)A.动能变大,势能变小,总能量变小B.动能变小,势能变大,总能量变大C.动能变大,势能变大,总能量变大D.动能变小,势能变小,总能量变小2.下列叙述中,哪些符合玻尔理论(ABC)A.电子可能轨道的分布是不连续的B.电子从一条轨道跃迁到另一个轨道上时,原子将辐射或吸收一定的能量C.电子的可能轨道上绕核做加速运动,不向外辐射能量D.电子没有确定的轨道,只存在电子云3.大量原子从n=5的激发态向低能态跃迁时,产生的光谱线数是( B )A.4条B.10条C.6条D.8条4.对玻尔理论的评论和议论,正确的是(BC)A.玻尔理论的成功,说明经典电磁理论不适用于原子系统,也说明了电磁理论不适用于电子运动B.玻尔理论成功地解释了氢原子光谱的规律,为量子力学的建立奠定了基础C.玻尔理论的成功之处是引入量子观念D.玻尔理论的成功之处,是它保留了经典理论中的一些观点,如电子轨道的概念5.氢原核外电子分别在第1、2条轨道上运动时,其有关物理量的关系是(BC )A.半径r1>r2 B.电子转动角速度ω1>ω2C.电子转动向心加速度a1>a2 D.总能量E1>E26.已知氢原子基态能量为-13.6eV,下列说法中正确的有(D )A.用波长为600nm的光照射时,可使稳定的氢原子电离B.用光子能量为10.2eV的光照射时,可能使处于基态的氢原子电离C.氢原子可能向外辐射出11eV的光子D.氢原子可能吸收能量为1.89eV的光子7.氢原子从能级A跃迁到能级B,吸收频率v1的光子,从能级A跃迁到能级C 释放频率v2的光子,若v2>v1则当它从能级C跃迁到能级B将(D)A.放出频率为v2-v1的光子B.放出频率为v2+ v1的光子C.吸收频率为v2- v1的光子D.吸收频率为v2+v1的光子8.已知氢原子的基态能量是E1=-13.6eV,第二能级E2=-3.4eV.如果氢原子吸收______eV的能量,立即可由基态跃迁到第二能级.如果氢原子再获得1.89eV的能量,它还可由第二能级跃迁到第三能级,因此氢原子第三能级E3=_____eV.10.2 -1.511.玻尔在他的原子模型中所做的假设有(ABC)A.原子处于成为定态的能量状态时,虽然电子做变速运动,但并不向外辐射能量;B.原子的不同能量状态与电子沿不同的圆轨道绕核运动相对应,而电子的可能轨道的分布是不连续的;C.电子从一个轨道跃迁到另一个轨道时,辐射或吸收一定频率的光子;D.电子跃迁时辐射的光子的频率等于绕核做圆周运动的频率。


玻尔的原子模型练习题1.玻尔在他提出的原子模型中所做的假设有()A.原子处在具有一定能量的定态中,虽然电子做变速运动,但不向外辐射能量B.原子的不同能量状态与电子沿不同的圆形轨道绕核运动相对应,而电子的可能轨道的分布是不连续的C.电子从一个轨道跃迁到另一个轨道时,辐射(或吸收)一定频率的光子D.电子跃迁时辐射的光子的频率等于电子绕核做圆周运动的频率解析:A、B、C三项都是玻尔提出来的假设,其核心是原子定态概念的引入与能级跃迁学说的提出,也就是“量子化”的概念。
原子的不同能量状态与电子绕核运动时不同的圆形轨道相对应,是经典理论与“量子化”概念的结合。
答案:A、B、C2.一个氢原子中的电子从一个半径为r a的轨道自发地直接跃迁至另一半径为r b的轨道,已知r a>r b,则在此过程中()A.原子发出一系列频率的光子B.原子要吸收一系列频率的光子C.原子要吸收某一频率的光子D.原子要辐射某一频率的光子解析:因为是从高能级向低能级跃迁,所以应放出光子,因此可排除B、C。
“直接”从一能级跃迁到另一能级,只对应某一能级差,故只能发出某一频率的光子。
答案:D3.氢原子处于量子数n=3的状态时,要使它的核外电子成为自由电子,吸收的光子能量应是()A.13.6 eV B.3.5 eVC.1.51 eV D.0.54 eV解析:只要被吸收的光子能量大于n=3态所需的电离能1.51 eV即可,多余能量作为电离后自由电子的动能。
答案:A、B、C4.一群氢原子处于同一较高的激发态,它们在向较低激发态或基态跃迁的过程中( )A .可能吸收一系列频率不同的光子,形成光谱中的若干条暗线B .可能发出一系列频率不同的光子,形成光谱中的若干条明线C .可能吸收频率一定的光子,形成光谱中的一条暗线D .可能发出频率一定的光子,形成光谱中的一条明线解析:从高能级态向低能级态跃迁,一定发射出光子,发出光子的频率种类为n (n -1)2。


玻尔原子模型的局限性作文玻尔原子模型的局限性玻尔原子模型是描述电子在原子中运动的经典理论,由丹麦物理学家尼尔斯·玻尔在20世纪初提出。
该模型帮助我们理解了原子内部结构和电子能级的存在,为后续的量子力学理论奠定了基础。
然而,随着科学的发展和实验的深入,玻尔原子模型的局限性逐渐显现出来。
首先,玻尔原子模型无法解释更复杂的原子结构。
根据该模型,电子在原子核周围的轨道上运动,而每个轨道对应着一定的能量。
然而,实际情况却更加复杂,原子中存在着许多不同的能级和亚能级,这些能级之间的跃迁引发了光谱现象。
玻尔原子模型无法解释这些现象,因为它只考虑了轨道的概念而忽略了电子运动的波粒二象性以及波函数的存在。
其次,玻尔原子模型无法解释原子核的结构和性质。
在该模型中,原子核被简化为一个带正电荷的质点,并没有考虑到原子核中存在的质子和中子以及其间的相互作用。
随着核物理的发展,我们了解到原子核是由质子和中子组成的,且它们之间通过核力相互作用维持着核的稳定。
而玻尔原子模型对于原子核结构和核稳定性的解释是不够准确的。
此外,玻尔原子模型无法解释更小尺度下的粒子行为。
在现代物理学中,我们知道电子不仅具有粒子性,还具有波动性,其行为需通过量子力学描述。
玻尔原子模型只能给出定态电子的能级和轨道信息,无法描述电子的具体运动和位置。
总的来说,玻尔原子模型是经典物理学的成果,虽然它在一定程度上解释了原子的结构和性质,但无法满足日益增长的科学需求。
随着量子力学的发展,我们能够更准确地描述原子能级、光谱现象、核结构等复杂问题,这些都是玻尔原子模型所无法涵盖的内容。
尽管玻尔原子模型具有局限性,但它在历史进程中的地位仍然重要。
它为量子力学的建立提供了基础,为科学家们的后续研究和发现打下了基石。
科学的发展是一个渐进的过程,每个理论的提出都是为了更好地理解自然界的规律。
因此,我们要以科学的眼光看待玻尔原子模型,尊重它的成就和局限性,并持续追求更准确、更完善的理论模型。
难点19 玻尔原子模型及相关应用玻尔原子模型是中学物理的重要模型之一,以此为背景的高考命题,有较强的抽象性和综合性,是考生应对的难点.●难点1.(★★★★)(1996年全国)根据玻尔理论,氢原子的电子由外层轨道跃迁到内层轨 道后A.原子的能量增加,电子的动能减小B.原子的能量增加,电子的动能增加C.原子的能量减小,电子的动能减小D.原子的能量减小,电子的动能增加2.(★★★★)(1995年全国)如图19-1所示,给出氢原子最低的四个能级,氢原子在这些能级之间跃迁即辐射的光子的频率最多有________种,其中最小的频率等于________Hz.(保留两位有效数字)●案例探究[例1]欲使处于基态的氢原子激发,下列措施可行的是A.用10.2 eV 的光子照射B.用11 eV 的光子照射C.用14 eV 的光子照射D.用11 eV 的光子碰撞命题意图:考查考生对玻尔原子模型的跃迁假设的理解能力及推理能力.B 级要求. 解题方法与技巧:由"玻尔理论"的跃迁假设可知,氢原子在各能级间,只能吸收能量值刚好等于两能级之差的光子.由氢原子能级关系不难算出,10.2 eV 刚好为氢原子n =1和n =2的两能级之差,而11 eV 则不是氢原子基态和任一激发态的能量之差,因而氢原子只能吸收前者被激发,而不能吸收后者.对14 eV 的光子,其能量大于氢原子电离能,足可使“氢原子”电离,而不受氢原子能级间跃迁条件限制.由能的转化和守恒定律不难知道,氢原子吸收14 eV 的光子电离后产生的自由电子仍具有0.4 eV 的动能.另外,用电子去碰撞氢原子时,入射电子的动能可全部或部分地为氢原子吸收,所以只要入射电子的动能大于或等于基态和某个激发态能量之差,也可使氢原子激发,故正确选项为ACD.[例2]光子能量为E 的一束光照射容器中的氢(设氢原子处于n =3的能级),氢原子吸收光子后,能发出频率γ1、γ2、γ3、γ4、γ5、γ6六种光谱线,且γ1<γ2<γ3<γ4<γ5<γ6,则E 等于A.h γ 1B.h γ 6C.h (γ6-γ1)D.h (γ1+γ2+γ3+γ4+γ5+γ6)命题意图:考查对玻尔理论跃迁假设的理解能力及推理能力.B 级要求.错解分析:出现错解的原因有(1)对氢原子跃迁机理理解不透.(2)对量子数为n 的氢原子自发辐射产生谱线条数n (n -1)/2这一规律把握不牢,难以执果索因,逆向思维推断氢原子吸收光子后所在能级量子数n =4.解题方法与技巧:因为,对于量子为n 的一群氢原子,向较低的激发态或基态跃迁时,可能产生的谱线条数为n (n -1)/2,故n (n -1)/2=6,可判定氢原子吸收光子的能量后可能的能级是n =4,从n =4到n =3放出的光子能量最小,频率最低.此题中的最低频率为γ,故处于n =3能级的氢原子吸收频率为γ1(E =h γ1)的光子能量,从n =3能级跃迁到n =4能级后,方可发出6种谱线的频率,故A 选项正确.●锦囊妙计一、高考走势图19—1中学所涉及的原子物理知识是大学《高能物理》的必备基础,尽管中学教材的要求较低,但历届高考命题均有涉及,其中对玻尔理论的考查常以氢原子为例,集中体现对定态假设、跃迁假设的理解能力及推理能力、抽象思维能力的考查.该考点仍不失为今后高考命题的考查热点和难点.二、处理玻尔原子模型应用问题要点1.某定态时氢原子的几个结论设r n 为某定态(量子数为n )时氢原子核外电子的轨道半径,电子绕核速度v n ,电子动能E k n ,系统电势能E p n ,原子总能量E n ,据玻尔的轨道假设和经典力学规律得:⎪⎩⎪⎨⎧==⋅=⋅n n n n n r m v r ke n h n r m v //)3,2,1(2/222 π 由此方程可得以下结论:(1)电子绕行速度:v n =2πke 2/nh ,v n =v 1/n .(n =1,2,3……)(2)电子轨道半径:r n =n 2h /4π2mke 2,r n =n 2r 1.(n =1,2,3……)(3)电子绕行周期T n =n 3h 3/4π2mk 2e 2,T n =n 3T 1.(n =1,2,3……)(4)电子动能E k n =2π2mk 2e 4/n 2h 2,E k n =E k1/n 2.(n =1,2,3……)(5)系统电势能:E p n =-ke 2/r n =-4π2mk 2e 4/n 2h 2.(n =1,2,3……)且|E k n |=21|E p n | (6)原子总能量 E n =-2π2mk 2e 4/n 2h 2,E n =21n E .(n=1,2,3……) 以上结论是对相关氢原子定态问题进行判断、推理的主要依据.2.氢原子的跃迁及电离(1)氢原子受激发由低能级向高能级跃迁:当光子作用使原子发生跃迁时,只有光子能量满足h γ=E m -E n 的跃迁条件时,原子才能吸收光子的全部能量而发生跃迁.当用电子等实物粒子作用在原子上,只要入射粒子的动能大于或等于原子某两"定态"能量之差E m -E n ,即可使原子受激发而向较高能级跃迁.如果光子或实物粒子与原子作用而使原子电离(绕核电子脱离原子的束缚而成为“自由电子”,即n =∞的状态)时,不受跃迁条件限制,只不过入射光子能量越大,原子电离后产生的自由电子的动能越大.(2)氢原子自发辐射由高能级向低能级跃迁:当一群氢原子处于某个能级向低能级跃迁时,可能产生的谱线条数为n (n -1)/2条. 当单个氢原子处于某个能级向低能级跃迁时,最多可能产生(n -1)个频率的光子. ●歼灭难点训练1.(★★★★)按照玻尔理论,在氢原子中,当电子从半径为4r 1的轨道跃迁到半径为r 1的轨道时,它的能量变化是A.电势能减少,动能增加B.电势能减少,动能减少C.电势能的减少等于动能的增加D.电势能的减少大于动能的增加2.(★★★★)根据氢原子的玻尔模型,核外电子在第一(n =1),第三(n =3)轨道上① ②运动时,以下说法正确的是A.速率之比为3∶1B.周期之比为1∶3C.能量之比为3∶1D.半径之比为1∶33.(★★★★)一个氢原子中的电子从一半径为r a 的轨道跃迁到另一半径为r b 的轨道,已知r a <r b ,则在此过程中A.原子可能发出一系列频率的光子B.原子可能吸收一系列频率的光子C.原子可能吸收某一频率的光子D.原子可能辐射某一频率的光子4.(★★★★)用能量为12.3 eV 的光子去照射一群处于基态的氢原子,受光子照射后,下列的说法正确的是A.原子能跃迁到n =2的轨道上去B.原子能跃迁到n =3的轨道上去C.原子能跃迁到n =4的轨道上去D.原子不能跃迁到其他轨道上去5.(★★★★)如图19-2所示,表示汞原子可能的能级(不是全部),一个自由电子的总能量为9.0 eV ,与处于基态的汞原子发生正碰(不计汞原子的动量变化),则电子可能剩余的能量(碰撞过程中无能量损失)A.0.2 eVB.1.4 eVC.2.3 eVD.5.5 eV6.(★★★★★)有一群处于量子数n =4的激发态中的氢原子,在它们发光的过程中,发出的光谱线共有________条,有一个处于量子数n =4的激发态中的氢原子,在它向低能态跃迁时,最多可能发出________个频率的光子.7.(★★★★★)一个氢原子处于基态,用光子能量为15 eV 的电磁波去照射该原子,问能否使氢原子电离?若能使之电离,则其被电离后电子所具有的动能是多大?参考答案:[难点磁场]1.D2.6;1.6×1014[歼灭难点训练]1.AD2.A3.BC4.D5.AC6.6;37.能;1.4 eV图19—2。
解释玻尔的原子能级模型玻尔的原子能级模型是为了解释原子的线谱现象而提出的,该模型提出了原子中电子的能级和跃迁规则,并揭示了电子在原子中的轨道运动特征。
这一模型对于揭示原子结构和电子行为具有重要意义,而且也为量子力学的发展奠定了基础。
玻尔的原子能级模型最早于1913年提出,他模型的基本假设是:1.电子只能在特定的能级上运动;2.电子在不同能级之间的跃迁是具有能量差的光子的发射或吸收过程;3.在运动轨道上的电子不会辐射能量。
根据这些假设,玻尔做出了以下推论:1.电子的能级:根据赝离心力和库仑引力的平衡关系,玻尔得出电子的能级是量子化的,即只能存在于特定的能级上。
电子能级从低到高分别记为K、L、M、N等,对应不同的主量子数n。
其中n=1的能级最低,对应基态;n=2的能级次之,为第一激发态;以此类推。
2.能级间的跃迁:当电子从低能级向高能级跃迁时,必须吸收一定能量,产生发射谱线;而当电子从高能级向低能级跃迁时,释放出一定的能量,产生吸收谱线。
这解释了实验观察到的线谱现象。
3.能级间的能量差:玻尔利用经典力学的方法推导出了能级间的能量差公式:E = -13.6/n² eV,其中E为能量差,n为主量子数。
这一公式被称为玻尔能级公式,能够解释氢原子光谱中的巴尔末线系的频率。
4.稳定轨道:玻尔假设电子只能在特定的轨道上运动,而且这些轨道是稳定的。
玻尔的模型认为,当电子在能级间跃迁时,电子会离开原轨道,跃迁结束后会回到原轨道,从而保证了能级的稳定性。
玻尔的原子能级模型虽然得出了一些重要结论,但也存在一些问题:1.仅适用于氢原子:玻尔的模型只能解释氢原子光谱,无法应用于其他原子。
其他原子光谱的线数目与跃迁规则无法用该模型解释。
2.忽略了波动性:玻尔的模型将电子看作粒子,并忽略了波动性。
然而,根据后来的量子力学理论,电子不仅具有粒子性,还具有波动性,这一点在玻尔的模型中没有得到很好的解释。
3.无法解释轨道形状:玻尔模型没有提供关于轨道形状和电子运动路径的明确信息。
波尔的原子模型总结波尔的原子模型是20世纪初提出的一种描述原子结构的模型,它对原子的特性和行为做出了重要解释。
本文将围绕波尔的原子模型展开,从历史背景、基本原理、实验证据和应用等方面进行综述。
一、历史背景20世纪初,科学家们对原子的结构和性质知之甚少。
当时的原子理论无法解释原子光谱现象,无法解释为什么原子是稳定的,也无法解释为什么原子在发光和吸收光时只能发生特定的颜色或频率。
在这个背景下,丹麦物理学家尼尔斯·波尔提出了他的原子模型。
二、基本原理波尔的原子模型基于以下几个基本假设:1. 原子由一个中心核和围绕核运动的电子组成;2. 电子只能在特定的能级轨道上运动,每个轨道都对应一定的能量;3. 电子在能级轨道之间跃迁时,会吸收或释放特定能量的光子。
三、实验证据波尔的原子模型提出后,许多实验证据证实了它的正确性。
1. 原子光谱:原子在吸收能量时,电子会跃迁到高能级轨道,当电子从高能级跃迁回低能级时,会释放出特定频率的光。
这解释了原子光谱现象,也验证了波尔的能级理论。
2. 玻尔模型对氢原子光谱的解释:波尔用他的模型成功解释了氢原子光谱线的频率和能量关系,从而得到了氢原子的能级图。
3. X射线衍射:X射线通过晶体时会发生衍射,这表明晶体中的原子排列是有序的,支持了波尔的原子模型。
四、应用波尔的原子模型对于理解原子结构和性质、解释光谱现象以及推动量子力学的发展起到了重要作用。
1. 原子结构研究:波尔的模型揭示了原子由核和电子组成的结构,为后续的原子结构研究奠定了基础。
2. 光谱分析:波尔的模型解释了原子发射光谱和吸收光谱的现象,为光谱分析提供了理论依据。
3. 量子力学的发展:波尔的原子模型为量子力学的发展提供了重要线索,奠定了波尔量子化条件的基础。
总结:波尔的原子模型通过引入能级概念,成功解释了原子光谱现象,并为后续的原子结构研究和量子力学的发展奠定了基础。
虽然波尔的原子模型在某些方面存在局限性,但它为我们理解原子的基本结构和性质提供了重要的思路和启示。
玻尔原子结构模型的主要观点1. 引言玻尔原子结构模型是物理学家尼尔斯·玻尔于1913年提出的一种描述原子结构的理论模型。
该模型通过量子力学的基本原理,解释了电子在原子中的能级分布和跃迁行为,为后续量子力学理论的发展奠定了基础。
本文将详细介绍玻尔原子结构模型的主要观点。
2. 原子结构问题在19世纪末20世纪初,科学家们已经意识到传统物理学无法解释一些实验现象,如氢光谱、电离现象等。
这些现象表明,原子具有稳定的能级和特定的跃迁行为。
然而,根据经典物理学中电荷加速度产生辐射能量损失的观点,电子应该会不断向核心运动,并最终坠入核内。
这一问题促使科学家们寻找新的理论模型来解释这些现象。
3. 玻尔原子结构模型基本假设为了解决上述问题,玻尔提出了以下几个基本假设:•假设1:电子只能在特定的能级中存在,这些能级称为定态。
电子在不同的能级之间跃迁时会吸收或释放特定的能量。
•假设2:电子在一个特定的能级上运动时,不会辐射出能量。
只有当电子跃迁到另一个能级时,才会辐射或吸收能量。
•假设3:电子的运动轨道是圆形或椭圆形。
这些轨道称为原子壳层。
这些基本假设为玻尔原子结构模型奠定了基础,使得科学家们可以通过一系列计算和实验验证来解释原子结构和光谱现象。
4. 玻尔模型的数学描述玻尔通过一系列数学推导,给出了玻尔模型的数学描述。
以下是玻尔模型的主要公式:•公式1:mvr=nℎ2π这个公式描述了电子在原子壳层上运动时的角动量量子化条件。
其中m为电子质量,v为电子速度,r为轨道半径,n为主量子数(表示壳层),h为普朗克常数。
•公式2:E=−2π2me4nℎ2这个公式描述了原子能级的能量。
其中E为能量,e为电子电荷。
•公式3:E=−R H Z2n2这个公式是玻尔模型中的定态能级公式。
其中R H为里德堡常数,Z为原子核电荷数。
通过这些公式,玻尔模型可以计算出不同能级上电子的运动轨道、角动量和能量。
5. 玻尔模型的应用和局限性玻尔模型的提出对解释氢光谱等实验现象起到了重要作用,并且为后续量子力学理论的发展奠定了基础。