电化学相平衡-习题课讲解
- 格式:ppt
- 大小:469.00 KB
- 文档页数:38



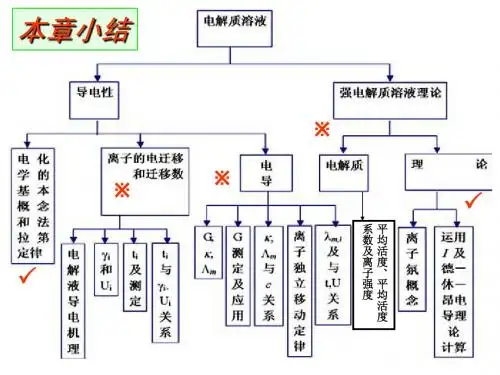
第六章相平衡中、英文习题与参考答案1、 在推导相律时,C 个组分是否在每一相中都必须存在?答:在推导相律时,随然假设C 个组分在每一相中都存在,但实际某一相中的组分数即使小于C ,限制条件同样随之减少,相律不受影响。
2、 指出下列各系统的独立组分数和自由度数:(1) (1) NH4Cl(s)部分分解为NH3(g)和HCl(g),并达到分解平衡; (2) (2) CaCO3(s)达到分解平衡;(3) (3) C(s)和CO(g)、CO2(g)、O2(g)在700℃时达到平衡。
[(1)、2,2。
(2)、2,1。
(3)、2,1。
](4) 3、试用相相律分析,用碳还原金属氧化物MeO 的反应体系中能否用控制温度来控制Me 的蒸气压? (5) 解:系统中反应:(6) C(s)+MeO(s)=CO(g)+Me(g) (7) 2CO(g)=CO2(g)+C(s) (8) 压力平衡: (9) ()()()g CO g CO g Me p p p 22+=(10) 系统中C=5-2-1=2 (11)P=3F=C-P+2 =3-3-2=1由于自由度为1,平衡时T 、p 及各物质浓度等条件中只有一个是独立变化的,所以指定温度时,压力随之而改变,可以用控制温度来控制Me 的蒸汽压。
4、如何用相律说明两组分气液平衡相图中恒沸点混合物是混合物而不是化合物。
答:二组分气液平衡相图系统恒沸混合物特点是,气相与其平衡的液相组成如何相同,R ‘=1。
由相律可知:F=C+P+2 =(2-0-2)-2+2 =1压力确定时,该平衡系统中温度、气、液相组成也恒定,若压力改变时,平衡系统中温度、气、液相组成也相应改变。
所以恒沸点组成随压力改变而改变。
因此,恒沸混合物是混合物而不是化合物。
5、在100 kPa 下,A 、B 二组分系统的沸点-组成图 如右图:(1) (1) 图中E 点对应的温度TE 称为什麽温度,此 点对应的气相和液相的组成有何关系? (2) (2) 曲线1和曲线4各称为什麽线?(3) (3) 总组成在0~xB,E 范围内,B 组分在气相中的含量与在平衡液相中的含量有和何关系?答:(1)图中E 点对应的温度TE 称最低恒沸点,此 点对应的气相和液相的组成相等。


天津大学第五版物理化学下册习题解答第六章 相平衡6-1 指出下列平衡系统中的组分数C ,相数P 及自由度数F : (1)I 2(s )与其蒸气成平衡;(2)CaCO 3(s )与其分解产物CaO (s )和CO 2(g )成平衡;(3)NH 4HS(s)放入一抽空的容器中,并与其分解产物NH 3(g)和H 2S(g)成平衡; (4)取任意量的NH 3(g)和H 2S(g)与NH 4HS(s)成平衡;(5) I 2作为溶质在两不相互溶液体H 2O 和CCl 4中达到分配平衡(凝聚系统)。
解:(1) S-R-R '=1-0-0=1;P=2;F=C-P+2=1 (2) S-R-R '=3-1-0=2;P=3;F=C-P+2=1 (3) S-R-R '=3-1-1=1;P=2;F=C-P+2=1 (4) S-R-R '=3-1-0=2;P=2;F=C-P+2=2 (5) S-R-R '=3-0-0=3;P=2;F=C-P+1=2 6-2常见的)(32s CO Na 水合物有)(10)(7),(232232232s O H CO Na s O H CO Na s O H CO Na ⋅⋅⋅和(1)101.325kPa 下,与32CO Na 水溶液及冰平衡共存的水合物最多有几种? (2)20℃时,与水蒸气平衡共存的水合物最多可能有几种? 解 系统的物种数S=5,即H 2O 、)(32s CO Na 、)(10)(7),(232232232s O H CO Na s O H CO Na s O H CO Na ⋅⋅⋅和。
独立的化学反应式有三个:)()()(232232s O H CO Na l O H s CO Na ⋅=+)(7)(6)(2322232s O H CO Na l O H s O H CO Na ⋅=+⋅ )(10)(3)(72322232s O H CO Na l O H s O H CO Na ⋅=+⋅则R=3没有浓度限制条件 0'=R所以,组分数 C=S-R-'R =5-3-0=2在指定的温度或压力的条件下,其自由度数 F=C-P+1=3-P 平衡条件下F=0时相数最多,因此上述系统最多只能有3相共存。



2017年高考化学二轮复习专题08 电化学(讲)(含解析)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(2017年高考化学二轮复习专题08 电化学(讲)(含解析))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为2017年高考化学二轮复习专题08 电化学(讲)(含解析)的全部内容。
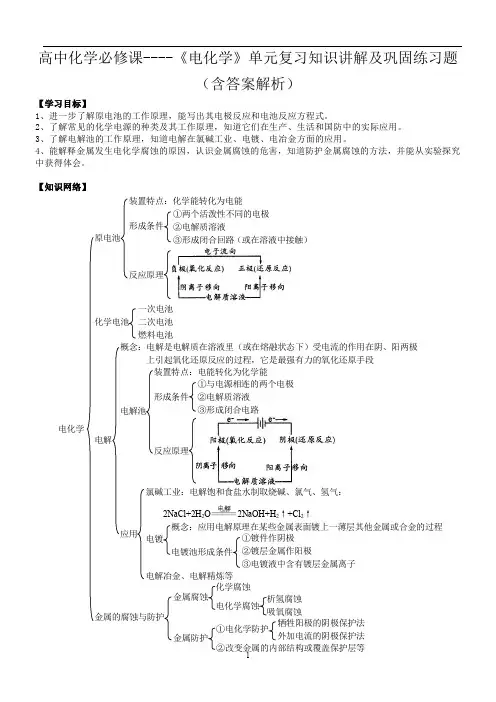
专题08 电化学(讲)考向一原电池(1)考纲要求1.了解原电池的工作原理,能写出常见的电极反应和电池反应方程式。
2。
了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害、防止金属腐蚀的措施.(2)命题规律原电池作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位,在高考中主要考查原电池的工作原理、电极反应及电池反应的方程式、电池中溶液pH的变化以及有关电化学的计算等,由于能源问题已成为社会热点,从能源问题切入,结合新能源开发及新型电池仍将会出现在今后高考试题中.【例1】【2016年高考海南卷】某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液.下列说法正确的是()A.Zn为电池的负极B.正极反应式为2FeO42−+ 10H++6e−=Fe2O3+5H2OC.该电池放电过程中电解质溶液浓度不变D.电池工作时OH 向负极迁移【答案】AD考点:考查原电池原理及化学电源【名师点睛】原电池原理是建立在氧化还原和电解质溶液基础上,借助氧化还原反应实现化学能与电能的相互转化,是高考命题重点,题目主要以选择题为主,主要围绕原电池的工作原理、电池电极反应的书写与判断、新型电池的开发与应用等进行命题。
【例2】【2016年高考新课标Ⅱ卷】Mg—AgCl电池是一种以海水为电解质溶液的水激活电池.下列叙述错误的是 ( )A.负极反应式为Mg-2e-=Mg2+B.正极反应式为Ag++e—=AgC.电池放电时Cl—由正极向负极迁移D.负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑【答案】B【解析】试题分析:根据题意,电池总反应式为:Mg+2AgCl=MgCl2+2Ag,正极反应为:2AgCl+2e-= 2Cl—+ 2Ag,负极反应为:Mg—2e—=Mg2+,A项正确,B项错误;对原电池来说,阴离子由正极移向负极,所以电池放电时Cl-由正极向负极迁移,C项正确;由于镁是活泼金属,则负极会发生副反应Mg+2H2O=Mg(OH)2+H2↑,D项正确;答案选B.【考点定位】考查原电池的工作原理。