无机化学酸碱质子理论
- 格式:docx
- 大小:10.84 KB
- 文档页数:3


酸碱质子理论
一、酸碱质子理论中酸碱的定义
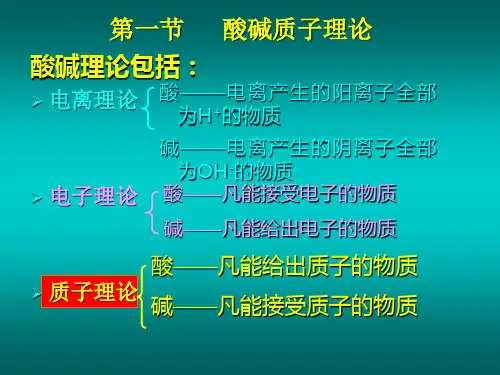
1923年,布朗斯特德和劳瑞各自独立提出酸碱质子理论:
酸:能够给出质子(H+)的物质
碱:能够接受质子(H+)的物质
酸碱反应指质子有给予提向接受体的转移过程。
酸=碱+H+
上式酸碱称为共轭酸碱对。
酸碱质子理论很好的说明了NH3是碱,因为它可以接受质子生成NH4+,同时也解释了非水溶剂中的酸碱反应。
二、共轭酸碱对
质子理论中无盐的概念,电离理论中的盐,在质子理论中都是离子酸或离子碱;
酸碱质子理论中酸碱具有相对概念:酸可以是分子、阳离子、阴离子;碱也可以是分子、阳离子、阴离子。
既能给出质子又能接受质子的物质,称为两性物质,如H2O。
三、酸碱反应的实质
●酸越强,其共轭碱越弱;碱越强,其共轭酸越弱
●反应总是向生成相对较弱的酸和碱的方向进行
●对于某种物种,是酸是碱取决于参与的具体反应
四、酸碱质子理论的优缺点
优点:酸碱概念扩大到所有含有质子的体系,适用于水溶液,非水溶液,气相溶液,无溶剂体系。
缺点:只适用于包含质子转移的反应。


无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:nRT PV = R 为气体摩尔常数,数值为R =11--⋅⋅K mol J3、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物 !1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton 分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃= STP 下压强为 = 760mmHg = 76cmHg)第二章:热化学第一节:热力学术语和基本概念1、 系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为: …⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、 状态是系统中所有宏观性质的综合表现。
描述系统状态的物理量称为状态函数。
状态函数的变化量只与始终态有关,与系统状态的变化途径无关。
3、 系统中物理性质和化学性质完全相同而与其他部分有明确界面分隔开来的任何均匀部分叫做相。
相可以由纯物质或均匀混合物组成,可以是气、液、固等不同的聚集状态。
4、 化学计量数()ν对于反应物为负,对于生成物为正。
5、反应进度νξ0)·(n n sai k et -==化学计量数反应前反应后-,单位:mol第二节:热力学第一定律 0、 : 1、 系统与环境之间由于温度差而引起的能量传递称为热。
热能自动的由高温物体传向低温物体。
系统的热能变化量用Q 表示。
若环境向系统传递能量,系统吸热,则Q>0;若系统向环境放热,则Q<0。

无机化学,有机化学,物理化学,分析化学无机化学元素化学、无机合成化学、无机高分子化学、无机固体化学、配位化学(即络合物化学)、同位素化学、生物无机化学、金属有机化学、金属酶化学等。
有机化学普通有机化学、有机合成化学、金属和非金属有机化学、物理有机化学、生物有机化学、有机分析化学。
物理化学结构化学、热化学、化学热力学、化学动力学、电化学、溶液理论、界面化学、胶体化学、量子化学、催化作用及其理论等。
分析化学化学分析、仪器和新技术分析。
包括性能测定、监控、各种光谱和光化学分析、各种电化学分析方法、质谱分析法、各种电镜、成像和形貌分析方法,在线分析、活性分析、实时分析等,各种物理化学性能和生理活性的检测方法,萃取、离子交换、色谱、质谱等分离方法,分离分析联用、合成分离分析三联用等。
无机化学第一章:气体第一节:理想气态方程1、气体具有两个基本特性:扩散性和可压缩性。
主要表现在:⑴气体没有固定的体积和形状。
⑵不同的气体能以任意比例相互均匀的混合。
⑶气体是最容易被压缩的一种聚集状态。
2、理想气体方程:为气体摩尔常数,数值为=8.3143、只有在高温低压条件下气体才能近似看成理想气体。
第二节:气体混合物1、对于理想气体来说,某组分气体的分压力等于相同温度下该组分气体单独占有与混合气体相同体积时所产生的压力。
2、Dlton分压定律:混合气体的总压等于混合气体中各组分气体的分压之和。
3、(0℃=273.15K STP下压强为101.325KPa=760mmHg=76cmHg)第二章:热化学第一节:热力学术语和基本概念1、系统与环境之间可能会有物质和能量的传递。
按传递情况不同,将系统分为:⑴封闭系统:系统与环境之间只有能量传递没有物质传递。
系统质量守恒。
⑵敞开系统:系统与环境之间既有能量传递〔以热或功的形式进行〕又有物质传递。
⑶隔离系统:系统与环境之间既没有能量传递也没有物质传递。
2、状态是系统中所有宏观性质的综合表现。


无机化学-知识点总结无机化学知识点总结无机化学是化学学科的一个重要分支,它研究的是无机物质的组成、结构、性质和反应等方面的知识。
以下是对无机化学中一些重要知识点的总结。
一、原子结构与元素周期表1、原子结构原子由原子核和核外电子组成。
原子核包含质子和中子,质子带正电荷,中子不带电。
核外电子绕核运动,处于不同的能级和轨道。
电子的排布遵循泡利不相容原理、能量最低原理和洪特规则。
2、元素周期表元素周期表是按照原子序数递增的顺序排列的。
周期表中的横行称为周期,纵列称为族。
同一周期元素的电子层数相同,从左到右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。
同一主族元素的最外层电子数相同,从上到下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。
二、化学键与物质结构1、化学键化学键包括离子键、共价键和金属键。
离子键是由阴阳离子之间的静电作用形成的,通常存在于活泼金属与活泼非金属之间。
共价键是原子之间通过共用电子对形成的,分为极性共价键和非极性共价键。
金属键是金属原子之间通过自由电子形成的。
2、物质结构物质的结构有原子晶体、分子晶体、离子晶体和金属晶体。
原子晶体如金刚石,由原子通过共价键形成空间网状结构,硬度大,熔点高。
分子晶体如干冰,通过分子间作用力结合,熔点和沸点较低。
离子晶体由阴阳离子通过离子键形成,熔点较高,硬度较大。
金属晶体由金属阳离子和自由电子组成,具有良好的导电性、导热性和延展性。
三、化学热力学基础1、热力学第一定律能量守恒定律在热力学中的体现,即ΔU = Q + W,其中ΔU 为热力学能的变化,Q 为吸收或放出的热量,W 为做功。
2、热力学第二定律指出了热功转换的方向性和不可逆性,即自发过程总是朝着熵增加的方向进行。
3、热力学第三定律规定了绝对零度时,纯物质的完美晶体熵值为零。
四、化学反应速率和化学平衡1、化学反应速率表示化学反应进行快慢的物理量,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。



无机化学酸碱质子理论集团文件发布号:(9816-UATWW-MWUB-WUNN-INNUL-DQQTY-酸碱质子理论酸碱质子理论(布朗斯特-劳里酸碱理论)是丹麦化学家布朗斯特和英国化学家汤马士·马丁·劳里于1923年各自独立提出的一种酸碱理论12。
该理论认为:凡是可以释放质子(氢离子,H+)的分子或离子为酸(布朗斯特酸),凡是能接受氢离子的分子或离子则为碱(布朗斯特碱)。
当一个分子或离子释放氢离子,同时一定有另一个分子或离子接受氢离子,因此酸和碱会成对出现。
酸碱质子理论可以用以下反应式说明:酸 + 碱≒共轭碱 +共轭酸酸在失去一个氢离子后,变成共轭碱;而碱得到一个氢离子后,变成共轭酸。
以上反应可能以正反应或逆反应的方式来进行,不过不论是正反应或逆反应,均维持以下的原则:酸将一个氢离子转移给碱。
在上式中,酸和其对应的共轭碱为一组共轭酸碱对。
而碱和其对应的共轭酸也是一组共轭酸碱对。
在这里,酸和碱具有同一性,互为存在条件,在一定条件下又朝着与自己相反的方向转化,这是符合唯物辩证法的。
酸碱离子理论是阿累尼乌其斯(Arrhenius)根据他的电离学说提出来的。
他认为在水中能电离出氢离子并且不产生其它阳离子的物质叫酸。
在水中能电离出氢氧根离子并且不产生其它阴离子的物质叫碱。
酸碱中和反应的实质是氢离子和氢氧根离子结合成水。
这个理论取得了很大成功,但它的局限性也早就暴露出来,倒台。
例如气态氨与氯化氢反应迅速生成氯化铵,这个酸碱中和反应并未掺杂水的生成;又如氨的水溶液显碱性,曾被错误地认为是NH3和H2O形成弱电解质NH4OH分子,然后离解出OH-等。
由于阿累尼乌斯的酸碱离子理论不能解一些非水溶液中进行的酸碱反应等问题,1923年布朗斯特(Bronsted)提出了酸碱质子理论,把酸碱概念加以推广。
酸碱质子理论认为凡是能给出质子的物质都是酸,凡是能与质子结合的物质都是碱。
即酸是质子的给予体,碱是质子的接受体。
大一无机化学知识点整理一、化学基本概念。
1. 物质的量(n)- 定义:表示含有一定数目粒子的集合体,单位为摩尔(mol)。
- 阿伏伽德罗常数(N_A):1mol任何粒子的粒子数,N_A =6.02×10^23mol^-1。
- 物质的量与粒子数(N)的关系:n=(N)/(N_A)。
2. 摩尔质量(M)- 定义:单位物质的量的物质所具有的质量,单位为g/mol。
- 数值:以g/mol为单位时,摩尔质量在数值上等于该物质的相对原子质量或相对分子质量。
- 物质的量(n)、质量(m)和摩尔质量(M)的关系:n = (m)/(M)。
二、化学中的计量关系。
1. 气体摩尔体积(V_m)- 定义:单位物质的量的气体所占的体积,单位为L/mol。
- 在标准状况(0^∘C,101kPa)下,V_m=22.4L/mol。
- 物质的量(n)、气体体积(V)和气体摩尔体积(V_m)的关系:n=(V)/(V_m)。
2. 阿伏伽德罗定律及其推论。
- 阿伏伽德罗定律:同温同压下,相同体积的任何气体都含有相同数目的分子。
- 推论:- 同温同压下,frac{V_1}{V_2}=frac{n_1}{n_2}。
- 同温同体积下,frac{p_1}{p_2}=frac{n_1}{n_2}。
三、溶液。
1. 物质的量浓度(c)- 定义:单位体积溶液里所含溶质B的物质的量,单位为mol/L。
- 计算公式:c=(n)/(V)(n为溶质的物质的量,V为溶液体积)。
2. 溶液的稀释。
- 稀释定律:c_1V_1=c_2V_2(c_1、c_2为稀释前后溶液的物质的量浓度,V_1、V_2为稀释前后溶液的体积)。
四、原子结构。
1. 原子的组成。
- 原子由原子核和核外电子组成,原子核由质子和中子组成。
- 原子序数(Z)=核电荷数 = 质子数 = 核外电子数。
- 质量数(A)=质子数(Z)+中子数(N)。
2. 核外电子排布规律。
- 能量最低原理:电子总是先排布在能量最低的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里。
无机化学中的酸碱理化学12208邢颍楠无机化学中的酸碱理论摘要:本文简要地论述了无机酸碱理论的发展,及浅议各无机酸碱理论关键词:无机化学,酸碱理论,认识,发展,作用1.无机化学酸碱理论的早期发展17世纪前,人们普遍认为酸指一切有酸味的物质,碱指一切有涩味滑腻感的物质。
显然,并无科学性与规律性。
1663年,英国化学家波义耳根据实验总结出了朴素酸碱理论认为,酸:凡物质的水溶液能溶解某些金属、跟碱接触会失去原有的特性、而且能使石蕊试液变红的物质。
碱:凡物质的水溶液有苦涩味、能腐蚀皮肤、与酸接触后失去原有特性、而且能使石蕊试液变蓝的物质。
可以看出,波义耳的定义虽比前人高明许多,但仍很不完善,易与盐混淆。
如氯化铁、碳酸钾符合波义耳朴素酸碱理论,但它们实际上却是盐。
1787年,法国化学家拉瓦锡进一步发展了酸碱理论,他做了大量的实验,分析了当时几乎所有的酸(硫酸、硝酸),发现其中都含有氧,阐明其观点为“:一般的可燃物质(指非金属)燃烧以后通常变为酸,因此氧是酸的本原,一切酸中都含有氧。
”很显然,拉瓦锡没有能够从盐酸中分离出氧,但他却认为盐酸中的氧被牢固的结合了,用一般的方法分离不出。
2. 阿累尼乌斯的水离子理论凡在水溶液中产生氢离子H+的物质叫做酸,而在水溶液中产生氢氧根离子OH-的物质叫做碱。
酸碱中和反应就是H+和OH-结合生成中性水分子的过程。
这就是大家熟知的建立在电离理论基础上的水一离子酸碱定义。
从定性的角度讲,它并不比李比希的定义前进了多少。
但是它给出了一个比较满意的碱的定义。
水一离子理论抓住了氢离子和氢氧根离子这一关键问题。
它的重要性在于提供了一个描述酸碱强度的定量标度。
因为溶液中氢离子和氢氧根离子的浓度是可以通过测量电导而加以测定的。
利用pH计甚至可以直接侧出H+浓度,利用酸碱平衡常数Ka、Kb或pKa、pKb,人们可以比较精确地比较各种酸碱的相对强度。
水一离子理论的最大缺陷是只能限用于水溶液中,例如它不能回答象无水氯化氢究竟算不算酸的问题,也不能说明发生在其它非水质子溶剂(如液氨、液态氟化氢)和非质子溶剂(如液态二氧化硫、液态四氧化二氮)中的酸碱反应问题,更无法阐述根本不存在溶剂的酸碱反应体系,如BaO(S)跟液态或气态SO3反应生成BaSO4等。
酸碱质子理论
酸碱质子理论(布朗斯特-劳里酸碱理论)是丹麦化学家布朗斯特和
英国化学家汤马士·马丁·劳里于1923年各自独立提出的一种酸碱理论12。
该理论认为:凡是可以释放质子(氢离子,H+)的分子或
离子为酸(布朗斯特酸),凡是能接受氢离子的分子或离子则为碱(布朗斯特碱)。
当一个分子或离子释放氢离子,同时一定有另一个分子或离子接受氢离子,因此酸和碱会成对出现。
酸碱质子理论可以用以下反应式说明:酸+ 碱≒共轭碱+共轭酸
酸在失去一个氢离子后,变成共轭碱;而碱得到一个氢离子后,变成
共轭酸。
以上反应可能以正反应或逆反应的方式来进行,不过不论是正反应或逆反应,均维持以下的原则:酸将一个氢离子转移给碱。
在上式中,酸和其对应的共轭碱为一组共轭酸碱对。
而碱和其对应的共轭酸也是一组共轭酸碱对。
在这里,酸和碱具有同一性,互为存在条件,在一定条件下又朝着与自己相反的方向转化,这是符合唯物辩证法的。
酸碱离子理论是阿累尼乌其斯(Arrhenius)根据他的电离学说提出来的。
他认为在水中能电离出氢离子并且不产生其它阳离子的物质叫酸。
在水中能电离出氢氧根离子并且不产生其它阴离子的物质叫碱。
酸碱中和反应的实质是氢离子和氢氧根离子结合成水。
这个理论取得了很大成功,但它的局限性也早就暴露出来,倒台。
例如气态氨与氯化氢反应迅速生成氯化铵,这个酸碱中和反应并未掺杂水的生成;又如氨
的水溶液显碱性,曾被错误地认为是NH3和H2O形成弱电解质
NH4OH分子,然后离解出OH-等。
由于阿累尼乌斯的酸碱离子理论不能解一些非水溶液中进行的酸碱反应等问题,1923年布朗斯特(Bronsted)提出了酸碱质子理论,把酸碱概念加以推广。
酸碱质子理论认为凡是能给出质子的物质都是酸,凡是能与质子结合的物质都是碱。
即酸是质子的给予体,碱是质子的接受体。
这样,一个酸给出质子后余下的部分自然就是碱,因为它本身就是与质子结合的。
它们的关系如下:
这种关系叫做酸碱的共轭关系,式中略去了HB和B可能出现的电荷。
右边的碱是左边酸的共轭碱,左边的酸是右边碱的共轭酸,两者组成一个共轭酸碱对,它们只差一个质子。
酸和碱可以是分子,也可以是阳离子和阴离子。
还可以看出,像(HPO4)2-这样的物质,既表现酸,也表现为碱,所以它是两性物质。
同理,H2O,HCO3-等也是两性物质。
共轭酸碱
用KW表示[H3O+][OH-],KW称为水的离子积。
这说明在一定温度下,水中的[H3O+]与[OH-]的乘积为一常数。
所以Ka·Kb=KW
24℃时KW值为1.0×10-14.这个关系说明,只知道了酸的离解常数Ka,就可以计算出它的共轭碱的Kb,反之亦然。
Ka和Kb是成反比的,而Ka和Kb正是反映酸和碱的强度,所以,在共轭酸碱对中,酸的强度愈大,其共轭碱的强度愈小;碱的强度愈大,其共轭酸的强度愈小。
一些共轭酸碱对的强度次序。
酸性增强共轭酸(HB) Ka(在水中) pKa(在水中) 共轭碱(B) 碱性增强
H3O+ H2O H2C2O4 5.4×10-2 1.27 HC2O-4 H2SO3 1.54×10 1.81 HSO-3 HSO-4 1.20×10-2 1.92 SO2-4 H3PO4 7.51×10-3 2.12 H2PO-4 HNO2
4.6×10-4 3.37 NO-2 HF 3.53×10-4 3.45 F- HCOOH 1.77×10-4 3.75 HCOO-HC2O-4
5.4×10-5 4.27 C2O2-4 CH3COOH 1.76×10-5 4.75 CH3COO-
H2CO3 4.30×10-7 6.37 HCO-3 HSO-3 1.02×10-7 6.91 SO2-3 H2S 9.1×10-8 7.04 HS- H2PO-4 6.23×10-8 7.21 HPO2-4 NH+4 5.68×10-10 9.25 NH3 HCN 4.93×10-10 9.31 CH- HCO-3 5.61×1011 10.25 CO2-3 H2O2
2.4×10-12 11.62 HO-2 HS- 1.1×10-12 11.96 S2- HPO2-4 2.2×10-13 12.67 PO3-4 H2O OH-
根据酸碱质子理论,酸碱在溶液中所表现出来的强度,不仅与酸碱的本性有关,也与溶剂的本性有关。
我们所能测定的是酸碱在一定溶剂中表现出来的相对强度。
同一种酸或碱,如果溶于不同的溶剂,它们所表现的相对强度就不同。
例如HOAc在水中表现为弱酸,但在液氨中表现为强酸,这是因为液氨夺取质子的能力(即碱性)比水要强得多。
这种现象进一步说明了酸碱强度的相对性。
折叠。