实验七 鱼粉中组胺含量的测定
- 格式:doc
- 大小:24.50 KB
- 文档页数:1

鱼粉组胺标准
鱼粉组胺标准是指对鱼粉中组胺含量的限制标准。
组胺是一种生物胺,可以在食品中产生,尤其是在腐败的鱼类中。
组胺含量过高会对人体健康造成危害,如引起头痛、头晕、恶心、呕吐等症状,严重时可导致过敏反应、休克等。
以下是鱼粉组胺标准的历史发展:
1. 欧盟标准:欧盟对鱼粉中组胺含量的限制标准为200mg/kg。
2. 美国标准:美国FDA对鱼粉中组胺含量的限制标准为500mg/kg。
3. 中国标准:中国对鱼粉中组胺含量的限制标准为400mg/kg。
4. 日本标准:日本对鱼粉中组胺含量的限制标准为100mg/kg。
以上标准均是针对鱼粉中组胺含量的限制标准,不同国家和地区的标准存在差异,但都是为了保障人体健康而制定的。

鱼粉的主要卫生学问题及评价方法鱼粉是畜、禽、水产饲料中一种非常重要的动物性蛋白质原料,它在饲料工业中的地位不容取代。
目前,由于我国渔业资源相对匮乏,鱼粉的价格一直居高不下。
本文主要从蛋白质鲜度指标、油脂新鲜度指标和霉变程度等几个卫生学指标对鱼粉的品质进行科学的评价。
1 主要的卫生学问题1.1 脂肪酸败1.1.1 产生原因及机理脂肪酸败的实质是由于鱼粉长期储存在不适宜条件下发生的一系列化学变化,其中含有不饱和键的物质(脂肪、脂肪酸、脂溶性维生素及其他的脂溶性的物质)被氧化成游离脂肪酸、酮和醛等多种氧化产物,从而酸价、过氧化物值等发生改变,其营养价值降低(刘晓华和陈汉生,2001)。
在生产实践中,长期存放在高温、高湿的环境中与空气中的氧和过氧化物过多接触以及掺杂了一些油脂含量高的物质,是鱼粉脂肪酸败的主要原因。
1.1.2 对鱼粉品质及动物健康的影响1.1.2.1 降低营养价值脂肪酸败造成鱼粉中营养成分的破坏,使其中的营养价值降低或完全不能作为饲料原料供生产加工。
在脂肪酸败过程中产生大量高活性的自由基,这些自由基对VA、VD、VE、VK产生极大的破坏性,同时对B族维生素的吸收利用也有一定的影响(俞海峰等,2004)。
1.1.2.2 影响动物生产性能研究表明,鱼粉脂肪酸败可损害动物生产性能。
大鼠(Heman,1973)、肉鸡(Hussrin,1982)摄食含氧化油脂的饲料后,饲料利用率下降,严重者可出现失重,甚至死亡等现象。
鱼粉脂肪酸败可引起产蛋率急剧下降(顾浩清等,1991)。
1.1.2.3 影响动物消化功能油脂氧化产生的游离脂肪酸会减少胆汁的产生或降低乳糜微粒形成的效率,使油脂与消化道内壁接触的时间减少,从而干扰油脂在消化道内的吸收。
对于肉鸡和蛋鸡来讲,鱼粉酸败阻碍叶黄素类色素在肠道内的吸收,从而导致肉鸡皮肤达不到理想效果及蛋鸡所产蛋的蛋黄着色不佳(俞海峰等,2004)。
1.1.2.4 对鱼类的影响鱼油氧化酸败的中间产物或最终产物将严重影响养殖动物的正常生理状态的维持,继而影响生长速度,严重的会导致鱼体死亡。

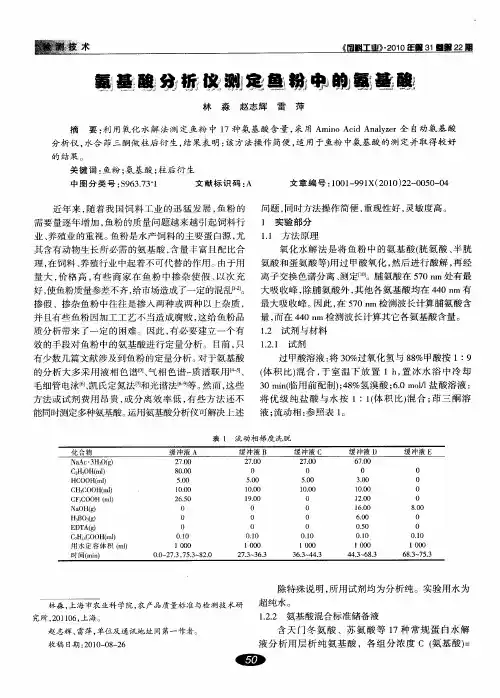
鱼粉中组胺的测定原理简介:鱼粉中组胺用三氯乙酸提取,之后调PH=9,将游离的组胺用正戊醇提取出,之后再用HCL反萃取,用偶氮试剂显色。
组胺+三氯乙酸盐(溶于水)--PH=9--组胺(溶于正戊醇)--HCl--正戊醇(组胺溶于稀HCl)1试剂与溶液1.1偶氮试剂的配制甲液:称取0.5g对硝基苯胺,加5ml盐酸(1+1)溶解,再加水释到200ml,置冰箱中(2~8度)保存。
乙液:亚硝酸钠溶液5g/l,临用现配甲液5ml、乙液40ml混合后立刻使用。
1.2三氯乙酸100 g/L1.3氢氧化钠250g/L1.4盐酸1mol/L1.5正戊醇分析纯1.6碳酸氢钠溶液50g/L1.7磷酸组胺(Sigma公司)步骤2.1样品处理称取1--3克鱼粉于具塞三角瓶内,加入25.0ml三氯乙酸(100g/L)每隔30分钟摇动一次,提取3小时,过滤,取滤液1.00ml或2.00ml于15ml试管内,加氢氧化钠(250g/L)5滴,振荡一下,再加5ml正戊醇振荡2分钟,静止分层(如出现乳化现象可滴加2--3滴无水乙醇),用移液枪小心吸取上清液(正戊醇层)于50ml分液漏斗内,下层沉淀再下层沉淀再分别用正戊醇5ml、3ml、3ml反萃取3次。
将正戊醇全部收集到50ml分液漏内,分别用盐酸(1mol/L)6ml、6ml、3ml反萃取3次,收集水相(下层)于20ml刻度试管内,用水定容至刻度(20.00ml),摇匀,吸取1.00ml(或2.00ml)盐酸提取液于10ml比色管中,加入碳酸氢钠溶液(50g/L)3.0ml摇匀,振荡下加入偶氮试剂3.0ml,用水定容到刻度,室温下显色10min,用1cm比色皿于480nm下测定吸光度。
2.2标准曲线称取磷酸组胺样品(Sigma公司)2.7671mg,置于100ml容量瓶内,用水溶解并定容到刻度,此液组胺含量为10ug/ml,分别取此标液0.00、1.00、2.00、4.00、6.00ml于5支10ml比色管内,各加盐酸(1mol/L)1.0ml,加入碳酸氢钠溶液(50g/L)3.0ml摇匀,振荡下加入偶氮试剂3.0ml,振荡,用水定容到刻度,摇匀后放置10min(室温下),用1cm比色皿于480nm下测吸光值。


近红外光谱分析技术测定鱼粉中三聚氰胺含量一、实验背景:近红外光谱技术被誉为90年代以来发展最快的光谱分析技术[1],是光谱测量技术与化学计量学学科的有机结合,采用化学计量学方法分析处理实验数据,从而对样品进行定性和定量分析测定,是一种快速、无损的新型检测技术。
近红外光谱技术直接由近红外光谱,通过不同的数学模型,在极短时间内测定样品中的多种成份或与其有关的多种物理、化学或生物学性质。
二、实验目的:1.掌握利用近红外光谱作定性分析的基本原理。
2.掌握利用近红外光谱进行定性鉴定的基本过程。
3.掌握使用近红外光谱仪的主要操作步骤。
三、实验原理:近红外光谱分析技术是光谱测量技术与化学计量学学科的有机结合,光谱分析中红外光谱一般用于定性分析,其与分子结构关系密切,而紫外光谱多用于物质定量分析,基于溶液对其吸收满足的朗伯比尔定律,近红外光在波长上介于紫外与红外之间,其兼有定性和定量分析的作用。
近红外光谱分析需建立数学模型,其分析依赖于编程及数学模型的建立,利用标准方法提供的大量数据用化学计量学及统计学理论建立数学模型,建立模型前需进行合格性测试,聚类分析,初拟定性模型并验证,比对模型进行修正与维护、更新等。
在建立校正曲线或数据库之前, 把测试样品先作近红外扫描, 然后再用传统分析法(如:GC、HPLC、TKN、FIA、折光仪等) 准确测定出样品的数值, 具有不同指标的样品在近红外光谱中将产生不同强度的吸收图谱,将数据信号平滑与归一化处理后,再利用专用软件处理, 便可得到校正曲线或数据库,分析人员可利用该校正曲线或数据库方便快速地通过测定未知样品的近红外谱图得知其被测指标的数据即通过模式识别(计算比较光谱间距离)与偏最小二乘回归,多元线性回归,主成分回归等进行定性、定量分析。
四、实验步骤:实验用近红外光谱分析法测定鱼粉三聚氰胺含量,实验具体应包含检测模型的建立(即合格性测试,聚类分析,建立模式识别模型等),而实验采用已建立的模型为基础,所以直接将未知样品的近红外图谱与数据模型通过专用软件比较处理,得出定性、定量结果。


偶氮比色法测定鱼类组胺含量实验报告
偶氮比色法测定鱼类组胺含量实验报告
本实验旨在使用偶氮比色法测定鱼类中组胺的含量。
组胺是一种
常见的生物胺,其含量高会对人体健康造成危害。
因此,对食品中组
胺含量的检测十分必要,本实验将使用偶氮比色法对鱼类中组胺含量
进行测定。
实验材料:鱼类样品、无水乙醇、氯化钠、三氯乙酸、偶氮二甲苯、去离子水、标准组胺溶液等。
实验步骤:
1.取适量鱼类样品,用无水乙醇将其浸泡3小时,摇匀后离心10分钟。
取上清液置入容量瓶中,加去离子水至刻度线。
2.取5ml上清液放入离心管中,加入氯化钠和三氯乙酸,离心10分钟,取上清液备用。
3.取出0.5ml上清液置于试管中,加入偶氮二甲苯溶液和氯化钠
溶液,摇匀,静置10分钟。
4.加入去离子水至刻度线,摇匀后立即测定吸光度。
5.将标准组胺按照上述方法进行操作,测定吸光度,并以标准曲
线计算出样品中组胺的含量。
实验结果:
本实验使用偶氮比色法对鱼类样品进行测定,得出样品中组胺的
含量为50mg/kg。
实验结论:
本次实验使用偶氮比色法成功测定了鱼类样品中组胺的含量。
通
过实验结果可以看出,该样品中组胺含量较高,需要加以注意。
同时,该方法简单易操作,可用于食品中组胺含量的检测。
总结:
本次实验使用的偶氮比色法是一种常见的检测组胺含量的方法,
操作简单,结果可靠。
通过该方法可以快速准确地测定食品中的组胺
含量,对于保障人们的健康非常重要。
同时,在实验中还需要加强对化学试剂的储存和使用,避免误操作造成危险。



鱼粉中掺入铵盐的检验
3.2.1原理:
铵盐一般都含有氨态氮,奈斯勒试剂能与含氨态氮物质产生黄褐色沉淀,尿素在碱性条件下,由于尿素酶的催化作用,可生成氨态氮。
3.2.2检验方法:
取鱼粉试样1-2g于试管中,加10ml水振摇2min,静置20min,取上清液2ml到蒸发皿中,加入1mol/l氢氧化钠溶液1ml置水浴上蒸干,再加水数滴和生豆粉约10mg,静置2-3min,加奈斯勒试剂2滴。
如试样有黄褐色沉淀产生则表
明有尿素存在。
鱼粉中掺有铵态氮物质的检验方法:取鱼粉1-2g,加水10ml,振摇2min,静置20min,取上清液2ml加1mol/l氢氧化钠1ml,加奈斯勒试剂2滴。
如试样有黄褐色沉淀表明有NH4+存在。
实验五组胺含量的测定一、实验目的:学习比色法测定组胺含量的原理和方法二、实验原理:鱼肉中的组胺用正戊醇提取,与偶氮试剂反应显橙色,与标准系列比较定量,即可求出组胺含量三、实验原料:鱼肉四、实验试剂与仪器:Na2CO3、NaOH、对硝基苯胺、正戊醇、三氯乙酸、盐酸、组胺标准品、具塞锥形瓶、分液漏斗、721分光光度计等五、实验方法:1、组胺标准曲线的制定:称取25mg于105℃干燥至恒重的磷酸组胺定容至100ml 得到250ug/ml,再稀释配制成100ug/ml的组胺标准液,取上述标准使用液0、0.4、0.8、1.2、1.6、2.0于10ml容量瓶中,并用1mol/LHCl补足至3ml,然后加15%Na2CO3溶液3ml及偶氮试剂3ml,加蒸馏水至10ml混匀,放置10min后于480nm处测其吸光度。
作出标准曲线。
2、样品中组胺的提取:取10.0g左右切碎的鱼肉于具塞锥形瓶中,加入20ml 0.1g/ml三氯乙酸浸泡2—3h过滤小烧杯中,用NaOH跳PH为9—10,取1ml滤液于分液漏斗中,再加入3.0ml正戊醇振摇5min,吸取上层液,重复操作3次,合并上层液于10ml容量瓶,用正戊醇定容至10ml,取1.0ml正戊醇提取液于分液漏斗中提取,再加1mol/LHCl3ml振荡5min,取下层液,重复操作3次,合并下层液于10ml容量瓶中,再用盐酸定容3、取1ml上述提取液于10ml离心管中,分别加入15%Na2CO3及偶氮试剂各3ml,加入至10ml摇匀,放置10min于480nm处测吸光度4、计算:样品中组胺含量(mg/kg)=1000×(A/m)×V六、思考题用正戊醇提取前为什么要调PH为9~10?为什么还要用HCl提取3次?。
高效液相色谱法测定鱼粉中7种生物胺含量杨丽云;刘成模;肖锦永;黄智成;李娟【期刊名称】《中国畜牧兽医》【年(卷),期】2013(40)12【摘要】试验以0.4 mol/L高氯酸溶液为样品提取溶剂,以丹磺酰氯为衍生剂,以乙腈和0.02 mol/L乙酸铵溶液为流动相,采用梯度洗脱,于波长254 nm处紫外检测,同时建立检测鱼粉中7种生物胺的反相高效液相色谱法(RP-HPLC).结果表明,在45 min内各种生物胺得到很好分离,经方法学验证线性关系良好,回收率在85%~105%之间,精密度相对标准偏差(RSD)均小于4%.所建立方法灵敏度高,重现性好,是测定鱼粉中生物胺含量的有效方法.【总页数】4页(P112-115)【作者】杨丽云;刘成模;肖锦永;黄智成;李娟【作者单位】广东恒兴饲料实业股份有限公司,广东湛江524094;广东恒兴饲料实业股份有限公司,广东湛江524094;广东恒兴饲料实业股份有限公司,广东湛江524094;广东恒兴饲料实业股份有限公司,广东湛江524094;广东省农业科学院动物卫生研究所,广东广州 510640【正文语种】中文【中图分类】S816.48【相关文献】1.高效液相色谱法测定市售腐乳中生物胺的含量 [J], 李大伟;李丹丹;梁静静;史瑞琴;马艳莉2.高效液相色谱法测定不同乳制品中生物胺含量的研究 [J], 刘继超;陈历俊;刘硕;乔为仓;史润鸽;姜铁民3.高效液相色谱法测定鱼粉中组胺含量 [J], 梅光明;郭远明;陈雪昌;张小军;朱敬萍;李铁军;龙举4.高效液相色谱串联质谱法测定蜂毒中五种生物胺含量 [J], 张文文;金玥;周金慧5.高效液相色谱法测定黄酒发酵醪液中生物胺含量 [J], 牛天娇; 郭永杰; 孙二娜; 马莺因版权原因,仅展示原文概要,查看原文内容请购买。
鱼粉中的有毒有害物质组胺的HPLC检测方法初探
杨文军;马丹;张丽英;王燕华;王宗义
【期刊名称】《饲料广角》
【年(卷),期】2004(000)004
【摘要】鱼粉和肉骨粉作为优质的动物蛋白饲料原料,被广泛应用在动物生产中。
其质量的好坏通常以粗蛋白、粗脂肪、氨基酸、钙、磷、盐分和灰分等常规指标来衡量。
在卫生指标中主要强调沙门氏菌不得检出。
实际上使用不新鲜、腐败霉变的鱼或肉制品制作的鱼粉或肉骨粉产品.其生物胺含量
【总页数】2页(P28-29)
【作者】杨文军;马丹;张丽英;王燕华;王宗义
【作者单位】农业部饲料工业中心;中国农业大学动物科技学院;云南省饲料监察所;农业部饲料工业中心;中国农业大学动物科技学院;农业部饲料工业中心;中国农业大学动物科技学院;农业部饲料工业中心
【正文语种】中文
【中图分类】S85
【相关文献】
1.鱼粉中组胺的纸电泳简易检测方法 [J], 陶志华;韩雅丽;张宏梅;谭竹钧
2.水产品药物残留及有毒有害物质检测中的质量控制 [J], 林敏
3.鱼粉中组胺含量检测的协作研究——高效液相色谱法 [J], 赵华梅;牟志春;蔡发
4.代谢组学技术在有毒有害物质检测应用中的研究进展 [J], OU Yahong;WANG Xu;WANG Yulian;TAO Yanfei;WANG Yuke;ZHANG Liyun;WANG
Yanxin;PENG Dapeng;XIE Shuyu;HUANG Lingli;PAN Yuanhu;CHEN Dongmei
5.HPLC法检测海水鱼中组胺含量 [J], 孙晶
因版权原因,仅展示原文概要,查看原文内容请购买。
微生物对鱼粉中组胺含量的影响作者:王啸宇徐铭沈思思郭君宁丁小涵李俊成付晚涛来源:《现代农业科技》2020年第11期摘要; ; 我国鱼粉产品质量参差不齐,鱼粉中组胺含量普遍高于国际水平,过高的组胺含量易造成食品安全问题。
为了降低过高的组胺含量对鱼粉品质的影响,本试验通过使用微生物降解鱼粉产品中的组胺。
试验将降解时间与微生物添加比例作为变量,测试出较为适宜微生物降解组胺的条件以及该条件下的实际效果。
结果表明,24 h为较适宜的降解时间,降解时间为24 h时较适宜的微生物添加比例为10∶1。
此时鱼粉组胺含量为1 622 mg/kg,较未加入微生物处理的鱼粉组胺含量(5 298 mg/kg)降低69.38%。
试验结果证明了用微生物降解鱼粉中的组胺具有显著的效果,为鱼粉生产、储存技术的改良提供了参考依据。
关键词; ; 鱼粉;组胺;微生物中图分类号; ; S963.321; ; ; ; 文献标识码; ; A文章编号; ;1007-5739(2020)11-0223-02; ; ; ; ; ; ; ; ; ; 开放科学(资源服务)标识码(OSID)Effect; of; Microorganism; on; Histamine; Content; in; Fish; MealWANG Xiao-yu 1; ; XU Ming 1; ; SHEN Si-si 2; ; GUO Jun-ning 2; ; DING Xiao-han 2; ; LI Jun-cheng 1; ; FU Wan-tao 2,3 *(1 College of Fisheries and Life Science,Dalian Ocean University,Dalian Liaoning 116023;2 School of Marine Sciences and Environment,Dalian Ocean University;3 Liaoning University Key Laboratory of Coastal Marine Environmental Science and Technology)Abstract; ; The quality of fish meal products in China is uneven. The content of histamine in fish meal is generally higher than the international level. Excessively high histamine content can easily cause food safety problems. In order to reduce the effect of excessively high histamine content on the quality of fish meal,this experiment used microorganisms to degrade histamine in fish meal products. In the experiment,the degradation time and the ratio of microorganism addition were taken as variables to test the conditions suitable for the degradation of histamine by microorganisms and the actual effect under the conditions. The results showed that 24 h was the most suitable degradation time,and the most suitable microorganism addition ratio was 10∶1 in the suitable degradation time (24 h). At this time,the histamine content in fish meal was 1 622 mg/kg,which was 69.38% lower than that of fish meal without microbial treatment(5 298 mg/kg). The experimental results proved that the use of microorganisms to degrade histamine in fish meal had a significant effect,which provided references for the improvement of fish meal production and storage technology.Key words; ; fish meal;histamine;microorganism鱼粉是养殖业中主要的动物蛋白来源,目前其普遍生产工艺是将原材料经过蒸煮、压榨、油水分离、烘干以产出产品[1]。
食品快速检验方法犓犑202102水产品中组胺的快速检测2021 01 13发布国家市场监督管理总局发布犓犑202102水产品中组胺的快速检测1 范围本方法规定了水产品中组胺的快速检测方法。
本方法适用于水产品(鱼类等)中组胺的快速测定。
第一法 胶体金免疫层析法2 原理本方法采用竞争抑制免疫层析原理,样品中的组胺经提取(或提取衍生)后与胶体金标记的特异性抗体结合,抑制抗体和检测卡中检测线(T线)上抗原的结合,从而导致检测线颜色深浅的变化。
通过检测线(T线)与控制线(C线)颜色深浅比较,对样品中组胺进行定性判定。
3 试剂与材料除非另有说明,本方法所用试剂均为分析纯,水为GB/T6682规定的二级水。
3.1 试剂3.1.1 无水乙醇(C2H5OH)。
3.1.2 无水四氢呋喃(C4H8O)。
3.1.3 4 硝基苯甲酰氯(C7H4ClNO3)。
3.1.4 三羟甲基氨基甲烷(C4H11NO3),即Tris。
3.1.5 盐酸(HCl,37%)。
3.2 试剂配制3.2.1 70%乙醇溶液(体积分数):量取乙醇(3.1.1)700mL,加水至1000mL,混合均匀。
3.2.2 样品提取液:称取12.1gTris(3.1.4),加950mL70%乙醇(3.2.1)溶解,充分混匀后,用盐酸(3.1.5)调节pH值至8.5,用70%乙醇(3.2.1)定容至1000mL。
或使用胶体金免疫层析检测试剂盒专用提取液。
3.2.3 样品稀释液:称取12.1gTris(3.1.4),加950mL水溶解,充分混匀后用盐酸(3.1.5)调节pH至7.0,用水定容至1000mL。
或使用胶体金免疫层析检测试剂盒专用稀释液。
3.2.4 样品衍生剂(100mg/mL):称取10g4 硝基苯甲酰氯(3.1.3),加90mL无水四氢呋喃(3.1.2)溶解,用无水四氢呋喃(3.1.2)定容至100mL。
或使用胶体金免疫层析检测试剂盒专用衍生剂。
3.3 参考物质组胺参考物质的中文名称、英文名称、CAS号、分子式、相对分子质量见表1,纯度≥97.0%。
实验七鱼粉中组胺含量的测定
1、实验目的:通过本实验,使学生掌握鱼粉中组胺测定方法。
2、基本技能训练内容:了解组胺含量对鱼粉品质评价的意义;鱼粉中组胺测定方法。
3、主要仪器设备和药品:正戊醇、三氯乙酸溶液(100g/L)、碳酸钠溶液(50g/L)、氢氧化钠溶液(250g/L)、盐酸(1+11)、组织胺标准溶液(准确称取0.2767g于100±5℃干燥2h的磷酸组织胺,溶于水,移入100mL 容量瓶中,再加水稀释至刻度。
此溶液每毫升相当于1.0mg组织胺)、磷酸组织胺标准使用液(吸取1.0mL 组织胺标准溶液,置于50mL容量瓶中,加水稀释至刻度。
此溶液每毫升相当于20μg组织胺)、偶氮试剂:甲液(称取0.5g对硝基苯胺,加5mL盐酸溶液溶解后,再加水稀释至200mL,置冰箱中)、乙液(亚硝酸钠溶液(5g/L),临用现配)甲液5mL、乙液40mL混合后立即使用。
4、实验方法:
4.1样品处理
称取5.00~10.00g切碎样品,置于具塞锥形瓶中,加入15~20mL三氯乙酸溶液(100g/L),浸泡2~3h,过滤。
吸取2.0mL滤液,置于分液漏斗中,加氢氧化钠溶液(250g/L)使呈碱性,每次加入3mL正戊醇,振摇5min,提取三次,合并正戊醇并稀释至10.0mL。
吸取2.0mL正戊醇提取液于分液漏斗中,每次加3mL 盐酸(1+11)振摇提取三次,合并盐酸提取液并稀释至10.0mL。
备用。
4.2测定
吸取2.0mL盐酸提取液于10mL比色管中。
另吸取0、0.20、0.40、0.60、0.80、1.0mL组织胺标准使用液(相当于0、4、8、12、16、20μg组织胺),分别置于10mL比色管中,加水至1mL,再各加1mL盐酸(1+11),样品与标准管各加3mL碳酸钠溶液(50g/L),3mL偶氮试剂,加水至刻度,混匀,放置10min 后用1cm比色杯以零管调节零点,于480nm波长处测吸光度,绘制标准曲线比较,或与标准系列目测比较。
4.3计算
式中:X1——样品中组织胺的含量,mg/100g;
V1——加入三氯乙酸溶液(100g/L)的体积,mL;
m1——测定时样品中组织胺的质量,μg;
m2——样品质量,g。
结果的表述:报告算术平均值精确至小数点后一位。
4.4允许差:相对相差≤10%。