第二章热力学第一定律公式总结1
- 格式:ppt
- 大小:127.00 KB
- 文档页数:9


热力学第一定律功:δW =δW e +δW f(1)膨胀功 δW e =p 外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δW f =xdy非膨胀功为广义力乘以广义位移。
如δW (机械功)=fdL ,δW (电功)=EdQ ,δW (表面功)=rdA 。
热 Q :体系吸热为正,放热为负。
热力学第一定律: △U =Q —W 焓 H =U +pV 理想气体的内能和焓只是温度的单值函数。
热容 C =δQ/dT(1)等压热容:C p =δQ p /dT = (∂H/∂T )p (2)等容热容:C v =δQ v /dT = (∂U/∂T )v 常温下单原子分子:C v ,m =C v ,m t =3R/2常温下双原子分子:C v ,m =C v ,m t +C v ,m r =5R/2 等压热容与等容热容之差:(1)任意体系 C p —C v =[p +(∂U/∂V )T ](∂V/∂T )p (2)理想气体 C p —C v =nR 理想气体绝热可逆过程方程:pV γ=常数 TV γ-1=常数 p 1-γT γ=常数 γ=C p / C v 理想气体绝热功:W =C v (T 1—T 2)=11-γ(p 1V 1—p 2V 2) 理想气体多方可逆过程:W =1nR-δ(T 1—T 2) 热机效率:η=212T T T - 冷冻系数:β=-Q 1/W 可逆制冷机冷冻系数:β=121T T T -焦汤系数: μJ -T =H p T ⎪⎪⎭⎫⎝⎛∂∂=-()pT C p H ∂∂ 实际气体的ΔH 和ΔU :ΔU =dT T U V ⎪⎭⎫ ⎝⎛∂∂+dV V U T ⎪⎭⎫ ⎝⎛∂∂ ΔH =dT T H P ⎪⎭⎫⎝⎛∂∂+dp p H T ⎪⎪⎭⎫ ⎝⎛∂∂ 化学反应的等压热效应与等容热效应的关系:Q p =Q V +ΔnRT 当反应进度 ξ=1mol 时, Δr H m =Δr U m +∑BB γRT化学反应热效应与温度的关系:()()()dT B C T H T H 21T T m p B1m r 2m r ⎰∑∆∆,+=γ热力学第二定律Clausius 不等式:0TQS BAB A ≥∆∑→δ—熵函数的定义:dS =δQ R /T Boltzman 熵定理:S =kln Ω Helmbolz 自由能定义:F =U —TS Gibbs 自由能定义:G =H -TS 热力学基本公式:(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:dU =TdS -pdV dH =TdS +Vdp dF =-SdT -pdV dG =-SdT +Vdp (2)Maxwell 关系:T V S ⎪⎭⎫⎝⎛∂∂=VT p ⎪⎭⎫ ⎝⎛∂∂Tp S ⎪⎪⎭⎫ ⎝⎛∂∂=-p T V ⎪⎭⎫ ⎝⎛∂∂ (3)热容与T 、S 、p 、V 的关系:C V =T V T S ⎪⎭⎫ ⎝⎛∂∂ C p =T pT S ⎪⎭⎫⎝⎛∂∂Gibbs 自由能与温度的关系:Gibbs -Helmholtz 公式 ()pT /G ⎥⎦⎤⎢⎣⎡∂∆∂T =-2T H ∆ 单组分体系的两相平衡: (1)Clapeyron 方程式:dT dp=mX m X V T H ∆∆ 式中x 代表vap ,fus ,sub 。



第二章 热力学第一定律主要公式及使用条件1. 1. 热力学第一定律的数学表示式W Q U +=Δ或'amb δδδd δdU Q W Q p V W =+=−+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 2. 焓的定义式pVU H +=3. 3. 焓变(1) )(pV U H Δ+Δ=Δ式中为乘积的增量,只有在恒压下)(pV ΔpV )()(12V V p pV −=Δ在数值上等于体积功。
(2) 2,m 1d p H nC Δ=∫T 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4. 4. 热力学能(又称内能)变此式适用于理想气体单纯pVT 变化的一切过程。
2,m 1d V U nC Δ=∫T5. 5. 恒容热和恒压热(d V Q U =Δ0,'0)V W ==p Q H =Δ(d 0,'0)p W ==6. 6. 热容的定义式(1)定压热容和定容热容δ/d (/)p p C Q T H T p ==∂∂δ/d (/)V V C Q T U T ==∂∂V p V R 3(2)摩尔定压热容和摩尔定容热容,m m /(/)p p C C n H T ==∂∂,m m /(/)V V C C n U T ==∂∂上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。
(3)质量定压热容(比定压热容),m //p p p c C m C M==式中m 和M 分别为物质的质量和摩尔质量。
(4),m ,m p V C C −=此式只适用于理想气体。
(5)摩尔定压热容与温度的关系2,m p C a bT cT dT =+++式中a , b , c 及d 对指定气体皆为常数。
(6)平均摩尔定压热容21,m ,m 21d /()T p p T C T T T C =−∫7. 7. 摩尔蒸发焓与温度的关系21v ap m 2vap m 1v ap ,m ()()d T p T H T H T C T Δ=Δ+Δ∫或 vap m vap ,m (/)p p H T ∂Δ∂=ΔC d amb ∑−=−−=−−=式中 = C (g) —C (l),上式适用于恒压蒸发过程。

热力学公式总结
一、热力学第一定律
热力学第一定律,也被称为能量守恒定律,表明在一个封闭系统中,能量不能被创造或毁灭,只能从一种形式转化为另一种形式。
公式如下:
ΔU = Q + W
其中,ΔU表示系统内能的改变,Q表示系统吸收或释放的热量,W表示系统对外界所做的功。
二、热力学第二定律
热力学第二定律表明,热量不能自发地从低温物体传递到高温物体,而不引起其他变化。
公式如下:
dS/dt ≥ 0
其中,S表示系统的熵,dS/dt表示熵的变化率。
如果dS/dt大于0,则表
示熵增加,如果dS/dt等于0,则表示熵不变。
三、理想气体状态方程
理想气体状态方程表示理想气体的压力、体积和温度之间的关系。
公式如下:PV = nRT
其中,P表示气体的压力,V表示气体的体积,n表示气体的摩尔数,R表
示气体常数,T表示气体的温度(以开尔文为单位)。
四、热力学第三定律
热力学第三定律表明,绝对零度不能通过有限的降温过程达到。
公式如下:ΔS(T→0) = 0
其中,ΔS表示系统熵的变化,T表示温度。
这个公式表明在绝对零度时,
系统的熵为零。


热一定律总结一、 通用公式ΔU = Q + W绝热: Q = 0,ΔU = W 恒容W ’=0:W = 0,ΔU = Q V恒压W ’=0:W =-p ΔV =-ΔpV ,ΔU = Q -ΔpV ΔH = Q p 恒容+绝热W ’=0 :ΔU = 0 恒压+绝热W ’=0 :ΔH = 0焓的定义式:H = U + pV ΔH = ΔU + ΔpV典型例题:思考题第3题,第4题;二、 理想气体的单纯pVT 变化恒温:ΔU = ΔH = 0变温: 或或如恒容,ΔU = Q ,否则不一定相等;如恒压,ΔH = Q ,否则不一定相等;C p , m – C V , m = R双原子理想气体:C p , m = 7R /2, C V , m = 5R /2 单原子理想气体:C p , m = 5R /2, C V , m = 3R /2典型例题:思考题第2,3,4题书、三、 凝聚态物质的ΔU 和ΔH 只和温度有关或 典型例题:书四、可逆相变一定温度T 和对应的p 下的相变,是恒压过程ΔU ≈ ΔH –ΔnRTΔn :气体摩尔数的变化量;如凝聚态物质之间相变,如熔化、凝固、转晶等,则Δn = 0,ΔU ≈ ΔH ;ΔU = n C V, m d T T 2T1 ∫ ΔH = n C p, md T T2 T1∫ ΔU = nC V, m T 2-T 1 ΔH = nC p, m T 2-T 1ΔU ≈ ΔH = n C p, m d TT 2T 1∫ΔU ≈ ΔH = nC p, m T 2-T 1ΔH = Q p = n Δ H m α βkPa 及其对应温度下的相变可以查表; 其它温度下的相变要设计状态函数不管是理想气体或凝聚态物质,ΔH 1和ΔH 3均仅为温度的函数,可以直接用C p,m 计算;或典型例题:作业题第3题 五、化学反应焓的计算其他温度:状态函数法ΔU 和ΔH 的关系:ΔU = ΔH –ΔnRT Δn :气体摩尔数的变化量;典型例题:思考题第2题典型例题:见本总结“十、状态函数法;典型例题第3题” 六、体积功的计算通式:δW = -p amb ·d V恒外压:W = -p amb ·V 2-V 1Δ H m T = ΔH 1 +Δ H m T 0 + ΔH 3α ββα Δ H m TαβΔH 1ΔH 3Δ H m T 0α β可逆相变K:ΔH = nC p, m T 2-T 1ΔH = n C p, m d T T 2T1∫恒温可逆可逆说明p amb = p :W = nRT ·ln p 2/p 1 = -nRT ·ln V 2/V 1 绝热可逆:pV γ= 常数γ = C p , m /C V , m ; 利用此式求出末态温度T 2,则W =ΔU = nC V , m T 2 – T 1或:W = p 2V 2 – p 1V 1/ γ–1典型例题: 书,作业第1题 七、p -V 图斜率大小:绝热可逆线 > 恒温线 典型例题:如图,A→B 和A→C 均为理想气体变化过程,若 B 、C 在同一条绝热线上,那么U AB 与U AC 的关系是: A U AB > U AC ; B U AB < U AC ; C U AB =U AC ; D 无法比较两者大小;八、可逆过程可逆膨胀,系统对环境做最大功因为膨胀意味着p amb ≤ p ,可逆时p amb 取到最大值p ;可逆压缩,环境对系统做最小功; 典型例题:1 mol 理想气体等温313 K 膨胀过程中从热源吸热600 J,所做的功仅是变到相同终态时最大功的1/10,则气体膨胀至终态时,体积是原来的___倍;九、求火焰最高温度: Q p = 0, ΔH = 0求爆炸最高温度、最高压力:Q V = 0, W = 0 ΔU = 0 典型例题:见本总结“十、状态函数法;典型例题第3题” 十、状态函数法重要设计途径计算系统由始态到终态,状态函数的变化量; 典型例题:1、 将及Θ的水汽100 dm 3,可逆恒温压缩到10 dm 3,试计算此过程的W,Q 和ΔU ;2、 1mol 理想气体由2atm 、10L 时恒容升温,使压力到20 atm;再恒压压缩至体积为1L;求整个过程的W 、Q 、ΔU 和ΔH ;3、 298K 时,1 mol H 2g 在10 mol O 2g 中燃烧H 2g + 10O 2g = H 2Og + g恒容过程恒压过程p 恒温过程绝热可逆过程p V已知水蒸气的生成热Δr H m H2O, g = kJ·mol-1, C p,m H2 = C p,m O2 = J·K-1·mol-1,C p,m H2O = J·K-1·mol-1.a)求298 K时燃烧反应的Δc U m;b)求498 K时燃烧反应的Δc H m;c)若反应起始温度为298 K,求在一个密封氧弹中绝热爆炸的最高温度;十、了解节流膨胀的过程并了解节流膨胀是绝热、恒焓过程典型例题:1、理想气体经过节流膨胀后,热力学能____升高,降低,不变2、非理想气体的节流膨胀过程中,下列哪一种描述是正确的:A Q = 0,H = 0,p < 0 ;B Q = 0,H < 0,p < 0 ;C Q > 0,H = 0,p < 0 ;D Q < 0,H = 0,p < 0 ;十一、其他重要概念如系统与环境,状态函数,平衡态,生成焓,燃烧焓,可逆过程等,无法一一列举典型例题:1、书2、体系内热力学能变化为零的过程有:A 等温等压下的可逆相变过程B 理想气体的绝热膨胀过程C 不同理想气体在等温等压下的混合过程D 恒容绝热体系的任何过程十二、本章重要英语单词system 系统surroundings 环境state function 状态函数equilibrium 平衡态open/closed/isolated system 开放/封闭/隔离系统work 功heat 热energy 能量expansion/non-expansion work 体积功/非体积功free expansion 自由膨胀vacuum 真空thermodynamic energy/internal energy 热力学/内能perpetual motion machine 永动机The First Law of Thermodynamics热力学第一定律heat supplied at constant volume/pressure 恒容热/恒压热adiabatic 绝热的diathermic 导热的exothermic/endothermic 放热的/吸热的isothermal 等温的isobaric 等压的heat capacity 热容heat capacity at constant volume/pressure 定容热容/定压热容enthalpy 焓condensed matter 凝聚态物质phase change 相变sublimation 升华vaporization 蒸发fusion 熔化reaction/formation/combustion enthalpy反应焓/生成焓/燃烧焓extent of reaction 反应进度Kirchhoff’s Law 基希霍夫公式reversible process 可逆过程Joule-Thomson expansion 焦耳-汤姆逊膨胀/节流膨胀isenthalpic 恒焓的。


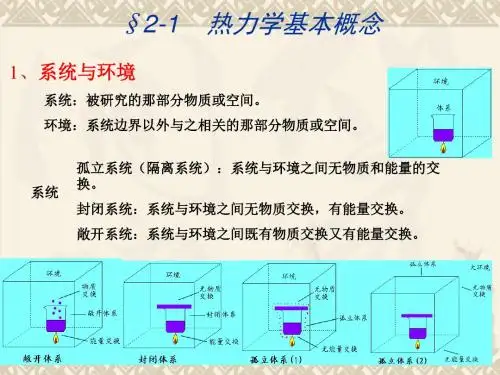
第二章 热力学第一定律2.3热力学基本概念 1.系统:● 隔离系统:没有物质或能量的交换 ● 封闭系统:有能量交换● 敞开系统:有能量或物质的交换 2.热力学平衡态:(当系统的各种性质不随时间而改变,则系统就处于热力学平衡状态)热力学必须同时满足的条件平衡:热动平衡、力学平衡、相平衡、化学平衡。
2.3.1状态函数(当系统的状态发生变化时,它的一系列性质也随之变化,改变的多少取决于始态和终态)【异途同归,值变相等;周而复始,数值还原】 《m 、T 、、P 、V 、浓度、黏度、折光率、热力学能、焓、熵》 2.3.2 状态方程(),ν=T f p 与系统性质有关的函数2.3.3 过程和途径2.3.3.1 常见的变化过程有:● 等温过程:只有始终态温度不变● 恒温过程:在过程中温度一直持续不变 ● 等压过程:始终态压力相等且等于环境温度● 等容过程:系统变化过程中体积不变(刚性容器)● 绝热过程:系统与环境没有热交换(爆炸、快速燃烧)Q=0 ● 环状过程:系统经一系列变化又回到了原来的状态d 0∮ν= 、d 0∮=p 、d 0∮=U 、d 0∮=T状态函数的变化值仅取决于系统的始终态,而与中间具体的变化无关。
过程函数的特点:只有系统发生一个变化时才有过程函数 过程函数不仅与始终态有关还与途径有关没有全微分,只有微小量。
用δQ 、δw 表示环积分不一定为0 (不一定0∮δ=Q )2.3.4 热和功热的本质是分子无规则运动强度的一种体现,系统内部的能量交换不可能是热。
功和热都不是状态函数,其值与过程无关。
2.4热力学第一定律热力学能是指系统内分子运动的平动能、转动能、振动能、电子及核的能量,以及分子与分子之间相互作用的位能等能量的总和。
文字表述:第一类永动机是不可能造成的(既不靠外界提供能量,本身也不减少能量,却可以不断对外做功的机器称为第一类永动机)能量总量在转化过程中保持不变 系统热力学能的变化是:21∆=-=+U U U Q W系统发生微小变化,热力学能的变化d U 为:d δδ=+U Q W (状态函数)对于物质的量为定值的封闭系统,则微小变量的热力学能变化可以表示为:d d d ν⎛⎫∂∂⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭p TU U T p T p 2.5准静态过程与可逆过程2.5.1功与过程系统做的膨胀功为:e e d δ=-=-W F dl p V膨胀功分为 :✧ 自由膨胀(向真空膨胀)<W=0>:外压e p 为零的膨胀过程,由于e p =0所以,,10δ=e W ,系统对外不做功。
第二章 主要公式及适用条件热力学第一定律dU = δQ + δW 或 ∆U = Q + W一.体积功WdV p W amb -=⎰或 dV p W amb -=δ 适用于任何系统、任何过程的体积功的计算。
1.自由膨胀过程(向真空膨胀): W = 02.恒外压过程: )(12V V p W amb --=3.恒容过程:4. 恒压过程: )(12V V p W --= 一定量理想气体恒压过程 T nR W ∆-=5.一定量理想气体恒温可逆过程:1221ln ln p p nRT V V nRT W ==6.一定量理想气体绝热可逆过程W = ΔU = n C v.m (T 2-T 1) 或)11(1111211----=γγγγV V V p W(其中 γ = C p.m / C v.m 称为绝热指数 也称热容商。
)7.恒温恒压相变过程: W = - p (V β-V α )若β相为理想气体: W = - p V g = -nRT8.恒温恒压化学反应;且气体视为理想气体W = - R T(g ) (式中为反应计量系数,反应物为“-”,产物为“+”。
)二.热容热容定义 C = Q / ΔT = δQ / d TC v. m = δQ v / d T = (әU m / әT )vC p. m =δQ p / d T = (әH m /әT )p对理想气体 C p.m – C v.m = R单原子分子 C v.m = 3R /2 , C p.m = 5R / 2双原子分子 C v.m = 5R/2, C p.m =7R /2多原子分子 C v.m = 3 R , C p.m = 4 R三. 热1.封闭体系无非体积功恒容变温过程:dT nC Q T T m V V ⎰=21, 若常数=m V C ,,则)(12,T T nC Q m V V -=2.封闭体系无非体积功恒压变温过程: dT nC Q T T m p V ⎰=21,若常数=m p C ,,则)(12,T T nC Q m p p -=3.绝热过程及理想气体自由膨胀过程:Q = 04.恒温恒压无非体积功的相变过程:Q p = n ΔH m5.恒温恒压与恒温恒容化学反应 Q p 与Q v 关系:Q p –Q v = Δr H – Δr U = R T Δn或Q p.m –Q v.m = Δr H m – Δr U m = R T四.热力学能(内能):ΔU = Q + W1.一定量理想气体恒温过程或隔离体系任何过程 ΔU = 02.封闭体系无非体积功恒容变化或一定量理想气体任何过程dT nC U T T m V ⎰=∆21, 3.绝热过程:ΔU = W (Q =0)五.焓:定义: H = U + p V1. 封闭体系任何过程ΔH = ΔU + Δ(p V ) = ΔU + (p 2V 2 – p 2V 2 )2.封闭体系无非体积功的恒压变化或一定量理想气体任何状态变化过程dT nC H T T m p ⎰=∆21, 3.一定量理想气体恒温、实际气体节流膨胀及恒压无非体积功的绝热化学反应过程 ΔH = 0 。
热力学第一定律主要公式1.∆U 和∆H 的计算 对封闭系统的任何过程 ∆U=Q+W2111()H U p V pV ∆=∆--(1) 简单状态变化过程 1) 理想气体 等温过程0T U ∆= 0T H ∆=任意变温过程,21()V m U nC T T ∆=-,21()p m H nC T T ∆=-等容变温过程 H U V p ∆=∆+∆ (V U Q ∆=) 等压变温过程 p U Q p V ∆=-∆ ()p H Q ∆=绝热过程,21()V m U W nC T T ∆==- ,21()p m H nC T T ∆=-2)实际气体van derWaals 气体等温过程 21211U na V V ⎛⎫⎪ ⎪⎝⎭∆=-222111211()H U pV na p V pV V V ⎛⎫⎪ ⎪⎝⎭∆=∆+∆=-+-(2) 相变过程等温等压相变过程 p tra H Q ∆= (pQ 为相变潜热)p tra tra U Q p V ∆=-∆(3)无其他功的化学变化过程绝热等容反应 0r U ∆=绝热等压反应 0r H ∆=等温等压反应r p H Q ∆= r r U H p V ∆=∆-∆等温等压凝聚相反应r r U H ∆≈∆等温等压理想气体相反应()r r U H n RT ∆=∆-∆或 r r B BH U RT ν∆=∆-∑由生成焓计算反应热效应 f ()(,)r m m B BH T H T B θθν∆=∆∑由燃烧焓计算反应热效应 c ()(,)r m m B BH T H T B θν∆=-∆∑由键焓估算反应热效应,,()(,(i m i i m i iiH T n H T n H ∆=∆∆∑∑反应物)-生成物)式中:i n 为i 种键的个数;n i为i 种键的键焓。
不同温度下反应热效应计算 2121()()d T r m r m r p T H T H T C T ∆=∆+∆⎰2.体积功W 的计算 任意变化过程 W= d e p V -∑任意可逆过程21W= d VV p V -⎰自由膨胀和恒容过程 W=0 恒外压过程 21()e Wp V V =--等温等压→l g 相变过程(设蒸气为理想气体)1()g g g W p V V pV n RT =--≈-=-等温等压化学变化 ()W p Vn RT =-∆=∆ (理想气体反应)0W ≈ (凝聚相反应)理想气体等温可逆过程2112ln ln V p W nRT nRT V p =-=-理想气体绝热过程,212122111()()()11V m nR W U nC T T T T p V pV γγ=∆=-=-=--- 理想气体多方可逆过程2122111()()11nR W T T p V pV δδ=-=---van der Waals 气体等温可逆过程2212112ln()V nb W nRT n a V nb V V -=----3.Q 的计算(1)简单状态变化过程 等压变温过程 等压变温过程(2) 等温等压相变过程 Joule-Thomson 系数-J Tμ-J T HT p μ∂⎛⎫= ⎪∂⎝⎭-11J T p p p T H V T V p T C C μ⎡⎤∂∂⎛⎫⎛⎫=-=- ⎪⎢⎥ ⎪∂∂⎝⎭⎝⎭⎣⎦表示节流膨胀后温度升高。
第二章热力学第一定律基本公式功: δW = -P外dV热力学第一定律: dU =δQ + δW ΔU = Q + W焓的定义: H ≡ U + PV热容的定义: C=limΔT→0δQ/ ΔT等压热容的定义: C P =δQ P /dT =(∂H/∂T)P等容热容的定义: C V =δQ V /dT =(∂U/∂T)V任意体系的等压热容与等容热容之差: C P - C V = [P + (∂U/∂V)T] (∂V/∂T)P 理想气体的等压热容与等容热容之差: C P - C V = nR理想气体绝热可逆过程方程: γ = C P / C VPVγ-1 =常数T Vγ-1 =常数P1-γTγ=常数理想气体绝热功: W =C V(T1 – T2 ) W = P1V1 – P2V2 /γ-1热机效率: η = W/Q2可逆热机效率: η = T2 – T1 / T2冷冻系数: β= Q1′/W可逆制冷机冷冻系数: β = T1 / T2 – T1焦汤系数: μ = ( ∂T/ ∂P)H = - (∂H/∂P)/C P反应进度: ξ= n B – n B0 / νB化学反应的等压热效应与等容热效应的关系: Q P = Q V + ΔnRT当反应进度ξ= 1 mol 时Δr H m= Δr U m +ΣBνB RT化学反应等压热效应的几种计算方法:Δr H m⊖=ΣBνBΔf H m⊖(B)Δr H m⊖=ΣB (єB )反应物 - ΣB(єB )产物Δr H m⊖= -ΣBνBΔC H m⊖(B)反应热与温度的关系: Δr H m(T2) =Δr H m(T1) + ∫21T TΔr C P dT表 1-1 一些基本过程的W 、Q、△U 、△H 的运算过程W Q △U △H 理想气体自由膨胀0 0 0 0 理想气体等温可逆 -nRTLnV2/V1 -nRTLnV2/V10 0任意物质等容可逆理想气体0∫C V dT∫C V dTQ v∫C V dT△U + V△P∫C P dT任意物质等压可逆理想气体-P外△V-P外△V∫C P dT∫C p dTQ P - P△V∫C V dTQ P∫C P dT理想气体绝热过程C V(T2 – T1)1/γ-1(P2V2-P1V1) 0 ∫C V dT ∫C P dT理想气体多方可逆过程PVδ=常数n R/1-δ(T2-T1) △U + W ∫C V dT ∫C P dT 可逆相变(等温等压) -P外△V Q P Q P -W Q P化学反应(等温等压) -P外△VQ PQ P – WΔr H m=Δr U m+ΣBνB RTQ PΔr H m⊖=ΣBνBΔf H m⊖(B) 例题例1 0.02Kg 乙醇在其沸点时蒸发为气体。
物化公式归纳 第一章 化学热力学基础 公式总结1.体积功 We = -Pe △V2.热力学第一定律的数学表达式 △U = Q + W 3.n mol 理想气体的定温膨胀过程.定温可逆时:Wmax=-Wmin=4.焓定义式 H = U + PV 在封闭体系中,W ′= 0,体系发生一定容过程 Qv = △U在封闭体系中,W ′= 0,体系发生一定压过程 Qp = H2 – H1 = △H5.摩尔热容 Cm ( J·K -1·mol -1 ):定容热容 CV(适用条件 :封闭体系、无相变、无化学变化、 W ′=0 定容过程适用对象 : 任意的气体、液体、固体物质 )定压热容 Cp⎰=∆21,T T m p dTnC H (适用条件 :封闭体系、无相变、无化学变化、 W ′=0 的定压过程适用对象 : 任意的气体、液体、固体物质 )单原子理想气体: Cv,m = 1.5R , Cp,m = 2.5R 双原子理想气体: Cv,m = 2.5R , Cp,m = 3.5R 多原子理想气体: Cv,m = 3R , Cp,m = 4RCp,m = Cv,m + R6.理想气体热力学过程ΔU 、ΔH 、Q 、W 和ΔS 的总结7.定义:△fHm θ(kJ·mol -1)-- 标准摩尔生成焓△H —焓变; △rHm —反应的摩尔焓变 △rHm θ—298K 时反应的标准摩尔焓变;△fHm θ(B)—298K 时物质B 的标准摩尔生成焓; △cHm θ(B) —298K 时物质B 的标准摩尔燃烧焓。
1221ln ln P PnRT V V nRT =⎰=∆21,T T m V dTnC U8.热效应的计算由物质的标准摩尔生成焓计算反应的标准摩尔焓变 △rH θm = ∑νB △fH θm ,B 由物质的标准摩尔燃烧焓计算反应的标准摩尔焓变 △rH θm = -∑νB △cH θm ,B 9.Kirchhoff (基尔霍夫) 方程 △rHm (T2) = △rHm (T1) + 如果 ΔCp 为常数,则△rHm (T2) = △rHm (T1) + △Cp ( T2 - T1) 10.热机的效率为 对于卡诺热机= 可逆循环过程 < 不可逆循环过程 11.熵变定义式 (体系经历一可逆过程的热温商之和等于该过程的熵变.) 12.热力学第二定律的数学表达式(不等式中, “ > ”号表示不可逆过程 , “ = ” 号表示可逆过程“ T ”—环境温度 , 对可逆过程也是体系温度. )13.熵增原理 (孤立体系的熵永不减少) △S 孤立 ≥ 0 > 不可逆过程, 自发过程 = 可逆过程, 体系达平衡 .对于封闭体系△S 孤立 = △S 封闭 + △S 环境 ≥ 0 > 不可逆过程, 自发过程 = 可逆过程, 体系达平衡 14.定温定压的可逆相变15.化学反应熵变的计算 △rS θm = ∑νBS θm ,B16.△rH θm 和△rS θm 与温度的关系:△rH θ m (T2) = △rH θ m (T1) +△rS θ m (T2) = △rS θ m (T1) +第二章 自由能、化学势和溶液 公式1.第一和第二定律的联合公式为 2.吉布斯自由能定义式 G = U + PV – TS = H – TS △G = △H -T △S(G----体系的状态函数, ( J ) , 绝对值无法测量 ) 3.在定温定压下,有如下关系: ΔG=W’最大2211≤+T Q T Q ∑≥∆ii i T Q S )(δ环体环环环境T Q T Q S -==∆dTC p T T ⎰∆21d TTC pT T ∆⎰214.吉布斯自由能判据< 不可逆过程, 自发过程 = 可逆过程, 平衡态> 反方向为自发过程5.判断过程方向及平衡条件的总结6定压下.对任意相变或化学变化7.定温物理变化?G的计算(W’=0的封闭体系). 理想气体定温过程. 纯液体或纯固体的定温过程. 定温定压可逆相变 dG = -SdT + VdP dT =0 dP =0 ?G T , P, W' = 0 。