高一化学化学反应热的计算共20页
- 格式:ppt
- 大小:2.09 MB
- 文档页数:20

反应热计算公式(1)ΔH=反应物总键能之和-生成物总键能之和。
(2)ΔH=生成物总能量-反应物总能量=H(生成物)-H(反应物)。
(3)ΔH=正反应活化能-逆反应活化能。
公式1 ΔH=反应物总键能之和-生成物总键能之和。
例1、(2021·浙江选考)已知共价键的键能与热化学方程式信息如下表:则2O(g)=O2(g)的ΔH为()A.428 kJ·mol-1 B.-428 kJ·mol-1C.498 kJ·mol-1 D.-498 kJ·mol-1解析:解析:选D由热化学方程式可知,2×(H—H)+(O—O)-4×(H—O)=-482 kJ·mol-1,代入数据解得,O—O=498 kJ·mol-1,形成化学键放出能量,故D正确公式2、ΔH=生成物总能量-反应物总能量=H(生成物)-H(反应物)。
解析:选A酸根离子对应的酸越弱,结合氢离子能力越强,E对应的是高氯酸根离子,高氯酸是最强的无机酸,酸根离子结合氢离子能力最弱,故A错误;能量越低越稳定,A最稳定,故B正确;ΔH=生成物的总能量-反应物的总能量=64+60-2×100=-76 kJ·mol-1,故C正确;3ClO-(aq)===2Cl-(aq)+ClO3-(aq)的ΔH=生成物的总能量-反应物的总能量=反应物的键能之和-生成物的键能之和=0+64-3×60=-116 kJ·mol-1,B→A+D的反应为放热反应,故D正确。
公式3、ΔH=正反应活化能-逆反应活化能。
例3、由N2O和NO反应生成N2和NO2的能量变化如图所示。
根据图示可知,反应N2O(g)+NO(g)=N2(g)+NO2(g)的反应热为____________解析:ΔH=正反应活化能-逆反应活化能。
ΔH=209kJ·mol-1-348kJ·mol-1=-139 kJ·mol-1。

反应热△h计算公式高一英文回答:The formula to calculate the heat of reaction, ΔH, isΔH = Σ(nΔHf(products)) Σ(nΔHf(reactants)), where ΔHfis the standard enthalpy of formation and n is the stoichiometric coefficient of each species.Let me explain this formula in simpler terms. The heatof reaction is the energy change that occurs during a chemical reaction. It tells us whether a reaction is exothermic (releases heat) or endothermic (absorbs heat).To calculate ΔH, we need to consider the enthalpy of formation of the reactants and products. The enthalpy of formation is the energy change that occurs when one mole of a substance is formed from its elements in their standard states. It is usually given in kilojoules per mole (kJ/mol).The stoichiometric coefficients, n, in the formularepresent the number of moles of each species involved in the reaction. By multiplying the enthalpy of formation by the stoichiometric coefficient for each species and summing them up for the reactants and products separately, we can determine the overall heat of reaction.Let's take an example to illustrate this. Consider the reaction: 2H2(g) + O2(g) -> 2H2O(g). We want to calculate the heat of reaction, ΔH.First, we need to know the enthalpy of formation for each species involved. Let's say the enthalpy of formation of H2(g) is -286 kJ/mol, O2(g) is 0 kJ/mol, and H2O(g) is -242 kJ/mol.Using the formula, we have: ΔH = (2 -242 kJ/mol) (2 -286 kJ/mol) = -484 kJ/mol + 572 kJ/mol = 88 kJ/mol.In this case, the heat of reaction is positive, indicating that the reaction is endothermic. It absorbs 88 kJ of heat for every mole of reaction.中文回答:反应热△H的计算公式为△H = Σ(nΔHf(产物)) Σ(nΔHf(反应物)),其中ΔHf代表标准生成焓,n代表每个物质的化学计量系数。

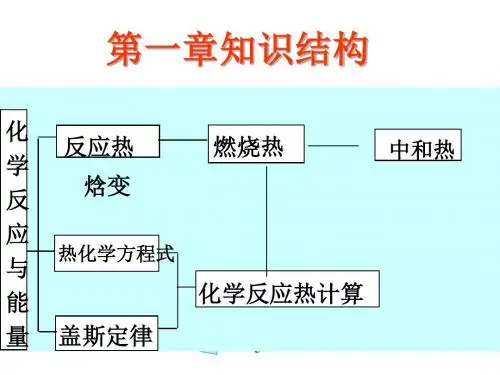




化学反应热的计算
(一)根据热化学方程式计算:若题目给出了相应的热化学方程式,其计算方法与根据一般方程式相似,可以把δh看成方程式内的一项进行处理,反应热与反应物中各物质的物质的量成正比;若没有给出热化学方程式,则根据条件先写出热化学方程式,再计算反应热。
(二)根据反应物和生成物的能量计算:△h=生成物总能量-反应物总能量。
(三)根据燃烧热排序反应热:q(摆)=n(可燃物)×|δh|。
(四)根据反应物和生成物的键能计算:δh=∑e(反应物)-∑e(生成物),即反应热等于反应物的键能总和跟生成物的键能总和之差。
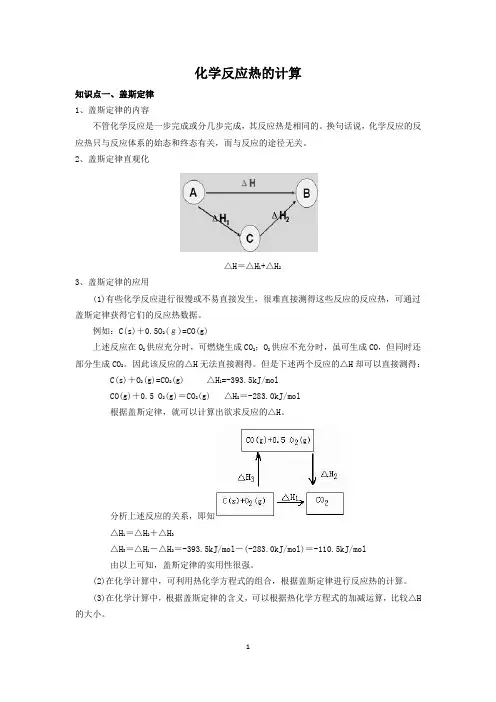
化学反应热的计算知识点一、盖斯定律1、盖斯定律的内容不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说,化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
2、盖斯定律直观化△H=△H1+△H23、盖斯定律的应用(1)有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
例如:C(s)+0.5O2(g)=CO(g)上述反应在O2供应充分时,可燃烧生成CO2;O2供应不充分时,虽可生成CO,但同时还部分生成CO2。
因此该反应的△H无法直接测得。
但是下述两个反应的△H却可以直接测得:C(s)+O2(g)=CO2(g) △H1=-393.5kJ/molCO(g)+0.5 O2(g)=CO2(g) △H2=-283.0kJ/mol根据盖斯定律,就可以计算出欲求反应的△H。
分析上述反应的关系,即知△H1=△H2+△H3△H3=△H1-△H2=-393.5kJ/mol-(-283.0kJ/mol)=-110.5kJ/mol由以上可知,盖斯定律的实用性很强。
(2)在化学计算中,可利用热化学方程式的组合,根据盖斯定律进行反应热的计算。
(3)在化学计算中,根据盖斯定律的含义,可以根据热化学方程式的加减运算,比较△H 的大小。
知识点二、反应热的计算根据热化学方程式、盖斯定律和燃烧热的数据,可以计算一些反应的反应热。
反应热、燃烧热的简单计算都是以它们的定义为基础的,只要掌握了它们的定义的内涵,注意单位的转化即可。
热化学方程式的简单计算的依据:(1)热化学方程式中化学计量数之比等于各物质的物质的量之比,还等于反应热之比。
(2)热化学方程式之间可以进行加减运算。
知识点三、有关反应热的计算依据归纳1、根据实验测得热量的数据求算反应热的定义表明:反应热是指化学反应过程中放出或吸收的热量,可以通过实验直接测定。
2、根据物质能量的变化求算根据能量守恒,反应热等于生成物具有的总能量与反应物具有的总能量的差值。

反应热的计算一、根据比例关系计算ΔH热化学方程式的简单计算的依据:⑴热化学方程式中化学计量数之比等于各物质物质的量之比;还等于反应热之比。
⑵热化学方程式之间可以进行加减运算。
〖例1〗 已知CH 4(g)+2O 2(g)=CO 2(g)+2H 2O(l) ΔH=-890.3kJ/mol ,现有CH 4和CO 的混合气体共0.75mol ,完全燃烧后,生成CO 2气体和18g 液态水,并放出515.65kJ 热量,则CO 燃烧的热化学方程式是 ( )①2CO(g)+O 2(g)=2CO 2(g) ΔH =-564kJ/mol②CO(g)+1/2O 2(g)=CO 2(g) ΔH =-282kJ/mol③CO(g)+1/2O 2(g)=CO 2(g) ΔH =+374.4kJ/mol④2CO 2(g)=2CO(g)+ O 2(g) ΔH =+1406.2kJ/molA.①②B. ①③C.②④D.③④二、根据化学键能计算ΔH化学反应过程是旧键断裂和新键形成的过程,反应物分子间化学键断裂成原子时,需克服化学键吸收能量,原子结合成生成物分子时,形成新化学键放出能量。
通常把拆开或破坏1 mol 某化学键所吸收或放出的能量看成该化学键的键能。
键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH ),化学反应的ΔH 等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
∆H =E(断键总吸能)- E(成键总释能)〖例2〗已知 ①1 mol H 2分子中化学键断裂时需要吸收436 kJ 的能量;②1 mol Cl 2分子中化学键断裂时需要吸收243 kJ 的能量;③由H 原子和Cl 原子形成1 mol HCl 分子时释放431 kJ 的能量。
下列叙述正确的是( )A .氢气和氯气反应生成氯化氢气体的热化学方程式是 H 2(g)+Cl 2(g) = 2HCl(g)B .氢气和氯气反应生成2 mol 氯化氢气体,反应的∆H = 183 kJ/molC .氢气和氯气反应生成2 mol 氯化氢气体,反应的∆H =-183 kJ/molD .氢气和氯气反应生成1 mol 氯化氢气体,反应的∆H =-183 kJ/mol三、根据盖斯定律计算ΔH盖斯定律:不管化学反应是一步完成或分几步完成,其反应热相同。

13化学反应热的计算解析化学反应热是指在进行化学反应时产生或吸收的热量,是一个重要的热力学概念。
化学反应热的计算可以帮助我们了解反应的放热或吸热程度,从而预测反应的方向或速率。
在进行化学反应热的计算时,通常使用反应焓变来表示反应热量的变化。
反应焓变是化学反应过程中,反应物和生成物之间焓的变化量。
化学反应的热量可以通过以下两种方式进行计算:1. 通过反应焓变的计算:反应焓变可以通过反应物和生成物之间的焓差来计算。
反应焓变的公式可以表示为ΔH = ΣH(生成物) - ΣH(反应物)。
其中ΔH表示反应焓变,ΣH(生成物)表示生成物的总焓,ΣH(反应物)表示反应物的总焓。
反应焓变的单位通常为焦耳/mol或千焦/mol。
2.通过热量平衡方程进行计算:热量平衡方程可以用来计算化学反应的热量。
热量平衡方程表示为Σq=0,其中Σq为反应物和生成物之间吸热和放热的总和。
通过热量平衡方程可以计算出反应的热量变化。
在进行化学反应热的计算时,需要注意以下几点:1.反应物和生成物的热化学性质需要事先确定:在进行反应焓变计算时,需要确保反应物和生成物的热化学性质是准确的。
通常可以通过实验方法或文献数据来获取反应物和生成物的热化学性质。
2.反应物和生成物的物质量需要明确:在计算反应焓变时,需要明确反应物和生成物的物质量,以便正确计算反应的热量变化。
3.考虑反应的放热或吸热性质:在计算反应焓变时,需要考虑反应是放热还是吸热的性质。
放热反应ΔH为负值,吸热反应ΔH为正值。
综上所述,化学反应热的计算是一个重要的热力学问题,可以通过反应焓变或热量平衡方程来计算。
在进行化学反应热的计算时,需要注意反应物和生成物的热化学性质、物质量和反应的放热或吸热性质。
通过正确计算反应热,我们可以更好地了解化学反应的热力学性质,为实验设计和反应优化提供参考。