初三化学三角关系化学方程式及反应类型总结
- 格式:doc
- 大小:238.50 KB
- 文档页数:2

化学三角转化关系一、酸碱中的中和反应酸碱中的中和反应是一种常见的化学转化关系。
当酸和碱混合时,产生盐和水的反应称为中和反应。
例如,将盐酸和氢氧化钠混合,会生成氯化钠和水。
这个反应过程中,酸和碱分别失去了H+离子和OH-离子,生成了水分子。
这种反应在我们日常生活中很常见,比如当我们喝柠檬汁时,柠檬汁中的酸会与口腔中的碱性物质中和,产生水和盐。
二、氧化还原反应氧化还原反应是化学反应中的重要类型之一。
在氧化还原反应中,物质中的原子氧化态和还原态发生变化,同时伴随着电子的转移。
例如,金属与非金属氧化物反应生成盐的过程中,金属原子失去电子变成阳离子,非金属氧化物原子得到电子变成阴离子。
这种反应在燃烧、腐蚀等过程中都有应用。
例如,当铁与氧气反应时,铁原子氧化成铁离子,氧气还原成氧离子,生成了氧化铁。
三、酯化反应酯化反应是一种酸催化的化学反应,常用于合成酯。
酯是一类含有酯基的有机化合物,其分子中含有羰基和氧原子。
酯化反应一般是酸催化的醇和酸反应生成酯和水。
例如,乙醇和乙酸反应生成乙酸乙酯和水。
酯化反应在食品、香料、涂料等领域有广泛的应用。
比如,水果中的香味主要来自于酯类物质。
四、聚合反应聚合反应是一种将小分子单体通过共价键连接起来形成高分子化合物的反应。
在聚合反应中,单体分子中的双键或三键被打开,形成新的共价键,从而形成高分子链。
例如,乙烯分子经过聚合反应可以形成聚乙烯链。
聚合反应在合成塑料、纤维等材料中起着重要作用。
五、水解反应水解反应是一种化合物与水反应生成两个或多个新的化合物的反应。
在水解反应中,水分子中的氢离子和水解物中的某个原子或基团发生置换,生成新的化合物。
例如,脂肪酸与水反应生成酸和醇。
水解反应在生物体内的消化过程中起着重要作用。
通过以上几种常见的化学转化关系,我们可以看到化学在物质变化中起着重要的作用。
通过不同的反应类型,我们可以合成新的化合物,改变物质的性质和用途。
化学转化关系的研究对于我们理解物质的本质和改进化学工艺具有重要的意义。

九年级化学上册化学反应方程总结化学反应方程是描述化学反应中物质转化过程的表达式。
在九年级化学上册中,我们研究了许多不同类型的化学反应方程。
以下是对这些方程的总结:1. 反应类型1.1. 合成反应合成反应是指两个或多个物质结合成一个新的化合物的反应。
它的化学反应方程通常采用以下形式:物质A + 物质B -> 化合物AB1.2. 分解反应分解反应是指一个化合物分解成两个或多个较简单的物质的反应。
它的化学反应方程通常采用以下形式:化合物AB -> 物质A + 物质B1.3. 双替反应双替反应是指两个化合物互相交换部分或全部组分,生成两个新的化合物的反应。
它的化学反应方程通常采用以下形式:化合物AB + 化合物CD -> 化合物AC + 化合物BD1.4. 单替反应单替反应是指一个元素与一个化合物发生反应,替换该化合物中的一个元素的反应。
它的化学反应方程通常采用以下形式:元素A + 化合物BC -> 元素B + 化合物AC1.5. 氧化还原反应氧化还原反应是指在化学反应中发生电荷转移的反应。
它的化学反应方程通常采用以下形式:物质A + 物质B -> 物质A' + 物质B'2. 注意事项- 在编写化学反应方程时,需要遵守化学方程式的平衡原则,即反应物和生成物之间的原子数目要保持平衡。
- 在写化学反应方程时,可以使用状态符号表示物质的状态,如(s)表示固体,(l)表示液体,(g)表示气体,(aq)表示溶于水的溶液。
以上是对九年级化学上册化学反应方程的总结。
希望这份文档能帮助您对化学反应方程的理解和记忆。

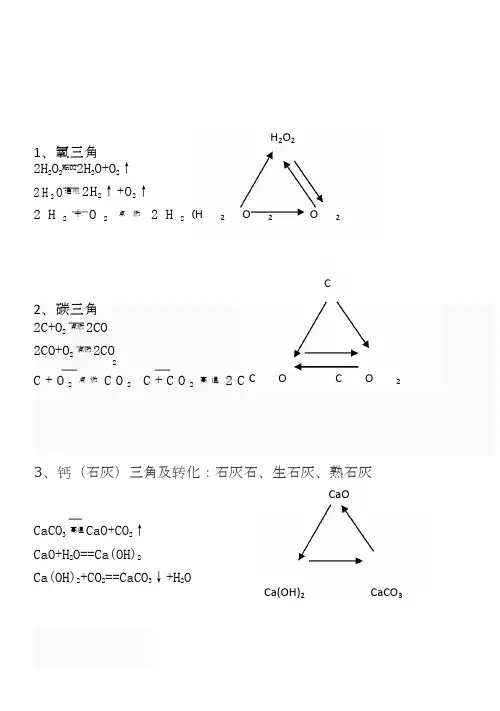
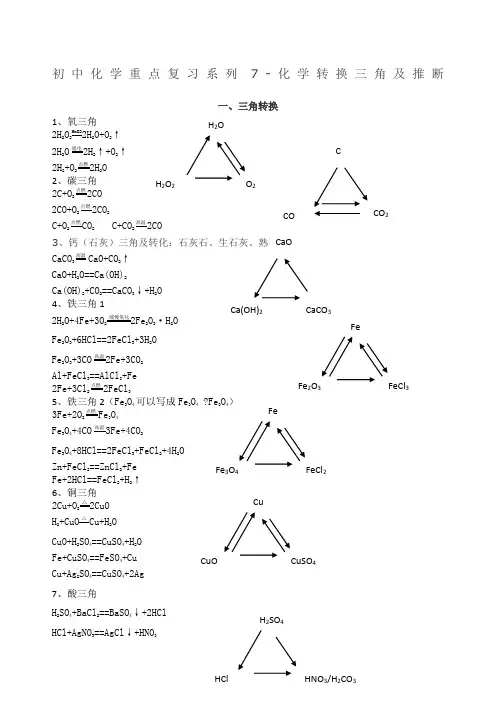
初三化学三角转换 Document serial number【NL89WT-NY98YT-NC8CB-NNUUT-初中化学重点复习系列7-化学转换三角及推断一、三角转换1、氧三角2H2O2MnO22H2O+O2↑2H2O通电2H2↑+O2↑2H2+O2点燃2H2O2、碳三角2C+O2点燃2CO2CO+O2点燃2CO2C+O点燃CO2C+CO高温2CO3、钙(石灰)三角及转化:石灰石、生石灰、熟石灰CaCO高温CaO+CO2↑CaO+H2O==Ca(OH)2Ca(OH)2+CO2==CaCO3↓+H2O4、铁三角12H2O+4Fe+3O2缓慢氧化2Fe2O3·H2OFe2O3+6HCl==2FeCl3+3H2OFe2O3+3CO高温2Fe+3CO2Al+FeCl3==AlCl3+Fe2Fe+3Cl点燃2FeCl35、铁三角2(Fe3O4可以写成Fe3O4Fe3O4)3Fe+2O2点燃Fe3O4Fe3O4+4CO高温3Fe+4CO2Fe3O4+8HCl==2FeCl3+FeCl2+4H2OZn+FeCl2==ZnCl2+FeFe+2HCl==FeCl2+H2↑6、铜三角2Cu+O2△2CuOH 2+CuO△Cu+H2OCuO+H2SO4==CuSO4+H2OFe+CuSO4==FeSO4+CuCu+Ag2SO4==CuSO4+2Ag7、酸三角CCO CO2H2O2H2O2O2FeFe2O3FeCl3CuCuO CuSO4CaOCa(OH)2CaCO3FeFe3O4FeCl2H 2SO 4+BaCl 2==BaSO 4↓+2HCl HCl+AgNO 3==AgCl ↓+HNO 3 H 2SO 4+Ba(NO 3)2==BaSO 4↓+2HNO 3 Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ 8、碱三角Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH 2NaOH+CuSO 4==Cu(OH)2↓+Na 2SO 4 Ca(OH)2+CuSO 4==Cu(OH)2↓+CaSO 4 Ca(OH)2+(NH 4)2SO 4==CaSO 4+2H 2O+2NH 3↑ 9、盐三角1Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ Na 2SO 4+BaCl 2==BaSO 4↓+2NaCl Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ Na 2CO 3+2HNO==2NaNO 3+H 2O+CO 2↑ 10、盐三角2CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ CaCl 2+2AgNO 3==2AgCl ↓+Ca(NO 3)2CaCO 3+2HNO 3==Ca(NO 3)2+H 2O+CO 2↑ ④2H 2+O 点燃2H 2O ⑤3Fe+2O 2点燃Fe 3O 4⑥C+O 2点燃CO 2 ⑨CO 2+H 2O==H 2CO 3 ⑩Ca(OH)2+CO 2=CaCO 3↓+H 2O ⑾CaCO 高温CaO+CO 2↑⑿CaCO 3+2HCl=CaCl 2+H 2O+CO 2↑ ⒀3CO+Fe 2O 3高温2Fe+3CO 2 ⒁2CO+O 2点燃2CO 2 ⒂C+CO 2高温2CO 二、推断题解题思路 1、 阅读题目:要求通阅全题,统领大局。

初中化学重点复习系列7-化学转换三角及推断一、三角转换1、氧三角2H2O2MnO22H2O+O2↑2H2O通电2H2↑+O2↑2H2+O2点燃2H2O2、碳三角2C+O2点燃2CO2CO+O2点燃2CO2C+O2点燃CO2 C+CO2高温2CO3、钙(石灰)三角及转化:石灰石、生石灰、熟石灰CaCO3高温CaO+CO2↑CaO+H2O==Ca(OH)2Ca(OH)2+CO2==CaCO3↓+H2O4、铁三角12H2O+4Fe+3O2缓慢氧化2Fe2O3·H2OFe2O3+6HCl==2FeCl3+3H2OFe2O3+3CO高温2Fe+3CO2Al+FeCl3==AlCl3+Fe2Fe+3Cl2点燃2FeCl35、铁三角2(Fe3O4可以写成Fe3O4•Fe3O4)3Fe+2O2点燃Fe3O4Fe3O4+4CO高温3Fe+4CO2Fe3O4+8HCl==2FeCl3+FeCl2+4H2OZn+FeCl2==ZnCl2+FeFe+2HCl==FeCl2+H2↑6、铜三角2Cu+O2△2CuOH2+CuO△Cu+H2OCuO+H2SO4==CuSO4+H2OFe+CuSO4==FeSO4+CuCu+Ag2SO4==CuSO4+2Ag7、酸三角H2SO4+BaCl2==BaSO4↓+2HClHCl+AgNO3==AgCl↓+HNO3H2SO4+Ba(NO3)2==BaSO4↓+2HNO3Na2CO3+H2SO4==Na2SO4+H2O+CO2↑8、碱三角Ca(OH)2+Na2CO3==CaCO3↓+2NaOH2NaOH+CuSO4==Cu(OH)2↓+Na2SO4Ca(OH)2+CuSO4==Cu(OH)2↓+CaSO4Ca(OH)2+(NH4)2SO4==CaSO4+2H2O+2NH3↑9、盐三角1Na2CO3+H2SO4==Na2SO4+H2O+CO2↑Na2SO4+BaCl2==BaSO4↓+2NaClNa2CO3+2HCl==2NaCl+H2O+CO2↑Na2CO3+2HNO==2NaNO3+H2O+CO2↑10、盐三角2CaCO3+2HCl==CaCl2+H2O+CO2↑CaCl2+2AgNO3==2AgCl↓+Ca(NO3)2CaCO3+2HNO3==Ca(NO3)2+H2O+CO2↑外一:我们身边的物质总转变②①⑧⑨⑥⒀⒁③④⑦⒂⑤⑩⑾⑿①2KMnO4△K2MnO4+MnO2+O2↑②2H2O2MnO22H2O+O2↑③2H2O通电2H2↑+O2↑④2H2+O2点燃2H2O ⑤3Fe+2O点燃Fe3O4⑥C+O2点燃CO2⑦6CO2+6H2O叶绿素光照C6H12O6+6O2⑧H2CO3△H2O+CO2↑⑨CO2+H2O==H2CO3⑩Ca(OH)2+CO2=CaCO3↓+H2O⑾CaCO高温CaO+CO2↑⑿CaCO3+2HCl=CaCl2+H2O+CO2↑O2⒀3CO+Fe2O3高温2Fe+3CO2 ⒁2CO+O2点燃2CO2⒂C+CO2高温2CO二、推断题解题思路1、阅读题目:要求通阅全题,统领大局。


初三化学三角转换关系
初三化学中的三角转换关系通常指的是物质之间的转化关系。
这种关系通常可以用图形来表示,其中每个物质都是一个顶点,而箭头表示转化方向。
例如,钙三角表示的是钙元素的不同化合物之间的转化关系。
包括碳酸钙(CaCO₃)、氧化钙(CaO)和水(H₂O)之间相互转化的关系。
氧化钙可以与水反应生成氢氧化钙,而氢氧化钙又可以与二氧化碳反应重新生成碳酸钙。
另一个例子是碳三角,它表示的是碳、一氧化碳和二氧化碳之间的相互转化关系。
碳可以在氧气中燃烧生成二氧化碳,一氧化碳可以与氧气发生反应生成二氧化碳,二氧化碳也可以通过植物的光合作用重新转化为碳。
在化学中,还有很多其他的三角转换关系,这些关系可以帮助我们理解物质的性质和变化规律,从而更好地掌握化学知识。

中考化学方程式总结
中考化学方程式总结主要包括以下几个方面:
1. 反应类型:
- 物质的合成反应:A + B → AB
- 物质的分解反应:AB → A + B
- 物质的置换反应:A + BC → AC + B
- 物质的双置换反应:AB + CD → AD + BC
- 氧化还原反应:A + B → AB (氧化剂和还原剂参与)
- 酸碱反应:酸 + 碱→盐 + 水
2. 反应条件:
- 反应温度:常温、加热、加热至沸腾
- 反应压力:常压、加压
- 反应催化剂:某些反应需要添加催化剂才能发生
3. 反应物与生成物的符号表示:
- 反应物和生成物的化学式:例如H2O、CO2等
- 反应物和生成物的状态符号:(s)固体、(l)液体、(g)气体、(aq)溶液
4. 化学方程式的平衡:
- 平衡态的表达式:可以通过化学方程式写出反应物和生成物的摩尔比例
- 平衡反应的条件:温度、压力、浓度等
5. 化学方程式的平衡计算:
- 通过给定反应物和生成物的量求平衡时未参与反应的物质的
量
- 通过给定反应物和生成物的量求平衡时反应物和生成物的量这些内容是中考化学方程式总结的基本要点,希望对你有帮助!。

初中所有化学方程式及反应现象总结化学方程式和反应现象是化学学习中的重要内容,涉及到化学反应类型、化学方程式的编写和化学反应的主要现象等方面。
下面给出了初中化学方程式和反应现象的总结,供参考。
一、化学反应类型及反应现象1.酸碱中和反应-一般式:酸+碱→盐+水-反应现象:产生气泡、放热、产生溶液颜色变化、溶液呈中性等。
2.钙、铝、锌与酸反应:-一般式:金属+酸→相应的盐+氢气-反应现象:产生气泡、放热、金属逐渐消失等。
3.金属与氧气反应-一般式:金属+氧气→金属氧化物-反应现象:放热、金属燃烧,产生灰白色或彩色物质。
4.金属与酸反应-一般式:金属+酸→相应的盐+氢气-反应现象:产生气泡、放热、金属逐渐消失等。
5.金属与非金属氧化物反应-一般式:金属+非金属氧化物→相应的金属氧化物-反应现象:放热、发生灼烧等。
6.钠与水反应-一般式:钠+水→碱+氢气-反应现象:氢气燃烧、放热、钠在水中剧烈活动等。
7.铜与酸反应-一般式:铜+酸→相应的盐+氢气-反应现象:产生气泡、放热、铜逐渐消失等。
8.化学电池反应-反应现象:产生电流、电解质溶液中金属片上产生气泡等。
二、化学方程式的编写在化学方程式的编写中,要考虑以下几点:1.反应物和生成物必须符合质量守恒定律;2.反应物和生成物必须符合电荷守恒定律;3.反应物和生成物中的元素应平衡;4.方程式两侧的原子总数应相等。
三、一些重要实验的化学方程式和反应现象1.硫酸和钙碳酸反应-方程式:硫酸+钙碳酸→盐+二氧化硫+水+二氧化碳-反应现象:产生气泡、溶液发热、颜色变化等。
2.铜与硫酸反应-方程式:铜+硫酸→铜硫酸+二氧化硫+水-反应现象:铜逐渐消失、发生气泡等。
3.碳酸氢钠分解反应-方程式:碳酸氢钠→碳酸钠+二氧化碳+水蒸气-反应现象:放热、产生气泡等。
4.铁和硫的反应-方程式:铁+硫→硫化铁-反应现象:放热、产生灰黑色沉淀等。
5.碘溶液和淀粉反应-方程式:碘溶液+淀粉→蓝黑色反应物-反应现象:溶液颜色变化、产生蓝黑色反应物等。
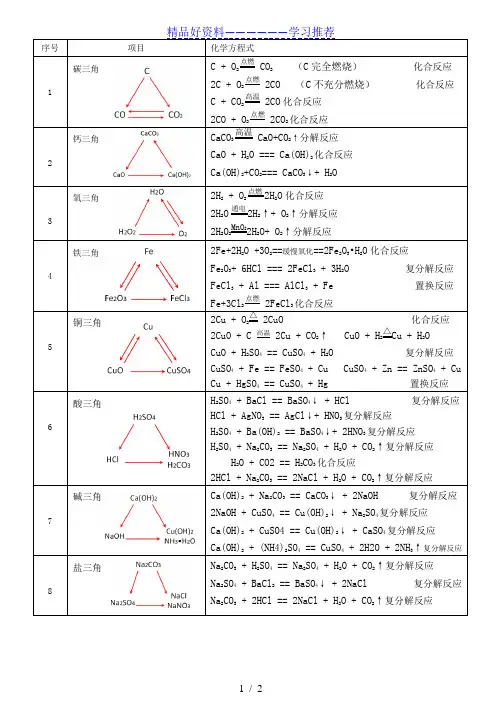
序号项目化学方程式1 碳三角 C + O2点燃 CO2(C完全燃烧)化合反应2C + O2点燃 2CO (C不充分燃烧)化合反应C + CO2高温 2CO化合反应2CO + O2点燃 2CO2化合反应2 钙三角CaCO3高温CaO+CO2↑分解反应CaO + H2O === Ca(OH)2化合反应Ca(OH)2+CO2=== CaCO3↓+ H2O3 氧三角2H2 + O2点燃2H2O化合反应2H2O通电2H2↑+ O2↑分解反应2H2O2MnO22H2O+ O2↑分解反应4 铁三角2Fe+2H2O +3O2==缓慢氧化==2Fe2O3•H2O化合反应Fe2O3+ 6HCl === 2FeCl3 + 3H2O 复分解反应FeCl3 + Al === AlCl3 + Fe 置换反应Fe+3Cl2点燃 2FeCl3化合反应5 铜三角2Cu + O2△ 2CuO 化合反应2CuO + C 高温 2Cu + CO2↑ CuO + H2△Cu + H2OCuO + H2SO4 == CuSO4 + H2O 复分解反应CuSO4 + Fe == FeSO4 + Cu CuSO4 + Zn == ZnSO4 + CuCu + HgSO4 == CuSO4 + Hg 置换反应6 酸三角H2SO4 + BaCl == BaSO4↓ + HCl 复分解反应HCl + AgNO3 == AgCl↓+ HNO3复分解反应H2SO4 + Ba(OH)2 == BaSO4↓+ 2HNO3复分解反应H2SO4 + Na2CO3 == Na2SO4 + H2O + CO2↑复分解反应H2O + CO2 == H2CO3化合反应2HCl + Na2CO3 == 2NaCl + H2O + CO2↑复分解反应7 碱三角Ca(OH)2 + Na2CO3 == CaCO3↓ + 2NaOH 复分解反应2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4复分解反应Ca(OH)2 + CuSO4 == Cu(OH)2↓ + CaSO4复分解反应Ca(OH)2 + (NH4)2SO4 == CuSO4 + 2H2O + 2NH3↑复分解反应8 盐三角Na2CO3 + H2SO4 == Na2SO4 + H2O + CO2↑复分解反应Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl 复分解反应Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑复分解反应9 盐三角CaCO3 + 2HCl == CaCl2 + H2O + CO2↑复分解反应CaCl2 + 2AgNO3 == 2ACl↓ + Ca(NO3)2复分解反应CaCO3 + 2HNO3 == Ca(NO3)2 + H2O + CO2↑复分解反应。
初中化学重点复习系列7-化学转换三角及推断一、三角转换1、氧三角2H 2O 2MnO22H 2O+O 2↑ 2H 2O 通电2H 2↑+O 2↑ 2H 2+O 2点燃2H 2O 2、碳三角 2C+O 点燃2CO 2CO+O 2点燃2CO 2C+O 2点燃CO 2 C+CO 2高温2CO 3、钙(石灰)三角及转化:石灰石、生石灰、熟石灰CaCO 3高温 CaO+CO 2↑ CaO+H 2O==Ca(OH)2 Ca(OH)2+CO 2==CaCO 3↓+H 2O 4、铁三角1 2H 2O+4Fe+3O 2缓慢氧化2Fe 2O 3·H 2OFe 2O 3+6HCl==2FeCl 3+3H 2O Fe 2O 3+3CO 高温2Fe+3CO 2Al+FeCl 3==AlCl 3+Fe2Fe+3Cl 2点燃 2FeCl 35、铁三角2(Fe 3O 4可以写成Fe 3O 4 ?Fe 3O 4) 3Fe+2O 2点燃 Fe 3O 4 Fe 3O 4+4CO 高温3Fe+4CO 2Fe 3O 4+8HCl==2FeCl 3+FeCl 2+4H 2O Zn+FeCl 2==ZnCl 2+Fe Fe+2HCl==FeCl 2+H 2↑ 6、铜三角 2Cu+O 2 △ 2CuO H 2+CuO △ Cu+H 2O CuO+H 2SO 4==CuSO 4+H 2O Fe+CuSO 4==FeSO 4+Cu Cu+Ag 2SO 4==CuSO 4+2Ag 7、酸三角H 2SO 4+BaCl 2==BaSO 4↓+2HCl HCl+AgNO 3==AgCl ↓+HNO 3CCOCO 2H 2OH 2O 2O 2FeFe 2O 3 FeCl 3CuCuOCuSO 4H 2SO 4HCl HNO 3/H 2CO 3CaO Ca(OH)2 CaCO 3FeFe 3O 4FeCl 2H 2SO 4+Ba(NO 3)2==BaSO 4↓+2HNO 3 Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ 8、碱三角Ca(OH)2+Na 2CO 3==CaCO 3↓+2NaOH 2NaOH+CuSO 4==Cu(OH)2↓+Na 2SO 4 Ca(OH)2+CuSO 4==Cu(OH)2↓+CaSO 4 Ca(OH)2+(NH 4)2SO 4==CaSO 4+2H 2O+2NH 3↑ 9、盐三角1Na 2CO 3+H 2SO 4==Na 2SO 4+H 2O+CO 2↑ Na 2SO 4+BaCl 2==BaSO 4↓+2NaCl Na 2CO 3+2HCl==2NaCl+H 2O+CO 2↑ Na 2CO 3+2HNO==2NaNO 3+H 2O+CO 2↑ 10、盐三角2CaCO 3+2HCl==CaCl 2+H 2O+CO 2↑ CaCl 2+2AgNO 3==2AgCl ↓+Ca(NO 3)2CaCO 3+2HNO 3==Ca(NO 3)2+H 2O+CO 2↑ 外一:我们身边的物质总转变 ② ① ⑧ ⑨⑥ ⒀⒁③④ ⑦ ⒂⑤ ⑩ ⑾⑿ Ca(OH)2NaOHCu(OH)2/NH 3·H 2ONa 2CO 3Na 2SO 4NaCl/NaNO 3CaCO 3CaCl 2 Ca(NO 3)2 O 2 Fe 3O 4H 2CO 3CO CO 2 CaCO 3H 2OH 2O 2 KMnO 4①2KMnO4△K2MnO4+MnO2+O2↑②2H2O2MnO22H2O+O2↑③2H2O通电2H2↑+O2↑④2H2+O2点燃2H2O⑤3Fe+2O2点燃Fe3O4⑥C+O点燃CO2 ⑦6CO2+6H2O叶绿素光照C6H12O6+6O2⑧H2CO3△H2O+CO2↑⑨CO2+H2O==H2CO3⑩Ca(OH)2+CO2=CaCO3↓+H2O⑾CaCO3高温CaO+CO2↑⑿CaCO3+2HCl=CaCl2+H2O+CO2↑⒀3CO+Fe2O3高温2Fe+3CO2⒁2CO+O2点燃2CO2⒂C+CO高温2CO二、推断题解题思路1、阅读题目:要求通阅全题,统领大局。
化学方程式里的三角
三角在化学方程式中表示反应物和生成物之间的相互作用关系。
它是一种用于表示化学反应的符号,通常用箭头表示。
化学方程式是描述化学反应的方式,其中包括反应物、生成物以及它们之间的转化关系。
三角箭头则用来表示反应的方向和转化的过程。
在化学方程式中,三角箭头的指向通常从反应物指向生成物。
箭头的方向表示反应的进行方向,从左到右表示反应是正向进行的,反之则表示反应是逆向进行的。
例如,考虑以下化学方程式:2H2 + O2 -> 2H2O
这个方程式表示了氢气和氧气反应生成水的过程。
箭头指向右侧,表示反应是正向进行的。
反应物是氢气和氧气,生成物是水。
三角箭头在化学方程式中的使用有以下几个作用:
1.指示反应的方向:箭头的指向表示反应是正向进行的还是逆向进行的。
正向反应是指反应物转化为生成物的过程,逆向反应是指生成物转化为反应物的过程。
2.描述化学反应的转化过程:箭头连接了反应物和生成物,表示它们之间发生了化学转化。
箭头的存在使得化学方程式更加明确和具体。
3.表示反应的速率:箭头的方向还可以表示反应的速率。
正向箭头表示反应速率较快,而逆向箭头表示反应速率较慢。
4.表示反应的平衡:当箭头指向双箭头时,表示反应是可逆的,可以同时进行正向和逆向反应。
双箭头中间的等号表示反应处于动态平衡状态。
总的来说,三角箭头在化学方程式中起到了指示反应方向、描述反应转化过程和表示反应速率等作用。
它是化学方程式中不可或缺的一部分,帮助我们理解化学反应的过程和特点。
序号项目化学方程式
1 碳三角 C + O2
点燃 CO
2(C完全燃烧)化合反应
2C + O2 点燃 2CO (C不充分燃烧)化合反应
C + CO2高温 2CO 化合反应
2CO + O2 点燃 2CO2 化合反应
2 钙三角CaCO3
高温
CaO + CO2↑分解反应
CaO + H2O === Ca(OH)2化合反应
Ca(OH)2 + CO2 === CaCO3↓+ H2O
3 氧三角2H2 + O2
点燃 2H
2O 化合反应
2H2O 通电 2H2↑+ O2↑分解反应
2H2O2 MnO22H2O + O2↑分解反应
4 铁三角2Fe + 2H2O + 3O2 ==缓慢氧化== 2Fe2O3•H2O 化合反应
Fe2O3 + 6HCl === 2FeCl3 + 3H2O 复分解反应
FeCl3 + Al === AlCl3 + Fe 置换反应
Fe+3Cl2 点燃 2FeCl3 化合反应
5 铜三角2Cu + O2
△ 2CuO 化合反应
2CuO + C 高温 2Cu + CO2↑ CuO + H2△Cu + H2O
CuO + H2SO4 == CuSO4 + H2O 复分解反应
CuSO4 + Fe == FeSO4 + Cu CuSO4 + Zn == ZnSO4 + Cu
Cu + HgSO4 == CuSO4 + Hg 置换反应
6 酸三角H2SO4 + BaCl == BaSO4↓ + HCl 复分解反应
HCl + AgNO3 == AgCl↓ + HNO3 复分解反应
H2SO4 + Ba(OH)2 == BaSO4↓+ 2HNO3 复分解反应
H2SO4 + Na2CO3 == Na2SO4 + H2O + CO2↑复分解反应
H2O + CO2 == H2CO3 化合反应
2HCl + Na2CO3 == 2NaCl + H2O + CO2↑复分解反应
7 碱三角Ca(OH)2 + Na2CO3 == CaCO3↓ + 2NaOH 复分解反应
2NaOH + CuSO4 == Cu(OH)2↓ + Na2SO4 复分解反应
Ca(OH)2 + CuSO4 == Cu(OH)2↓ + CaSO4 复分解反应
Ca(OH)2 + (NH4)2SO4 == CuSO4 + 2H2O + 2NH3↑复分解反应
8 盐三角Na2CO3 + H2SO4 == Na2SO4 + H2O + CO2↑复分解反应
Na2SO4 + BaCl2 == BaSO4↓ + 2NaCl 复分解反应
Na2CO3 + 2HCl == 2NaCl + H2O + CO2↑复分解反应
9 盐三角CaCO3 + 2HCl == CaCl2 + H2O + CO2↑复分解反应
CaCl2 + 2AgNO3 == 2ACl↓ + Ca(NO3)2 复分解反应
CaCO3 + 2HNO3 == Ca(NO3)2 + H2O + CO2↑复分解反应。