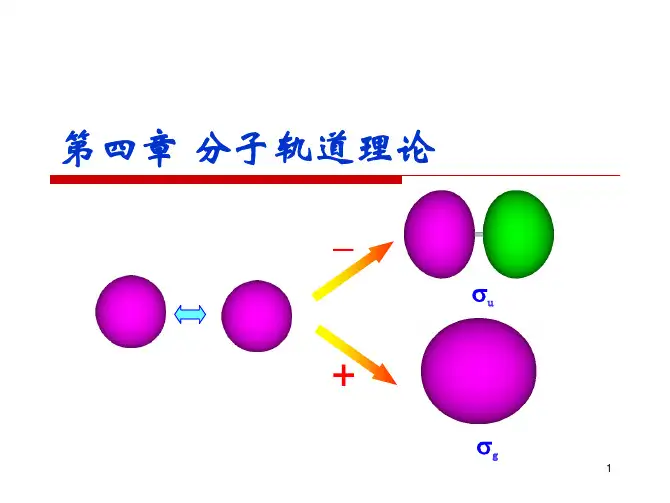
4第四章 分子轨道理论
- 格式:ppt
- 大小:7.04 MB
- 文档页数:93
![[课件]第四章 休克尔(Hückel) 分子轨道理论PPT](https://uimg.taocdn.com/1cf29dc819e8b8f67c1cb992.webp)

第三节分子轨道理论(MOT)一、概述要点:A、配体原子轨道通过线性组合,构筑与中心原子轨道对称性匹配的配体群轨道。
B、中心原子轨道与配体群轨道组成分子轨道。
形成LCAO-MO的三原则:二、金属与配体间σ分子轨道(d轨道能级分裂)1.可形成σ分子轨道的中心原子轨(n-1)d x2-y2, (n-1)d z2, ns, np x, np y, np z (可形成σ分子轨道)三、ABn型分子构筑分子轨道的方法1、步骤1)列出中心原子A及配位原子B中参与形成分子轨道的原子轨道;2)将中心原子轨道按照以它们为基的不可约表示分类;3)将B原子轨道按等价轨道集合分类(由对称操作可彼此交换的轨道称为等价轨道);4)将每一等价轨道集合作为表示的基,给出表示;再将其分解为不可约表示;5)用每一组等价轨道集合构筑出对应于上一步所求出的不可约表示的配体群轨道;6)将对称性相同的配体群轨道与中心原子轨道组合得分子轨道。
2、以AB6(O h群)为例1)A原子用ns、np、(n-1)d 9个轨道,每个B原子用3个p(p x、p y、p z)轨道,共27个轨道形成分子轨道。
C、规定p z向量指向中心原子,则p x、p y向量应存在于垂直于p z向量的平面内;D、规定第一个B原子的p x向量与y 轴平行(* 方向相同),则该B原子的p y向量应与z轴平行(* 方向相同);E、其余(6-1)个B原子的p x和p y 向量的方向由O h群对称性决定。
2)A原子价轨道在O h群对称下,属于下列表示:A1g: sE g: d x2-y2,d z2T1u: p x,p y,p zT2g: d xy,d xz,dyz3)O h群将B原子的18个轨道分为如下等价轨道的集合:I、6个p z轨道(可用于形成σ分子轨道)II、12个p x或p y轨道4)以上述轨道集合I为基,得出在O h群中的表示,并进行约化:Гσ = A1g + E g + T1u5)求出与中心原子价轨道相关的配体群轨道(用投影算符):中心原子轨道ψ(A1g) = (1/6)1/2(p z1+p z2+p z3+p z4+p z5+p z6) 匹配sψ(E g) = (1/12)1/2(2p z5+2p z6-p z1-p z2-p z3-p z4) d z21/2(p z1-p z2+p z3-p z4) 匹配d x2-y2ψ(T1u) = (1/2)1/2(p z1-p z3) p x(1/2)1/2(p z2-p z4) 匹配p y(1/2)1/2(p z5-p z6) p z6)按照上述对应关系,构成分子轨道。

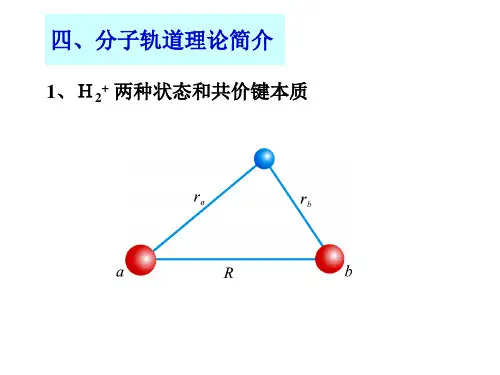
什么是分子轨道理论
分子轨道理论(Molecular Orbital Theory,简称MO理论)是1932年由美国化学家马利肯(R.S.Mulliken)及德国物理学家洪特(F.Hund)提出的一种描述多原子分子中电子所处状态的方法。
该理论认为原子形成分子后,电子不再属于个别的原子轨道,而是属于整个分子的分子轨道,分子轨道是多中心的。
分子轨道由原子轨道组合而成,形成分子轨道时遵从能量近似原则、对称性一致(匹配)原则、最大重叠原则,即通常说的“成键三原则”。
在分子中电子填充分子轨道的原则也服从能量最低原理、泡利不相容原理和洪特规则。
以上信息仅供参考,建议查阅化学专业书籍文献或咨询化学专业人士获取更全面更准确的信息。

分子轨道理分子轨道是描述分子中电子运动状态的波函数。
主要有4种类型的分子轨道:σ轨道、π轨道、非键轨道和反键轨道。
这些轨道的形状和能量级别决定了分子中电子的排布和化学性质。
下面将详细介绍这几种分子轨道的特征和相关理论。
首先是σ轨道。
σ轨道是分子中电子云最密集的轨道,具有球对称的形状。
它沿着化学键的轴向分布,所以也被称为轴向轨道。
σ轨道可以由两个原子轨道叠加而成,每个原子提供一个电子。
根据平面对称性的不同,σ轨道可以分为σ-s和σ-p轨道,前者为电子密度在分子中心沿轴向对称的轨道,后者为电子密度在分子平面中的两个方向上对称的轨道。
σ轨道主要参与形成化学键,是稳定的分子轨道。
接下来是π轨道。
π轨道具有两个相互垂直的环面,分别在化学键的上、下两侧。
与σ轨道不同,π轨道是运动在较大空间范围内的,所以也被称为侧向轨道。
π轨道可以由两个平行的原子轨道叠加而成,每个原子提供一个电子。
根据能级的不同,π轨道可以细分为π-s和π-p轨道,两者的电子密度在平面内的分布形式不同。
π轨道在化学键的形成中起到重要作用,决定了分子的共轭结构和反应性质。
非键轨道是分子中存在于原子之间的轨道。
它们是离域的电子轨道,不通过化学键与特定原子相关联。
非键轨道的能量相对较高,电子密度较低。
由于非键轨道的存在,分子可以吸收外部能量激发电子至非键轨道,从而进行各种光化学和电化学反应。
反键轨道与化学键中的σ和π轨道相对应,具有相同的空间分布形式,但电子的运动方向相反。
反键轨道的能级相对较高,电子密度较低。
它们主要参与分子中电子的排斥和共振现象,以及反应中的电荷转移。
分子轨道理论是通过量子力学的计算方法和原理来描述分子中电子的分布和运动状态,为解释分子光谱和化学反应提供了依据。
根据分子轨道理论,可以计算分子轨道的能级、形状和电子密度,并预测分子的化学性质。
分子轨道理论的成功应用包括描述分子的电子结构、解释分子间相互作用、预测分子的稳定性和反应性,以及设计新的功能分子。




分子轨道理
分子轨道理论是一种解释分子化学性质的理论,主要应用于复杂化学物质的计算和设计。
该理论结合量子力学和分子对称性理论,通过对分子中原子轨道的组合和相互作用的分析,得出分子轨道能级和电子分布,进而预测分子性质及其反应活性。
其主要内容包括:
1. 原理:分子轨道理论的核心原理是“波函数线性组合原理”,即分子轨道是由原子轨道按照一定的线性组合方式组成的。
线性组合系数称为“分子轨道系数”。
2. 能级:分子轨道能级是由原子轨道相互作用而形成的,其数目等于参与组合的原子轨道数目。
能级顺序和大小与分子轨道系数及原子轨道能级之间的相互作用有关。
3. 分子轨道类型:根据分子轨道能级和分子轨道系数的不同,分子轨道可分为sigma(σ)轨道、pi(π)轨道、delta(δ)轨道等。
4. 分子轨道的对称性:分子对称性对分子轨道的能级和分子性质有很大影响。
相同对称性的原子轨道组合会形成对称性相同的分子轨道。
5. MO图解:MO图是分子轨道理论的重要表述方式,用于描述分子中电子的能级和分布情况。
其结构为横坐标为分子轨道能级,纵坐标为分子轨道系数的坐标轴。
6. 应用:分子轨道理论可应用于物理、化学、生物等领域,如
化学反应机理、分子光谱学、药物设计等。
7. 限制和局限:分子轨道理论适用于与原子轨道相似的分子,但对于复杂分子和高能态的描述有一定局限性。
分子轨道理论简介一种化学键理论,是原子轨道理论对分子的自然推广。
其基本观点是:物理上存在单个电子的自身行为,只受分子中的原子核和其他电子平均场的作用,以及泡利不相容原理的制约;数学上则企图将难解的多电子运动方程简化为单电子方程处理。
因此,分子轨道理论是一种以单电子近似为基础的化学键理论。
描写单电子行为的波函数称轨道(或轨函),所对应的单电子能量称能级。
对于任何分子,如果求得了它的系列分子轨道和能级,就可以像讨论原子结构那样讨论分子结构,并联系到分子性质的系统解释。
有时,即便根据用粗糙的计算方案所得到的部分近似分子轨道和能级,也能分析出很有用处的定性结果。
理论⒈原子在形成分子时,所有电子都有贡献,分子中的电子不再从属于某个原子,而是在整个分子空间范围内运动。
在分子中电子的空间运动状态可用相应的分子轨道波函数ψ(称为分子轨道)来描述。
分子轨道和原子轨道的主要区别在于:⑴在原子中,电子的运动只受1个原子核的作用,原子轨道是单核系统;而在分子中,电子则在所有原子核势场作用下运动,分子轨道是多核系统。
分子轨道理论⑵原子轨道的名称用s、p、d…符号表示,而分子轨道的名称则相应地用σ、π、δ…符号表示。
⒉分子轨道可以由分子中原子轨道波函数的线性组合(linearcombinationofatomicorbitals,LCAO)而得到。
有几个原子轨道就可以可组合成几个分子轨道,其中有一部分分子轨道分别由对称性匹配的两个原子轨道叠加而成,两核间电子的概率密度增大,其能量较原来的原子轨道能量低,有利于成键,称为成键分子轨道(bondingmolecularorbital),如σ、π轨道(轴对称轨道);同时这些对称性匹配的两个原子轨道也会相减形成另一种分子轨道,结果是两核间电子的概率密度很小,其能量较原来的原子轨道能量高,不利于成键,称为反键分子轨道(antibondingmolecularorbital),如σ*、π*轨道(镜面对称轨道,反键轨道的符号上常加"*"以与成键轨道区别)。
分子轨道理论1. 引言分子轨道理论是化学中的一种重要理论,它用量子力学的原理解释了分子的电子结构和化学性质。
本文将介绍分子轨道理论的基本概念、应用以及相关的计算方法。
2. 基本概念2.1 原子轨道在分子轨道理论中,首先要了解的是原子轨道。
原子轨道是描述单个原子中电子运动的波函数。
根据量子力学的原理,一个原子可以存在多个不同的原子轨道,每个原子轨道都对应着不同的能量状态。
2.2 分子轨道当两个或更多个原子靠近形成化学键时,原子轨道会互相重叠,形成新的分子轨道。
分子轨道描述的是电子在整个分子中的运动状态。
根据分子轨道理论,分子轨道可以分为两类:成键分子轨道和反键分子轨道。
成键分子轨道对应着电子的主要分布区域,而反键分子轨道则对应着电子分布相对较少的区域。
2.3 分子轨道能级分子轨道能级与原子轨道能级类似,分子轨道的能量随着轨道的能级增加而增加。
有时,分子轨道能级之间会有一定的能隙,这种能隙反映了分子稳定性的特征。
3. 分子轨道的应用分子轨道理论可以解释大量的化学现象和性质,下面列举了几个常见的应用:3.1 化学键的形成分子轨道理论提供了解释化学键产生的机制。
当两个原子靠近并形成化学键时,原子轨道会发生线性组合形成分子轨道。
通过分子轨道理论,我们可以理解不同类型的化学键(如共价键、离子键和金属键)是如何形成的以及其性质的差异。
3.2 分子轨道的能级顺序分子轨道理论还可以预测分子轨道的能级顺序,从而解释分子的化学性质。
能级较低的分子轨道通常具有较高的稳定性,从而决定了分子的化学反应性质。
3.3 分子光谱在分子光谱中,分子轨道理论被广泛应用。
分子轨道理论可以解释分子在吸收或发射光的过程中所发生的能级跃迁,从而解释不同光信号的产生和分子结构的变化。
4. 分子轨道的计算方法4.1 原子轨道模型著名的原子轨道计算方法包括Hartree-Fock方法和密度泛函理论。
这些方法通过求解原子的薛定谔方程,得到原子轨道及其能量。
配位化学讲义第四章(2)分子轨道理论第三节分子轨道理论(MOT)一、概述要点:A、配体原子轨道通过线性组合,构筑与中心原子轨道对称性匹配的配体群轨道。
B、中心原子轨道与配体群轨道组成分子轨道。
形成LCAO-MO的三原则:二、金属与配体间σ分子轨道(d轨道能级分裂)1.可形成σ分子轨道的中心原子轨道在八面体配合物MX6中,每个配体可提供一个p z轨道用于形成σ分子轨道。
xy z123546中心金属价轨道:(n-1)d xy, (n-1)d yz, (n-1)d xz (可形成π分子轨道)(n-1)d x2-y2, (n-1)d z2, ns, np x, np y, np z (可形成σ分子轨道)三、ABn型分子构筑分子轨道的方法1、步骤1)列出中心原子A及配位原子B中参与形成分子轨道的原子轨道;2)将中心原子轨道按照以它们为基的不可约表示分类;3)将B原子轨道按等价轨道集合分类(由对称操作可彼此交换的轨道称为等价轨道);4)将每一等价轨道集合作为表示的基,给出表示;再将其分解为不可约表示;5)用每一组等价轨道集合构筑出对应于上一步所求出的不可约表示的配体群轨道;6)将对称性相同的配体群轨道与中心原子轨道组合得分子轨道。
2、以AB6(O h群)为例1)A原子用ns、np、(n-1)d 9个轨道,每个B原子用3个p(p x、p y、p z)轨道,共27个轨道形成分子轨道。
* 坐标系选择及配体编号xyz123546p xp y p zA 、中心原子取右手坐标系,配体取左手坐标系;B 、每个B 原子上三个p 轨道各用一个向量表示,方向指向波函数正值方向;C、规定p z向量指向中心原子,则p x、p y向量应存在于垂直于p z向量的平面内;D、规定第一个B原子的p x向量与y 轴平行(* 方向相同),则该B原子的p y向量应与z轴平行(* 方向相同);E、其余(6-1)个B原子的p x和p y 向量的方向由O h群对称性决定。