2.例如加热时,晶体溅出瓷坩埚外,又如加热 过头,无水CuSO4分解,又如称量错误,硫酸 铜晶体多而计量小,都造成测定结果偏大。
3.实验中因试剂纯度等因素不能达到.x= 5.00,可能正、负误差相互抵消。
4.
7. 加热结束后为什么要冷却后称量?为什么 要放在干燥器中冷却?
温度较高时称量会损坏天平;在空气中冷却会 又吸收空气中的水蒸气,影响测定结果.
8. 实验过程中至少需要称量几次?为什么? 为什么要恒重操作?如何进行恒重操作? 至少要称量4次: 称量坩埚,加入晶体后称 量,加热失去结晶水并冷却后称量,再加热 并冷却后称量。
b.加热坩埚需要垫石棉网吗?
不需要,坩埚可直接加热,但要放在泥三角上加热
c.加热时为什么要不断搅拌?
防止局部过热造成晶体飞溅,实验结果偏大.搅 拌时需用坩埚钳夹住坩埚,防止跌落
6. 加热到何时可以停止加热? 蓝色晶体基本变为白色粉末,停止加热,并继续用 玻棒搅拌,利用余热将可能还有的结晶水除去,也 可以防止因过热引起CuSO4受热分解
结晶水合物
CuSO4· 5 H 2O x
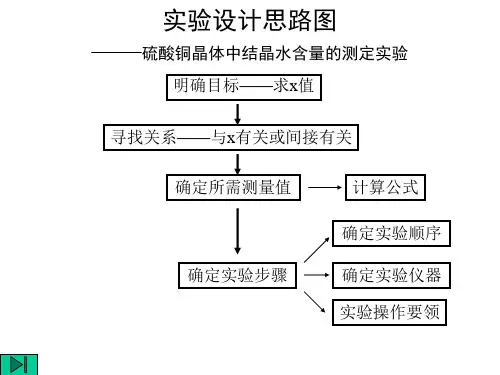
1.结晶水含量测定的原理
m(CuSO4)
=
m(H2O)
=1︰X
M(CuSO4) M(H2O)
硫酸铜结晶水含量的测定
实验用品
1、仪器:电子天平、研钵、坩埚、坩埚钳、三角架、 泥三角、玻璃棒、干燥器、酒精灯。 2、药品:硫酸铜晶体
泥三角
坩埚
坩埚钳
三角架
研钵
干燥器
电子天平
2.根据结晶水含量测定的原理设计实验方案:实验步骤, 实验所需要的用品(实验仪器,实验药品)。 (1)准确称量坩埚质量(m0 g )
(2)在瓷坩埚中加入约2g研细的硫酸铜晶体,并称量( m1 g )