人教版新教材 第五章 实验活动4 用化学沉淀法去除粗盐中的杂质离子课件(共19页ppt)
- 格式:pptx
- 大小:4.08 MB
- 文档页数:19


实验活动4 用化学沉淀法去除粗盐中的杂质离子-人教版高中化学必修第二册(2019版)教案实验目的通过本实验,学生将了解化学沉淀法对于粗盐中的杂质离子的去除原理,掌握本实验的操作方法和注意事项,提高学生在实验中的操作技能,并进一步提高学生的实验观察和实验数据处理能力。
实验原理化学沉淀法是指通过溶液中有机的络合物或不溶性沉淀物等,将杂质或分离出需要的物质的方法。
本实验中所使用的化学沉淀法是利用亚硝酸钠和硫酸铜作为沉淀剂,将粗盐中的杂质离子分离出来。
实验步骤1.取1g左右的粗盐样品,加入100mL蒸馏水中。
2.将亚硝酸钠溶液加入到样品中,滴加至颜色变为粉红色,停止滴加。
3.将硫酸铜溶液加入到样品中,滴加至溶液不再产生蓝色沉淀为止。
4.将产生的沉淀和溶液分离,用水洗涤沉淀。
5.将沉淀与水混合并加入稀盐酸中,搅拌均匀后过滤。
6.将过滤液加入氯化钾溶液中,观察有无产生白色沉淀。
实验注意事项1.实验中使用的设备、玻璃仪器等应察看是否干净、完整。
2.实验中使用的化学试剂,应注意其性质、危害性以及储存方式。
3.实验中使用的稀盐酸、氯化钾需要注意酸碱指示剂和酸碱中和等基本知识。
4.实验过程需要安全操作,注意预防小火灾等事故。
实验结果和分析将硫酸铜溶液滴加到样品中时,溶液中出现蓝色沉淀。
原因是存在硫酸铜中的阳离子Cu2+和粗盐中的阴离子Cl-反应生成沉淀。
CuSO4+2NaCl→CuCl2↓+Na2SO4当加入亚硝酸钠溶液后,亚硝酸钠起到还原Cu2+为Cu+的作用,并生成一定量的亚硝酸钠氧化物NO。
加入氯化钾后,产生白色沉淀。
原因是通过由NO自由基引发氯离子自由基,使Cl-离子被氧化为Cl2离子,和溶液中的钾离子结合形成了白色的沉淀KClO。
2Cl−+2K+→K2Cl2+O2↑实验总结经过本次实验的操作,学生掌握了化学沉淀法对于粗盐中的杂质离子的去除原理,学习了本实验的操作方法和注意事项,提高了学生所在实验中的操作技能,进一步提高了学生的实验观察和实验数据处理能力。


化学沉淀法去除粗盐中的杂质离子说课稿
化学沉淀法是一种常见的去除粗盐中杂质离子的方法。
它的基本原理是通过化学反应使杂质离子沉淀下来,从而实现分离纯化的目的。
我们需要了解粗盐中存在哪些杂质离子。
粗盐是指未经过任何处理的天然盐,其中可能会含有氯化钾、硫酸钠、碳酸钙等多种离子。
这些离子会影响到盐的品质和使用效果,因此需要进行去除。
化学沉淀法的实施一般需要以下步骤:
1. 将粗盐溶解在水中,制备出盐水溶液。
2. 加入化学试剂,使产生反应并形成沉淀。
常见的化学试剂有硫酸钙、氯化铝等。
3. 通过过滤或离心等手段将沉淀分离出来,得到经过纯化的盐水溶液。
4. 将盐水溶液进行蒸发,得到干盐,即为纯净的盐。
这种方法的优点在于操作简便、效果明显,可以比较彻底地去除杂质离子。
但是也存在一些缺点,比如需要使用化学试剂,会产生废液和废弃物,需要进行处理;同时也需要一定的专业知识和技术支持,否则可能会出现反应不充分、沉淀不彻底等问题。
总的来说,化学沉淀法是一种较为成熟和常用的去除粗盐中杂质离
子的方法。
在实施过程中需要注意操作规范、环保意识,并进行合理的废弃物处理,以保证安全、高效、环保地完成工作。






《用化学沉淀法去除粗盐中的杂质离子》学历案(第一课时)一、学习主题本课程学习主题为“用化学沉淀法去除粗盐中的杂质离子”。
在化学实验中,通过化学沉淀法,我们能够有效地去除粗盐中的杂质离子,从而得到较为纯净的盐类物质。
本节课我们将通过理论学习和实验操作,深入理解这一方法的基本原理和操作步骤。
二、学习目标1. 掌握化学沉淀法的基本原理和操作步骤;2. 了解粗盐中常见杂质离子的种类及其对盐类物质的影响;3. 学会通过实验操作,利用化学沉淀法去除粗盐中的杂质离子;4. 培养学生的实验操作能力和科学探究精神。
三、评价任务1. 理论评价:通过课堂提问和课后作业,评价学生对化学沉淀法基本原理的理解程度;2. 实验评价:通过观察学生在实验过程中的操作规范性和实验结果,评价学生掌握化学沉淀法去除杂质离子的能力;3. 综合评价:结合学生的课堂表现、实验报告和实验结果,综合评价学生对本节课内容的掌握情况。
四、学习过程1. 导入新课:通过展示粗盐样品和纯净盐样品的对比,引导学生了解粗盐中杂质的存在及其对盐类物质的影响,进而引入本节课的学习主题。
2. 理论学习:讲解化学沉淀法的基本原理和操作步骤,重点介绍杂质离子的种类、性质及其对盐类物质的影响。
同时,强调实验操作中的安全注意事项。
3. 实验演示:教师进行实验演示,展示如何利用化学沉淀法去除粗盐中的杂质离子。
在演示过程中,强调操作规范和实验注意事项。
4. 学生实验:学生分组进行实验操作,教师巡回指导,及时纠正学生的错误操作。
学生需按照实验步骤,逐步完成粗盐中杂质离子的去除。
5. 实验总结:学生完成实验后,进行实验总结和交流。
教师点评学生的实验操作和结果,指出存在的问题和不足,强调化学沉淀法的重要性和应用价值。
五、检测与作业1. 课堂检测:通过课堂小测验,检测学生对化学沉淀法基本原理的理解程度;2. 作业布置:布置相关实验报告和课后习题,要求学生总结实验过程和结果,巩固所学知识。
第五章《化工生产中的重要非金属元素》教学设计实验活动4 用化学沉淀法去除粗盐中的杂质离子A.A B.B C.C D.D【答案】C【解析】A.盐酸的酸性强于碳酸,CO2中混有HCl,常采用通入饱和碳酸氢钠溶液,故A不符合题意;B.加入过氧化氢,将Fe2+氧化成Fe3+,不引入新杂质,能够完成实验目的,故B不符合题意;C.氧化铝为两性氧化物,氧化铁为碱性氧化物,加入氢氧化钠溶液,氧化铝与氢氧化钠生成可溶的偏铝酸钠,而氧化铁不与氢氧化钠反应,不能达到实验目的,故C符合题意;D.MnO2不溶于水,KCl可溶于水,因此可采用加水溶液,过滤,除去KCl,能达到实验目的,故D不符合题意;答案为C。
【对应训练2】三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点为33℃,沸点为73℃,遇水易反应。
实验室可用图装置制取ICl3,制备的反应原理:I2+3Cl2=2ICl3 下列说法不正确的是()A.利用装置甲制备氯气选用的药品可以是高锰酸钾和浓盐酸B.装置乙中长颈漏斗液面上升说明丙装置可能发生堵塞C.装置丙中氯化钙的作用是干燥Cl2D.装置戊中的碱石灰可以用无水氯化钙代替【答案】D【解析】A.高锰酸钾氧化浓盐酸当中的氯离子生成氯气,且该反应不需要加热,A 正确;B.若丙中U型管堵塞,则气体会滞留在装置乙中,导致乙中长颈漏斗液面上升,B正确;C.氯化钙是干燥剂,因此丙的作用是干燥制得的氯气,C正确;D.碱石灰可以除去多余的氯气,无水氯化钙不能除去氯气,故装置戊中的碱石灰不可以用无水氯化钙代替,D错误;故本题选D。
【过渡】物质的分离和提纯实验过程中,会用到多种实验方法,下面我们来学习过滤和蒸发。
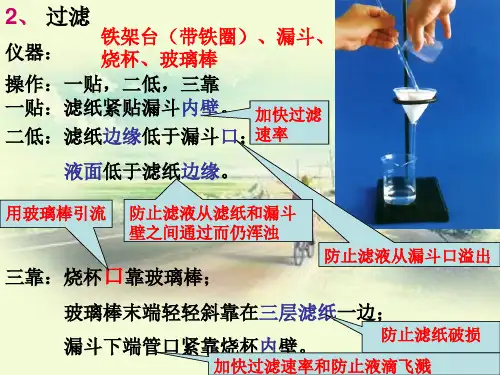
【问题1】过滤实验操作的概念、原理、适用范围、主要仪器及注意事项分别是什么?【学生1】概念:利用物质溶解性的差异,将液体和不溶于液体的固体分离开来【学生2】原理:物质溶解性的差异【学生3】适用范围:适用于固液混合物的分离。
一般情况下,是一种物质易溶于水,另一种物质难溶于水【学生4】主要仪器:铁架台(含铁圈)、烧杯、漏斗、滤纸【教师】评价、投影装置图:【教师】追问:在过滤操作中,要注意“一贴、二低、三靠”,其含义是什么?【学生】一贴:滤纸紧贴漏斗内壁,中间不留有气泡;二低:滤纸上边缘低于漏斗边缘,液面低于滤纸边缘;三靠:倾倒液体的烧杯紧靠玻璃棒,玻璃棒末端紧靠三层滤纸处,漏斗的下端尖口紧靠盛接滤液的烧杯内壁【教师】评价、设凝:在过滤过程中,若滤液浑浊,该怎样处理?滤液浑浊的原因可能是什么?【学生】需更换滤纸,重新过滤,直至溶液澄清透明为止。