周环反应解析
- 格式:pptx
- 大小:706.36 KB
- 文档页数:58

第九章周环反应(协同反应)协同反应——(1)此类反应中无产生离子或自由基等中间活性体(2)不受催化剂或溶剂的影响(3)键的生成和断裂在一步中完成(4)可在热和光照下反应(5)立体专一性反应由于反应的过渡态是一环状结构,所以也称为周环反应。
周环反应是以轨道对称守恒原理为基础的,由Woodward提出。
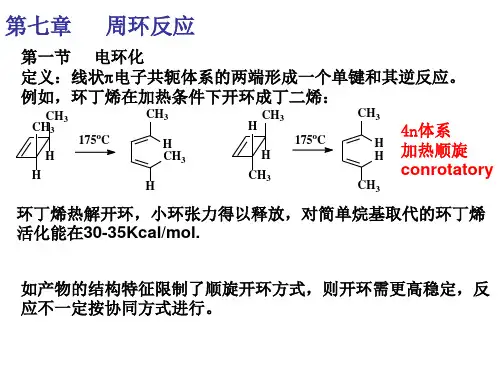
第一节分子轨道对称守恒定律1、术语:以乙烯分子为例:21反键轨道成键轨道分子轨道用波函数来表示:对乙烯分子π轨道来说,它有一个对称因素:为面对称(成键轨道S),而对反键轨道来说是反对称(A)C1对称:Symmetry波函数的数学符号相同,S 面:对映关系轴:转180°反对称:Antisymmetry波函数的数学符号相反,A轴C1:二个碳原子的连线轴C2:两个平面乙烯面与m平面的交线节点:将符号相同的波函数相连与C1轴的交点乙烯的π型分子轨道、节点数和对称性总结为:反键轨道成键轨道轨道节点数对称性21m C2A SS A 节面节点的物理意义:(1)节点越多,说明该轨道的能级越高不安定因素(2)节点处的电子密度等于零对Ψ1来说:是π电子的最高占有分子轨道(HOMO)high occupied molecule orbit *不是说满轨道,只要有一个也是占有最高占有轨道的电子束缚得最松弛,具有给电子的性质,最易激发到最低空轨道,因此这二个轨道为Ψ2是最低的空分子轨道(LUMO)low unoccupied molecule orbit 前线轨道(前沿轨道)对电子的亲和力较强,具有接受电子的性质丁二烯的分子轨道及其对称性:节点数 对称性 m C 23210A S S A A S S A21己三烯的分子轨道及其对称性321节点数 对称性 m C 2543210A S S A A S S A A S S A当最高轨道HOMO 的电子受到光的吸收光子的能量发生跃迁,到最低空轨道时,那时该轨道就变成HOMO 了基态:未激发的HOMO激发态:激发的HOMO ,相当于LUMO第二节 电子反应中的轨道对称守恒原理电环反应中的两种反应形式:1、热化学:是反应物分子处于基态所发生的反应 HOMO2、光化学: 激发态所发生的反应 LUMO 一、丁二烯和环丁烯的电环反应hγγLUMOHOMOCH3CH3H H 175。






周 环 反 应一、 基本内容1、周环反应是指在反应进程中,键的断裂与形成是以一个闭合环状过渡态、相互作用的轨道中的电子对重新组合为特征的协同反应。
也就是说,键的断裂与形成都在一个闭合环状过渡态中进行。
因此,周环反应具有如下特点:(1)反应进行时,有两支以上的键几乎同时断裂或形成。
(2)反应具有高度的立体选择性。
(3)反应进行的动力是加热或光照。
2、周环反应主要有三大类型:电环化反应、环加成反应和σ-迁移反应。
二、 重点与难点由周环反应的定义和特点可知,对分子轨道理论、过渡态及立体化学的理解和相关知识的运用是非常重要的。
本章特别强调对前线轨道理论在电环化反应中的运用。
本章的难点是合理地写出一具体反应的合理的反应产物,这要求对轨道的对称性及过渡态的能量加以合理的分析和判断。
三、 精选题及其解1、预测下列化合物电环化时产物的结构:(1)H CH 3H CH3(2)(3)H CH 3H CH 3hν(5)CH 3H CH 3H(4)解说明:我们以本题为例来探讨一下如何运用前线轨道理论,以及如何对反应加以正确的分析、写出合理的产物。
题(1)是电环化反应。
在反应条件下,反应物A有开环和关环两种反应途径。
关环反应的π电子数由反应物决定,为4π电子体系;开环反应的π电子数由产物决定为6π电子体系。
关环反应产物B 极不稳定(中间的四元环的两支σ键互为反式),说明形成该产物的过渡态的能量极高,反应不能进行。
因此,该反应经对旋开环形成产物C 。
若要验证一下答案的正确性,可将化合物C 在同样条件下的关环产物写出,如果写出的产物是A,说明答案是正确的。
因为,由A 到C 和由C 到A 的变化的过渡态是一样的。
2、用前线轨道理论解释1(1)的产物的正确性。
解 先画出化合物C 的π分子轨道如下:前线轨道分别为最高占有轨道HOMO 和最低空轨道LUMO 。
电环化反应轨道对称性取决于最高占有轨道的对称性。
(1)H CH 3H H CH 3HCH3(4)(5)3CH 3(1)HHH看成4π电子体系AB对旋开环C如用下图表示A 由到B 的关环反应的过渡态,可以看出标记为a 的那支碳碳键需跨面形成,这对小环化合物是不可能的。


周环反应机理
周环反应(也被称为电环反应)是一类有机化学反应,涉及到多环化合物的形成。
周环反应机理可能因反应类型和底物的不同而有所不同,下面是一个常见的周环反应机理的概述。
1.环化生成反应:周环反应通常涉及到有机分子中的双键、
三键或其他活性基团。
这些活性基团可通过内酰胺、环内醇或环内酮等反应生成稳定的环。
生成环的过程中可能涉及质子转移、亲核进攻或电子转移等步骤。
2.条件选择性:周环反应的选择性很重要,可以通过选择合
适的底物和反应条件来控制产物的形成。
例如,选择合适的溶剂、温度和催化剂等,可以有针对性地调控反应路径和产物选择。
3.反应中间体:周环反应通常涉及中间体的形成和转化。
这
些中间体可以是环间反应的临时产物,也可以是稳定的中间体,作为进一步的转化物种。
4.共轭体系:周环反应中,共轭体系的存在非常常见,因为
这些体系具有较低的反应能垒和较高的稳定性。
共轭结构可以通过电子共轭、杂化轨道等方式形成,促进周环反应的进行。
需要注意的是,周环反应可以是非常复杂的,通常需要考虑多步反应和可能的副产物。
因此,具体的周环反应机理可能涉及多个中间体和反应步骤,需要通过实验和理论研究进行详
细的探索和确认。
总结起来,周环反应是一类有机化学反应,涉及到多环化合物的形成。
它们的机理可因反应类型和底物的不同而有所不同,通常涉及环化生成、条件选择性、反应中间体和共轭体系等方面。
详细的机理研究有助于理解和应用周环反应以合成所需的化合物。

周环反应机理
摘要:
1.周环反应的定义和特征
2.周环反应的理论基础
3.周环反应的分类和典型例子
4.周环反应的应用和研究进展
正文:
一、周环反应的定义和特征
周环反应(Pericyclic Reaction)是一类在反应过程中形成环状过渡态的协同反应。
这类反应具有以下特征:
1.多中心的一步反应:反应进行时键的断裂和生成是同时进行的(协同反应)。
2.反应进行的动力是加热或光照:不受溶剂极性影响,不被酸碱所催化,不受任何引发剂的引发。
3.反应有突出的立体选择性,生成空间定向产物。
二、周环反应的理论基础
周环反应的理论基础主要包括前线轨道法、能级相关法和芳香性过渡态概念。
1.前线轨道法:通过计算反应物和产物的前线轨道能级,判断反应的进行方向和速率。
2.能级相关法:通过对反应物和产物的能级进行分析,解释反应的立体选
择性和反应速率。
3.芳香性过渡态概念:在化学反应过程中,能形成环状过渡态的协同反应往往具有芳香性。
三、周环反应的分类和典型例子
周环反应可分为电环化反应和环加成反应。
典型的例子包括:
1.Diels-Alder 反应:这是一种典型的周环反应,由Diels 和Alder 于1928 年发现,是一种双烯烃与环戊二烯的加成反应。
2.电环化反应:这类反应涉及到电子的转移,如环戊二烯与氮气的反应。
3.环加成反应:这类反应涉及到两个或多个分子的加成,如蒽与亚胺的反应。
四、周环反应的应用和研究进展
周环反应在化学领域具有广泛的应用,如在有机合成、材料科学和生物化学等方面。
第十七章周环反应第一节周环反应的理论一周环反应1.定义:在最近的五十年里,有机化学家研究有机化学机理,主要有两种。
一种是游离基型反应,一种是离子型反应,它们都生成稳定或不稳定的中间体。
离子型或游离基型反应:反应物→中间体→产物另一种机理是,在反应中不形成离子或游离基的中间体,而认为是有电子重新组织经过四或六中心环的过渡态而进行的。
这类反应不受溶剂极性的影响,不被碱或酸所催化,没有发现任何引发剂对反应有什么关系。
这类反应似乎表明化学键的断裂和生成是同时发生的。
这种一步完成的多种心反应叫周环反应。
周环反应:反应物→产物2.周环反应的特征:①反应进行的动力,是加热或光照。
②反应进行时,有两个以上的键同时断裂或形成,是多中心一步反应。
③反应时作用物的变化有突出的立体选择性。
④在反应过渡态中原子排列是高度有序的。
二. 分子轨道理论几个原子轨道线性组合,形成几个分子轨道,比原子轨道能量低的为成键轨道,比原子轨道能量高的为反键轨道。
其电子填充符合Pauli原理和Hund规则。
σ轨道:Л轨道:丁二烯的分子轨道:镜面节面直链共轭多烯烃分子轨道特点:①节面数:若共轭多烯烃有几个原子,它的n个轨道就有n-1个节面。
②轨道的节面越多,能量越高。
③高一能级的轨道和低一能级的轨道的对称性是相反的。
④图中的共轭多烯烃的对称性都是指类顺型(像顺型)的。
三.前线轨道.福井认为最高的已占分子轨道(HOMO)上的电子被束缚得最松弛,最容易激发到能量最低的空轨道(LUMO)中去。
这些轨道是处于前线轨道(FMO),前线轨道理论认为:化学键的形成主要是由FMO的相互作用决定的。
分子的HOMO与LUMO 能量接近,容易组成新轨道。
第二节电环化反应1.定义:在n个Л电子的线型共轭体系中,在其两端点之间生成一个单键的反应及其逆过程称为电环化反应。
电环化反应中,多烯烃的一个Л键变成环烯烃里的一个σ键。
如:(Z,E)2,4-己二烯根据微观可逆性原则,正反应和逆反应所经过的途径是相同的。