探究酶的专一性..
- 格式:ppt
- 大小:1.06 MB
- 文档页数:26

探究酶的专一性酶相同底物不同的实验思路酶的专一性是指酶只对特定的底物具有催化能力,而对底物以外的化合物几乎没有催化能力。
今天,我们要探讨酶的专一性,一般将酶相同底物不同的实验思路分为以下几个方面:一、研究底物结构要探究酶相同底物不同,就必须先研究底物的结构。
因为不同的酶对底物的反应机制不同,所以对于相同的底物,酶的反应机制也很可能不同。
因此,如果我们想研究酶的专一性,首先要深入研究底物的结构,尤其是它们之间的特性(如酰基位等)。
二、研究不同酶分子之间的差异进一步,以不同的酶比较它们分子之间的差异,以帮助我们更好地探究酶的专一性。
也就是说,我们要研究酶的部位和结构对底物的反应有多大的影响。
另外,还需要研究酶分子结构所引起的电荷变化,以及不同酶中的可动性特性,促成它们在不同的底物上的反应活性差异。
三、比较不同酶的动力学性质此外,还要比较不同酶的动力学性质,来发现不同酶对不同底物的反应活性差异,并寻求机理解释。
研究不同酶动力学性质时,常用的数据有催化速率常数、活性常数等,它们可以帮助我们更准确地了解不同酶对底物催化反应的潜在差异。
四、采用结构分离技术此外,我们还可以利用结构分离技术,来揭示不同酶对不同底物的反应机制差异,比如通过电泳技术,将酶分子依其分子大小、电荷、溶解性等指标分离,在不同的浓度和pH值下进行分离研究,就能获得更多的有价值的信息,用以发掘不同酶对不同底物的反应机制差异。
通过以上几个方面的研究,我们就能更好地解析酶的专一性,以更多的实验数据来支持我们的结论。
因此,为了探究酶相同底物不同的实验思路,我们可以从以上几个方面着手,来更好地揭示酶的专一性,并从中发现有价值的研究意义。

第1篇一、实验目的通过本实验,了解酶的催化作用特性,包括酶的专一性、高效性、温度和pH值对酶活力的影响,以及酶的激活剂和抑制剂对酶活力的作用。
通过对酶特性的研究,进一步掌握酶在生物体内的作用及其调控机制。
二、实验材料1. 实验材料:- 酶提取液(如唾液淀粉酶、蛋白酶、脂肪酶等)- 底物溶液(如淀粉溶液、蛋白质溶液、脂肪溶液等)- pH缓冲液(不同pH值的缓冲液)- 温度控制装置(恒温水浴)- pH计- 显微镜- 试管、试管架、滴管、移液器等2. 试剂:- 碘液- 斐林试剂- 班氏试剂- 激活剂(如金属离子)- 抑制剂(如竞争性抑制剂、非竞争性抑制剂)三、实验方法1. 酶的专一性检验:- 将酶提取液与底物溶液混合,观察酶催化底物反应的现象。
- 使用不同底物进行对比实验,验证酶的专一性。
2. 酶的高效性检验:- 将酶提取液与底物溶液混合,观察酶催化底物反应的现象。
- 使用相同底物,将酶提取液与无机催化剂(如FeCl3)进行对比实验,验证酶的高效性。
3. 温度对酶活力的影响:- 将酶提取液与底物溶液混合,在不同温度下进行反应。
- 观察酶催化底物反应的现象,分析温度对酶活力的影响。
4. pH值对酶活力的影响:- 将酶提取液与底物溶液混合,在不同pH值下进行反应。
- 观察酶催化底物反应的现象,分析pH值对酶活力的影响。
5. 激活剂和抑制剂对酶活力的影响:- 在酶提取液和底物溶液中分别加入激活剂和抑制剂。
- 观察酶催化底物反应的现象,分析激活剂和抑制剂对酶活力的影响。
四、实验结果与分析1. 酶的专一性检验:- 通过实验观察,酶提取液在特定底物存在下表现出催化作用,而在其他底物上无催化作用,证明酶具有专一性。
2. 酶的高效性检验:- 通过实验观察,酶提取液在催化底物反应时,反应速度明显快于无机催化剂,证明酶具有高效性。
3. 温度对酶活力的影响:- 通过实验观察,酶催化底物反应的速度随温度升高而加快,在一定温度范围内,酶活力达到最大值,超过此温度,酶活力逐渐降低。

酶的专一性的实验报告酶的专一性的实验报告引言:酶是生物体内一类极为重要的蛋白质催化剂,它在生物体内参与了许多代谢反应的进行。
酶的专一性是指酶对于特定底物的选择性反应能力。
本实验旨在通过观察不同酶对不同底物的反应,探究酶的专一性及其在生物体内的重要作用。
实验材料与方法:1. 实验材料:- 玉米淀粉溶液- 青枣淀粉溶液- 红薯淀粉溶液- 蛋白酶溶液- 淀粉酶溶液- 淀粉试纸- 碘液- 试管- 显微镜2. 实验方法:1) 取三个试管,分别加入玉米淀粉溶液、青枣淀粉溶液和红薯淀粉溶液。
2) 在每个试管中加入适量的蛋白酶溶液。
3) 将三个试管放置在恒温水浴中,保持温度恒定。
4) 每隔一段时间,取出一滴反应液,加入淀粉试纸。
5) 观察淀粉试纸的颜色变化,并记录下来。
6) 最后,在每个试管中加入碘液,观察颜色变化。
7) 使用显微镜观察淀粉颗粒的形态变化。
实验结果与讨论:通过实验观察,我们发现:- 玉米淀粉溶液在加入蛋白酶溶液后,淀粉试纸的颜色逐渐变浅,表明淀粉被分解。
- 青枣淀粉溶液在加入蛋白酶溶液后,淀粉试纸的颜色变化不明显,表明淀粉未被分解。
- 红薯淀粉溶液在加入蛋白酶溶液后,淀粉试纸的颜色变化不明显,表明淀粉未被分解。
进一步观察淀粉试纸颜色变化后,我们对实验结果进行了分析和讨论:- 玉米淀粉溶液中的淀粉被蛋白酶分解,导致淀粉试纸颜色变浅。
这是因为蛋白酶对玉米淀粉具有专一性,能够特异地与玉米淀粉结合并催化其分解。
- 青枣淀粉溶液和红薯淀粉溶液在加入蛋白酶溶液后,淀粉试纸的颜色变化不明显。
这可能是因为蛋白酶对青枣淀粉和红薯淀粉的专一性较低,无法与其特异结合并催化分解。
此外,我们还通过显微镜观察了淀粉颗粒的形态变化。
在玉米淀粉溶液中,淀粉颗粒逐渐变小,甚至完全消失;而在青枣淀粉溶液和红薯淀粉溶液中,淀粉颗粒的形态基本未发生明显变化。
这也进一步证实了酶对不同底物的专一性。
结论:通过本实验,我们验证了酶的专一性。

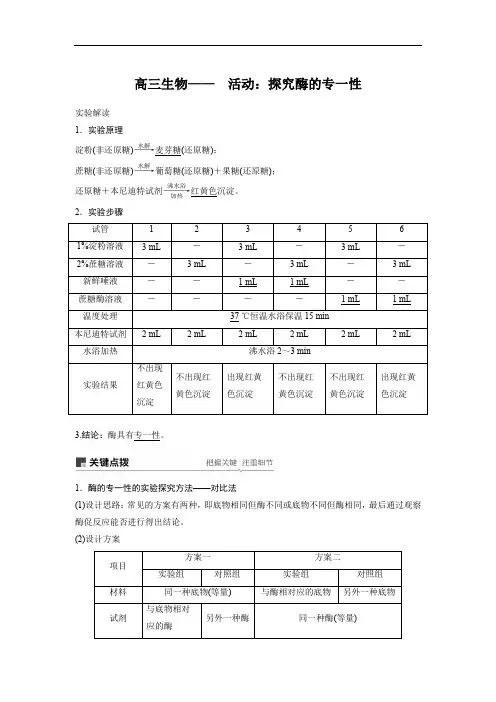
高三生物——活动:探究酶的专一性实验解读 1.实验原理淀粉(非还原糖)――→水解麦芽糖(还原糖);蔗糖(非还原糖)――→水解葡萄糖(还原糖)+果糖(还原糖); 还原糖+本尼迪特试剂―――→沸水浴加热红黄色沉淀。
2.实验步骤试管 1 2 3 4 5 6 1%淀粉溶液 3 mL - 3 mL - 3 mL - 2%蔗糖溶液 - 3 mL - 3 mL - 3 mL 新鲜唾液 - - 1 mL 1 mL - - 蔗糖酶溶液 ----1 mL1 mL温度处理 37 ℃恒温水浴保温15 min 本尼迪特试剂 2 mL2 mL2 mL2 mL2 mL2 mL水浴加热沸水浴2~3 min 实验结果不出现红黄色沉淀不出现红黄色沉淀出现红黄色沉淀不出现红黄色沉淀不出现红黄色沉淀出现红黄色沉淀3.结论:酶具有专一性。
1.酶的专一性的实验探究方法——对比法(1)设计思路:常见的方案有两种,即底物相同但酶不同或底物不同但酶相同,最后通过观察酶促反应能否进行得出结论。
(2)设计方案项目 方案一方案二实验组对照组实验组 对照组 材料 同一种底物(等量) 与酶相对应的底物另外一种底物试剂与底物相对应的酶另外一种酶同一种酶(等量)现象发生反应不发生反应发生反应不发生反应结论酶具有专一性酶具有专一性2.变量分析(1)自变量:不同底物或不同酶液。
(2)因变量:底物是否被分解或有无产物生成。
(3)无关变量:试剂量、反应温度、pH等。
命题点一实验原理、步骤和现象1.(2019·浙江稽阳联考)下表为“探究酶的专一性”的实验数据,下列相关叙述正确的是()试管123456本尼迪特试剂/mL2222221%淀粉溶液/mL3\3\3\2%蔗糖溶液/mL\3\3\3新鲜唾液/mL\\11\\蔗糖酶溶液/mL\\\\11实验结果A.1%淀粉溶液中含有一定量的氯化钠B.按表格将各种溶液分别加入6只试管后,再共同保温一段时间C.试管3有红黄色沉淀产生,说明有葡萄糖生成D.若5号试管出现轻度阳性反应,不可能是淀粉溶液中有杂质答案A解析氯离子为唾液淀粉酶的激活剂,所以1%淀粉溶液中含有一定量的氯化钠,A正确;本尼迪特试剂需要在酶促反应完成后加入,过早加入可能会对酶活性造成影响,从而影响实验结果,B错误;利用本尼迪特试剂能检测出试管3有还原糖生成,但不能确定就是葡萄糖,C错误;5号试管出现红黄色沉淀的原因,可能是淀粉溶液中有还原糖类杂质,D错误。

酶的专一性实验报告一、实验目的本实验旨在探究酶的专一性,即一种酶只能催化一种或一类化学反应的特性。
通过实验,观察酶对不同底物的作用情况,验证酶的专一性原理,并加深对酶的催化作用的理解。
二、实验原理酶是生物体内具有催化作用的蛋白质或 RNA 分子。
它们能够降低化学反应的活化能,从而加速反应的进行。
酶的专一性是指酶对底物具有严格的选择性,只作用于特定的底物,产生特定的产物。
本实验选用唾液淀粉酶作为研究对象,以淀粉和蔗糖为底物。
唾液淀粉酶能够催化淀粉水解为麦芽糖和葡萄糖,但不能催化蔗糖的水解。
通过检测反应产物的生成,可以判断酶的专一性。
三、实验材料与仪器1、材料新鲜唾液质量分数为 2%的淀粉溶液质量分数为 2%的蔗糖溶液斐林试剂(甲液:质量浓度为 01g/mL 的 NaOH 溶液;乙液:质量浓度为 005g/mL 的 CuSO4 溶液)热水浴装置2、仪器试管滴管量筒烧杯四、实验步骤1、制备唾液淀粉酶溶液漱口后,含一口清水,在口腔内保持 1-2 分钟,然后将唾液吐入小烧杯中备用。
2、分组与设置对照实验取 3 支洁净的试管,编号为 1、2、3。
向 1 号试管中加入 2mL 淀粉溶液,向 2 号试管中加入 2mL 蔗糖溶液,向 3 号试管中加入 1mL 淀粉溶液和 1mL 蔗糖溶液。
3、加入唾液淀粉酶溶液向 1 号和 2 号试管中分别加入 2mL 唾液淀粉酶溶液,轻轻振荡,使其混合均匀。
向 3 号试管中加入 2mL 唾液淀粉酶溶液,轻轻振荡。
4、反应一段时间将 3 支试管置于 37℃的温水浴中,保温 15 分钟。
5、检测反应产物取出试管,分别向 1、2、3 号试管中加入 2mL 斐林试剂,轻轻振荡,使其混合均匀。
将 3 支试管放入热水浴中加热 2-3 分钟,观察溶液颜色的变化。
五、实验结果与分析1、实验结果1 号试管中出现砖红色沉淀,说明淀粉被唾液淀粉酶水解产生了还原性糖(麦芽糖和葡萄糖)。
2 号试管中未出现砖红色沉淀,说明蔗糖未被唾液淀粉酶水解,没有产生还原性糖。
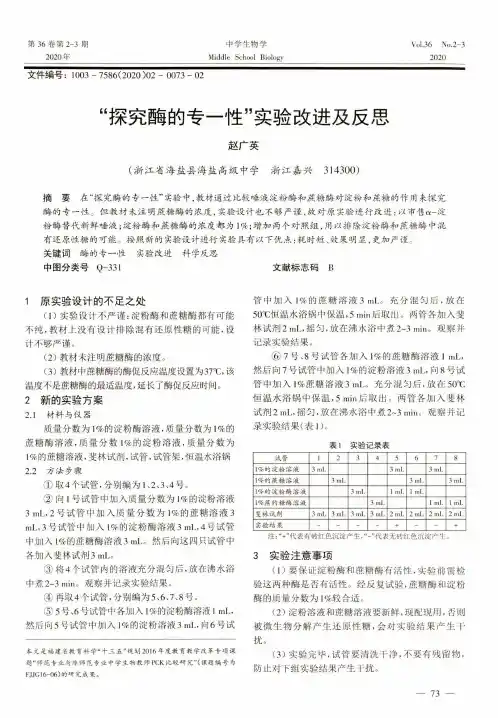
第36卷第2-3期2020 年中学生物学Middle School BiologyVol.36 No.2-32020文件编号:1003 - 7586(2020 )02 - 0073 - 02“探究酶的专一性”实验改进及反思赵广英(浙江省海盐县海盐高级中学浙江嘉兴314300)摘要在“探究酶的专一性”实验中,教材通过比较唾液淀粉酶和蔗糖酶对淀粉和蔗糖的作用来探究酶的专一性。
但教材未注明蔗糖酶的浓度,实验设计也不够严谨,故对原实验进行改进:以市售a -淀 粉酶替代新鲜唾液;淀粉酶和蔗糖酶的浓度都为1%;增加两个对照组,用以排除淀粉酶和蔗糖酶中混 有还原性糖的可能。
按照新的实验设计进行实验具有以下优点:耗时短、效果明显,更加严谨,3 关键词酶的专一性实验改进科学反思中图分类号Q -331文献标志码B1原实验设计的不足之处(1)实验设计不严谨:淀粉酶和蔗糖酶都有可能不纯,教材上没有设计排除混有还原性糖的可能,设计不够严谨。
(2) 教材未注明蔗糖酶的浓度。
(3)教材中蔗糖酶的酶促反应温度设置为37T ,该温度不是蔗糖酶的最适温度,延长了酶促反应时间。
2新的实验方案2.1材料与仪器质量分数为1%的淀粉酶溶液,质量分数为1%的 蔗糖酶溶液,质量分数1%的淀粉溶液,质量分数为 1%的蔗糖溶液,斐林试剂,试管,试管架,恒温水浴锅2.2 方法步骤① 取4个试管,分别编为1、2、3、4号。
② 向1号试管中加入质量分数为1%的淀粉溶液 3 mL, 2号试管中加入质量分数为1%的蔗糖溶液3m L,3号试管中加入1%的淀粉酶溶液3m L,4号试管中加入1%的蔗糖酶溶液3 m L。
然后向这四只试管中各加入斐林试剂3 mL。
③将4个试管内的溶液充分混匀后,放在沸水浴中煮2~3 m i n 。
观察并记录实验结果。
④ 再取4个试管,分别编为5、6、7、8号。
⑤5号、6号试管中各加入1%的淀粉酶溶液1 m L , 然后向5号试管中加入1%的淀粉溶液3 mL,向6号试本文是福建省教育科学“十三五”规划2016年度教育教学改革专项课 题“师范专业与非师范专业中学生物教师P C K 比较研究”(课题编号为F J JG 16-06)的研究成果。


酶的专一性的实验报告篇一:实验一酶的专一性实验实验一酶的专一性实验实验原理淀粉在唾液淀粉酶的催化作用下,能够水解成麦芽糖。
在煮沸的条件下,斐林试剂能使麦芽糖氧化,自身还原成砖红色的氧化亚铜沉淀。
因此,斐林试剂可以用来鉴定溶液中是否有麦芽糖,进而可以看出唾液淀粉酶是否只能催化淀粉水解,不能催化其他糖类(如蔗糖)水解。
H的要求1 (初步学会做酶的专一性实验的方法。
2(理解酶具有专一性的特点。
材料用具新鲜的唾液。
消过毒的脱脂棉,镶子,试管,小烧杯,量简,玻璃棒,酒精灯,火柴。
可溶性淀粉的质量分数为州的溶液?,蔗糖的质量浓度为3g, InL(克每毫升的溶液,斐林试剂,清水。
方法步骤1(用清水将口漱净,口内含一块消过毒的脱脂棉。
用银子取出脱脂棉,使其中的唾液收集到小烧杯中。
2(取3mL唾液,注入另一个小烧杯中,加入30mL蒸憎水,用玻璃棒搅匀,制成稀释的唾液备用。
1(取两支洁净的试管,编号,按下表加入试剂:3%淀粉溶液2mL —3%蔗糖溶液一2mL2%淀粉酶溶液2mL 2mL摇匀,37?保温5 min斐林试剂2mL 2mL摇匀,100?保温3 min现象砖红蓝色现象分析结论讨论:1、两次保温的U的各是什么,2、你认为这样设讣检测酶专一性的实验完善了吗,还应有哪些改进才能使之更完善,3、设计一个鉴定蔗糖酶专一性的实验。
结论篇二:10探究酶的专一性探究酶的专一性一、教学目标比较唾液淀粉酶和蔗糖酶对淀粉和蔗糖的作用。
二、实验原理含有自山醛基或酮基的单糖和双糖叫还原性糖。
在碱性溶液中,还原糖能将金属离子(铜、钮、汞、银等)还原,糖本身被氧化成酸性化合物。
此性质常用于检验糖的还原性,并且常称为测定还原糖含量的各种方法的依据。
还原糖与碱性硫酸铜可生成砖红色沉淀物。
本尼迪特试剂内含有硫酸铜,因此淀粉水解生成的麦芽糖和蔗糖水解生成的葡萄糖、果糖等还原糖在煮沸的条件下,与本尼迪特试剂会有砖红色沉淀物产生,淀粉和蔗糖(非还原糖)无此反应。

酶的专一性实验分析各试管颜色变化原因为了研究酶的专一性,可以进行专一性实验。
在实验中,选择一种特定的底物和一种酶,并观察试管中的颜色变化。
根据颜色变化可以初步判断酶对于该底物的催化效果,从而分析酶的专一性。
在专一性实验中,试管中发生颜色变化的原因主要有以下几种:1.酶催化反应导致底物的结构改变:底物在酶催化下经历一系列的化学反应,可能发生结构改变,从而导致颜色的变化。
例如,在酶催化下,一些底物会氧化还原反应,形成带有颜色的产物。
2.酶本身具有色素:有些酶本身就含有色素,因此与底物发生反应后,试管中的颜色会发生变化。
这种情况下,颜色的变化与底物的反应无关,而是由于酶本身的色素导致的。
3.酶的活性变化导致底物的反应速率变化:一些酶在特定条件下对不同底物的催化效果有差异。
因此,试管中的颜色变化可能是由于酶的活性变化导致底物的反应速率变化而引起的。
4.试剂或环境条件的改变引起的反应:有些试剂或环境条件的改变可以影响酶与底物的相互作用,从而导致试管中颜色的变化。
例如,pH、温度、离子浓度等的变化都可以影响酶催化反应的进行。
需要注意的是,试管中颜色的变化只是初步判断酶的专一性的一种方法,不能作为唯一的依据。
为了更加准确地判断酶的专一性,还需要结合其他实验数据和分析方法,如酶动力学研究、分子生物学技术等。
总之,酶的专一性实验中试管中颜色的变化主要是由于酶催化反应导致底物的结构改变、酶本身具有色素、酶的活性变化导致底物的反应速率变化以及试剂或环境条件的改变引起的反应等原因。
这些变化可以帮助我们初步判断酶对于底物的选择性,进一步分析酶的专一性以及酶催化机理的研究。

酶的专一性实验报告酶的专一性实验报告引言:酶是一类生物催化剂,能够加速化学反应的进行,而不被消耗。
酶具有高度的专一性,即只对特定的底物起作用。
本实验旨在探究酶的专一性,并通过实验验证酶对底物的选择性。
实验材料和方法:实验所需材料包括:淀粉溶液、淀粉酶溶液、葡萄糖试剂、碘酒、试管、试管架、显微镜等。
实验步骤如下:1. 准备试管,标记为A、B、C。
2. 在试管A中加入淀粉溶液。
3. 在试管B中加入淀粉溶液和淀粉酶溶液。
4. 在试管C中加入淀粉溶液和葡萄糖试剂。
5. 将试管A和B放入恒温水浴中,保持温度恒定。
6. 分别在试管A、B和C中加入碘酒,观察颜色变化。
7. 使用显微镜观察试管A和B中的淀粉颗粒。
结果与讨论:通过观察实验结果,我们可以得出以下结论:1. 在试管A中,淀粉溶液与碘酒反应后呈现蓝黑色,表明淀粉存在。
2. 在试管B中,淀粉溶液与淀粉酶溶液反应后,颜色变为红褐色,表明淀粉酶催化了淀粉的降解。
3. 在试管C中,淀粉溶液与葡萄糖试剂反应后,颜色变为橙黄色,表明淀粉被转化为葡萄糖。
从实验结果可以看出,淀粉酶对淀粉具有专一性,能够催化淀粉的降解,而对其他底物如葡萄糖则无作用。
这说明酶对底物的选择性是由其空间构象和活性位点的特定结构所决定的。
此外,通过显微镜观察试管A和B中的淀粉颗粒,可以发现试管B中的淀粉颗粒明显减少,而试管A中的淀粉颗粒基本未变。
这进一步证明了淀粉酶对淀粉的降解作用。
实验结果的验证和应用:为了验证实验结果的准确性,我们可以进行对照实验。
在对照实验中,可以将试管B中的淀粉酶溶液替换为其他酶溶液,如蛋白酶溶液或脂肪酶溶液。
观察结果发现,只有淀粉酶能够催化淀粉的降解,其他酶对淀粉没有作用。
酶的专一性在生物学和医学领域有着广泛的应用。
通过研究酶的专一性,可以深入了解生物催化的机制,为药物研发和生物工程提供指导。
例如,通过研究特定酶对特定底物的选择性,可以设计出高效的药物靶向传递系统,减少药物对健康组织的损害;还可以利用酶的专一性,开发出高效的酶工程方法,用于生物催化合成和废水处理等领域。
酶的专一性一、实验目的学习酶专一性的测定方法。
二、实验技能掌握移液管的规范操作。
三、实验原理酶与一般催化剂最主要的区别之一是酶具有高度的特异(专一)性,即一种酶只能对一种或一类化合物起催化作用。
例如,淀粉酶和蔗糖酶虽然都催化糖昔键的水解,但是淀粉酶只对淀粉起作用,蔗糖酶只水解蔗糖。
还原糖产物可用本乃狄试剂鉴定。
四、实验器材(1)唾液淀粉酶溶液:先用蒸馏水漱口,再含10ml左右蒸馏水,轻轻漱动,数分钟后吐出收集在烧杯中,用数层纱布或棉花过滤,即得清彻的唾液淀粉酶原液根据酶活高低稀释50~100倍,即为唾液淀粉酶溶液。
(2)蔗糖酶溶液:取1g鲜酵母或干酵母放入研钵中,加入少量石英砂和水研磨,加50ml 蒸馏水,静置片刻,过滤即得。
(3)2%蔗糖溶液:用分析纯蔗糖新鲜配制。
(4)1%淀粉溶液:1g淀粉和0.3g NaCI,用5ml蒸馏水悬浮,慢慢倒入60ml煮沸的蒸馏水中,煮沸lmin,冷却至室温,加水到100ml,冰箱贮存。
(5)0.1%淀粉溶液:0.1g淀粉,以5ml水悬浮,慢慢倒入60ml煮沸的蒸馏水中,煮沸lmin,冷却至室温,加水到100ml,冰箱贮存。
6)本乃狄(Benedict)试剂:17.3g CuSO4·5H2O,加100ml蒸馏水加热溶解,冷却;173g 柠檬酸钠和100g NaCO3·2H2O,以600ml蒸馏水加热溶解,冷却后将CuSO4溶液慢慢加到柠檬酸钠-碳酸钠溶液中,边加边搅匀,最后定容至1000ml。
如有沉淀可过滤除去,此试剂可长期保存。
五、实验步骤取6支干净试管,按下表操作:1,4号试管产生砖红色沉淀,其它试管不产生砖红色沉淀。
淀粉酶对淀粉有催化作用,对蔗糖没有催化作用,酶的催化具有专一性。
七、实验体会。
酶的专一性的实验报告
本实验室根据具体要求进行了酶的专一性实验,报告结论如下:
首先,我们采用试管实验来进行研究,表明该酶具有良好的专一性。
以下是研究结果:
1.酶对于给定的底物反应有很好的特异性。
我们在反应实验中发现,当酶和底物在一
起反应时,只有底物的反应产物的形成,而没有其他物质的产生;
2.本实验还考察了该酶对于非底物的反应。
当添加非底物(其他物质)时,该酶无反应,甚至最终溶液中没有明显发生变化;
3.反应温度也有明显的影响。
在较低温度适宜反应,只有在此温度下,底物和酶发生
反应。
当温度过高时,酶的活性会受到削弱,所以在反应过程中不产生任何反应;
4.本实验还考察了该酶的pH选择性,结果显示该酶对最适宜的pH的选择性很好,在
该pH值范围内,只有在较低的pH比较适宜的条件下,反应才可以正常进行。
而超出此范围,则不会有此效果。
综上所述,本实验室针对该酶进行了多种反应条件的实验,该酶表现出良好的专一性,对于最适宜的反应条件有很好的选择性,且有较高的灵敏度,基本满足实验要求。
酶的专一性实验报告一、引言酶是一类具有特异性的生物催化剂。
它们可以加速化学反应的速率而不参与反应本身。
酶的专一性是指酶对于特定底物具有高度选择性。
在这个实验中,我们将探究酶的专一性,并通过具体的实验设计和结果来验证这一特性。
二、材料与方法1. 实验材料:牛乳、牛乳分蛋白、水解酶、试管、小瓶、定量移液器、显色液等。
2. 实验步骤a. 准备不同浓度的酶溶液。
b. 准备牛乳和牛乳分蛋白的溶液。
c. 在多个试管中加入不同浓度的酶溶液。
d. 分别向各试管中加入牛乳和牛乳分蛋白溶液。
e. 让反应体系在恒温水浴中反应一定时间。
f. 加入显色液,观察和记录颜色的变化。
三、结果与分析通过实验我们观察到,当不同浓度的酶溶液与牛乳反应时,颜色的深浅与酶的浓度成正比。
而当酶溶液与牛乳分蛋白反应时,颜色的深浅与酶的浓度无明显关系。
这表明酶对于牛乳和牛乳分蛋白的反应具有不同的特性,即酶对于特定底物具有高度的专一性。
四、讨论与结论酶的专一性是由酶与底物之间的特异性相互作用所决定的。
酶分子表面的活性位点可以与底物分子特定的结构进行结合。
在本实验中,酶与牛乳中的某一成分发生特定的反应,导致颜色产生变化。
而对于牛乳分蛋白这一底物,酶无法与之发生特定的反应,因此颜色的变化不明显。
酶的专一性不仅仅是与底物的结构相互适配,还与酶分子的空间构象密切相关。
酶的活性位点的三维结构决定了酶能够识别和结合特定的底物。
因此,尽管酶可以催化多种化学反应,但其专一性使得它们对特定底物有更高的亲和性。
酶的专一性在生物体内具有重要的生理功能,如消化酶对不同种类的食物进行分解。
此外,专一性也在工业生产中得到广泛应用,通过研究酶的专一性可以开发出更高效的催化剂,从而降低生产成本和环境污染。
综上,酶的专一性是其作为生物催化剂的重要特性之一。
通过我们的实验,我们验证了酶对特定底物的选择性,为进一步研究酶的机理和应用提供了基础。
五、参考文献1. Berg JM, Tymoczko JL, Gatto GJ. Stryer L. Biochemistry. 8th edition. W.H. Freeman and Company, 2015.2. Nelson DL, Cox MM. Lehninger Principles of Biochemistry. 7th edition. W.H. Freeman and Company, 2017.3. Voet D, Voet JG, Pratt CW. Fundamentals of Biochemistry: Life at the Molecular Level. 5th edition. Wiley, 2016.。
《探究酶的专一性》的说课稿江西省玉山县樟村中学童长春各位评委老师、各位同仁大家早上好,今天我说课的实验题目是《探究酶的专一性》,下面我将从教材分析、学情分析、实验教学方法、实验教学过程、实验教学反思及自我评价这六个方面进行我的说课。
一、说教材分析(一)、课程的地位和作用:“酶的专一性”是人教版《(必修1)》分子与细胞第五单元第一节的内容。
本节内容是在“酶的作用和本质”的基础上,进一步理解酶的特性,理解实验探究方案设计原则及变量的控制,。
同时参阅江西省生物教学课程标准和考纲要求,设定本课的重点是建构酶的特性知识体系,进一步探究酶的专一性;难点是如何进行酶的专一性的实验创新设计与实施。
(二)、实验教学目标。
依据新课标要求,本着体现提高学生的科学素养、提倡合作探究的理念,培养学生实验探索的能力,提高学生发现问题、分析问题、解决问题的能力,确定以下目标:1、知识与能力概述酶的特性的知识体系。
通过学生主动参与科学探究的实验活动,掌握科学探究的程序和方法,理解探究性实验设计的基本原则,培养学生创造性思维的能力和动手实践的能力。
2、过程与方法目标本课设计的基本模式就是:教师引导——合作交流——创新方案——实验探究——精讲点拨——拓展延伸。
3、情感态度和价值观目标通过对酶的专一性的探究性实验,培养学生崇尚科学的态度和实事求是的精神。
培养学生敢于质疑,科学严谨的意志品质和勇于创新的精神。
二、学情分析高一学生已具备了以下与本节学习相关的知识和技能:①在初中阶段学习了多种消化酶在食物消化中的作用,并且做了“观察唾液淀粉酶对淀粉有消化作用”的实验。
②通过上节课对“酶的高效性”的学习,初步掌握了对照实验的设计与操作方法、自变量和无关变量的分析与控制方法。
然而,学生对于课本实验进行进一步改进的实验方案设计以及具体实验操作细节上,还有较大的不足。
三、说实验教学方法通过教材和学情分析,要高效的完成教学目标,我将采取“引导—探究式”教学法。
酶的专一性的实验报告
《探究酶的专一性:实验报告》
摘要:
本实验旨在探究酶的专一性,通过对不同底物和酶的反应进行观察和测定,以
验证酶对特定底物的专一性。
实验结果表明,酶对特定底物具有较高的专一性,这为我们深入了解酶的功能和应用提供了重要参考。
引言:
酶是生物体内一类重要的蛋白质,能够催化生物体内的化学反应,促进代谢过
程的进行。
酶的专一性是指酶对特定底物的选择性,即特定的酶只能催化特定
的底物。
本实验旨在通过实验验证酶的专一性,深入探究酶的功能和应用。
材料与方法:
1. 准备不同种类的酶和底物溶液。
2. 将不同种类的酶和底物溶液分别加入试管中。
3. 在一定时间内观察和记录反应的变化。
4. 使用比色法或其他测定方法测定反应产物的生成量。
结果与讨论:
经过实验观察和测定,我们发现不同种类的酶对特定的底物具有较高的专一性。
例如,脂肪酶只能催化脂肪的水解反应,而淀粉酶只能催化淀粉的水解反应。
这表明酶在生物体内具有精准的选择性,能够高效地催化特定的生物化学反应。
这一结论对于深入了解酶的功能和应用具有重要意义。
结论:
本实验验证了酶对特定底物的专一性,为我们深入了解酶的功能和应用提供了
重要参考。
酶的专一性不仅在生物体内起着重要作用,也为酶在工业生产和生物技术领域的应用提供了理论基础。
希望本实验结果能够为相关领域的研究和应用提供有益的启示。
酶的专一性实验报告酶是一种生物催化剂,它可以加速生物化学反应的速率。
酶的专一性指的是酶对某些特定底物的选择性,也就是只能催化特定类型物质的转化反应。
这种特性使得酶在工业、医药等领域有着重要应用价值。
本文将围绕酶的专一性展开实验探究。
实验过程:为了考察酶的专一性,我们选择用木瓜蛋白酶来进行实验。
在实验室准备好酶的反应物和试剂后,我们分别以木瓜蛋白酶和几种不同的底物进行反应,包括蛋白质、糖类和脂质等。
具体实验步骤如下:1. 制作反应液:将制备好的酶底物分别计量放入试管中,并加入适量的缓冲液进行混合均匀。
2. 加入酶:在反应液中依次滴加适量的木瓜蛋白酶,并用洗涤纯水进行稀释,最后在75度下进行培养。
3. 取样:依次在反应液反应后的不同时间取一定量的样品,在120度下进行灭酶,然后用试剂进行反应显色。
4. 录取结果:通过对反应液进行可视化检测,我们得到了不同底物在酶作用下的反应程度,从而得出酶的专一性。
实验结果:实验中我们得到了较为明显的结果,通过对多种底物反应的记录与观察,我们可以发现木瓜蛋白酶的专一性和活性在不同底物下的表现存在较大的差异。
在蛋白质底物下,木瓜蛋白酶表现出较为活跃的酶活性,可以使底物的反应快速进行。
而在糖类和脂质底物下,木瓜蛋白酶的活性较低,难以使底物被快速转化。
此外,我们还得到了一个有趣的发现,即在同种底物下,不同来源的酶表现出的专一性有所不同。
比如,不同生产商的木瓜蛋白酶呈现出了不同的酶活性,这说明酶的专一性是由其本身的结构性质和生产过程等多种因素共同决定的。
实验结论:通过对酶的专一性的研究,我们可以发现酶的选择性是一种非常重要的理化性质。
这种特性使酶能够在特定的反应路径中起到催化反应的作用,从而成为许多工业和生物医学领域的重要催化剂。
探究酶的专一性对于揭示酶的催化机理和优化酶的性能等都有着重要的意义。
本次实验结果表明,木瓜蛋白酶的专一性是由其本身的结构、环境因素以及反应底物的特性等多个因素共同作用的结果。