酶的本质、特性及相关实验探究
- 格式:ppt
- 大小:1.09 MB
- 文档页数:26


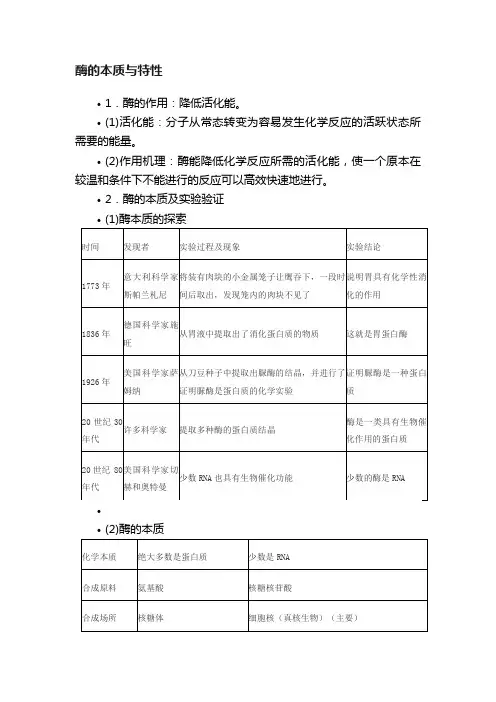
酶一、酶的本质:酶是由活细胞产生的具有催化活性和高度选择性的特殊蛋白质。
按其组成的不同,将酶分成单纯蛋白质和结合蛋白质两大类。
例如,大多数水解酶属单纯由蛋白质组成的酶; 黄素单核苷酸酶则属由酶蛋白和辅助因子组成的结合蛋白酶。
结合蛋白质中的酶蛋白为蛋白质部分,辅助因子为非蛋白质部分,两者结合成全酶,只有全酶才有催化活性二、酶的形态结构所有的酶都含有C、H、O、N四种元素。
按照酶的化学组成可将酶分为单纯酶和复合酶两类。
单纯酶分子中只有氨基酸残基组成的肽链。
结合酶分子中则除了多肽链组成的蛋白质,还有非蛋白成分,如金属离子、铁卟啉或含B 族维生素的小分子有机物。
结合酶的蛋白质部分称为酶蛋白,非蛋白质部分统称为辅助因子(cofactor),两者一起组成全酶;只有全酶才有催化活性,如果两者分开则酶活力消失。
非蛋白质部分如铁卟啉或含B族维生素的化合物若与酶蛋白以共价键相连的称为辅基(prosthetic group),用透析或超滤等方法不能使它们与酶蛋白分开;反之两者以非共价键相连的称为辅酶(coenzyme),可用上述方法把两者分开。
辅助因子有两大类,一类是金属离子,且常为辅基,起传递电子的作用;另一类是小分子有机化合物,主要起传递氢原子、电子或某些化学基团的作用。
结合酶中的金属离子有多方面功能,它们可能是酶活性中心的组成成分;有的可能在稳定酶分子的构象上起作用;有的可能作为桥梁使酶与底物相连接。
辅酶与辅基在催化反应中作为氢(H+和e)或某些化学基团的载体,起传递氢或化学基团的作用。
体内酶的种类很多,但酶的辅助因子种类并不多,常见到几种酶均用某种相同的金属离子作为辅助因子的例子,同样的情况亦见于辅酶与辅基,如3-磷酸甘油醛脱氢酶和乳酸脱氢酶均以NAD+作为辅酶。
酶催化反应的特异性决定于酶蛋白部分,而辅酶与辅基的作用是参与具体的反应过程中氢(H+和e)及一些特殊化学基团的运载。
酶属生物大分子,分子质量至少在1万以上,大的可达百万。

酶的特性实验报告酶是一类生物催化剂,能够加速生物体内化学反应的进行,而不参与反应本身。
酶在生物体内起着至关重要的作用,因此对酶的特性进行深入研究具有重要意义。
本实验旨在通过对酶的特性进行实验研究,了解酶的特性及其影响因素,为进一步探究酶的作用机制提供实验数据支持。
首先,我们选择了过氧化氢酶作为研究对象。
过氧化氢酶是一种常见的酶类,在生物体内起着重要的氧化还原作用。
通过对过氧化氢酶的特性进行实验研究,可以更好地理解酶的作用机制。
实验一,酶的最适温度。
我们首先对过氧化氢酶在不同温度下的活性进行了测定。
实验结果显示,过氧化氢酶在37摄氏度时的活性最高,随着温度的升高或降低,酶的活性均会显著下降。
这表明过氧化氢酶的最适温度为37摄氏度,这也与人体内部的温度相符合。
实验二,酶的最适pH值。
接着,我们对过氧化氢酶在不同pH值下的活性进行了测定。
实验结果显示,过氧化氢酶在pH为7时的活性最高,而在酸性或碱性条件下,酶的活性均会显著下降。
这表明过氧化氢酶的最适pH值为7,也就是中性条件下。
实验三,酶的受抑制剂作用。
最后,我们研究了过氧化氢酶在不同受抑制剂作用下的活性变化。
实验结果显示,某些受抑制剂可以显著抑制过氧化氢酶的活性,而另一些受抑制剂则对酶的活性影响不大。
这表明过氧化氢酶的活性受到特定受抑制剂的影响,这对于进一步研究酶的作用机制具有重要意义。
综上所述,通过对过氧化氢酶的特性进行实验研究,我们深入了解了酶的最适温度、最适pH值以及受抑制剂的作用。
这些研究结果为我们进一步探究酶的作用机制提供了重要的实验数据支持,也为生物医学领域的研究提供了重要参考。
希望通过我们的努力,能够更好地揭示酶的奥秘,为人类健康和生命科学研究做出更大的贡献。
酶的本质与特性被分解;实验组:反应物+等量的相应酶溶液检测反应物被分解。
•2.酶的专一性实验搽究此实验中的自变量可以是不同反应物,也可以是不同酶溶液,因变量是反应物是否被分解。
•(1)设计思路一:换反应物不换酶•实验组:反应物+相应酶溶液检测反应物被分解;•对照组:另一反应物+等量相同酶溶液检测反应物不被分解。
•(2)设计思路二:换酶不换反应物•实验组:反应物+相应酶溶液检测反应物被分解;•对照组:相同反应物+等量另一种酶溶液检测反应物不被分解。
•3.酶的高效性实验探究•对照组:反应物+无机催化剂检测底物分解速率;•实验组:反应物+等量酶溶液检测底物分解速率。
•实验中自变量是无机催化剂和酶,因变量是底物分解速率。
•4.酶作用的适宜条件的探究•(1)最适温度的探究实验原理•①淀粉+淀粉酶——麦芽糖;麦芽糖+斐林试剂—一产生砖红色沉淀;淀粉+碘——蓝色。
•②温度影响淀粉酶活性,从而影响淀粉的分解,滴加碘液后,根据蓝色深浅来判断淀粉分解状况,进而推断出酶活性变化。
•(2)最适pH的探究实验原理•①2H202+过氧化氢酶——2H2O+O2•②pH影响酶的活性,从而影响氧气的生成速度,可用点燃但无火焰的卫生香燃烧的情况来检验氧气生成速度的快慢。
•(3)实验探究思路•①最适温度的探究思路••②最适pH的探究思路•2、易错点拨:(1)在酶的最适pH探究实验中,操作时必须先将酶置于不同环境条件下(加清水、加氢氧化钠、加盐酸),然后再加入反应物。
不能把酶加入反应物在酶的作用下先发生水解。
(2)在酶的最适温度探究实验中,酶溶液和反应物混合之前,需要把两者先分别放在各自所需温度下保温一段时间。
若选择淀粉和淀粉酶来探究酶的最适温度,检测的试剂宜先用碘液,不应该选用斐林试剂。
因选用斐林试剂需热水浴加热,而该实验中需严格控制温度。
•知识拓展:••1、利用酶的专一性也可探究某种酶的化学本质是蛋白质还是RNA:将某种酶用蛋白酶或核糖核酸酶处理,根据处理后的酶液是否还有催化作用予以判断。



第1篇一、实验目的1. 了解酶的概念、特性及其在生物体内的重要作用。
2. 掌握酶的催化活性、专一性和影响酶活性的因素。
3. 通过实验验证酶的催化作用,加深对酶的理解。
二、实验原理酶是一种生物催化剂,由活细胞产生,具有高效性、专一性和温和性。
酶催化作用具有以下特点:1. 高效性:酶催化反应速率比无机催化剂快10^3~10^17倍。
2. 专一性:一种酶只能催化一种或一类底物。
3. 温和性:酶催化反应在较温和的条件下进行。
三、实验材料与仪器1. 材料:(1)酶:淀粉酶、蛋白酶、脂肪酶等。
(2)底物:淀粉、蛋白质、脂肪等。
(3)指示剂:碘液、酚酞等。
2. 仪器:(1)恒温水浴箱(2)试管及试管架(3)移液器(4)显微镜四、实验步骤1. 酶催化反应速率实验(1)取两只试管,分别加入相同量的淀粉溶液和碘液。
(2)向一只试管中加入适量的淀粉酶,另一只试管中加入等量的蒸馏水作为对照。
(3)将两只试管放入恒温水浴箱中,观察并记录碘液褪色所需时间。
2. 酶的专一性实验(1)取两只试管,分别加入相同量的淀粉溶液和蛋白质溶液。
(2)向一只试管中加入适量的淀粉酶,另一只试管中加入等量的蛋白酶。
(3)将两只试管放入恒温水浴箱中,观察并记录反应现象。
3. 影响酶活性的因素实验(1)温度对酶活性的影响取两只试管,分别加入相同量的淀粉酶和淀粉溶液。
向一只试管中加入适量蒸馏水作为对照,另一只试管中加入少量NaOH溶液,观察并记录碘液褪色所需时间。
(2)pH值对酶活性的影响取两只试管,分别加入相同量的淀粉酶和淀粉溶液。
向一只试管中加入适量蒸馏水作为对照,另一只试管中加入适量醋酸溶液,观察并记录碘液褪色所需时间。
五、实验结果与分析1. 酶催化反应速率实验:淀粉酶催化淀粉水解反应速率明显快于对照组,证明酶具有催化作用。
2. 酶的专一性实验:淀粉酶对淀粉具有催化作用,而对蛋白质无催化作用,证明酶具有专一性。
3. 影响酶活性的因素实验:(1)温度对酶活性的影响:NaOH溶液对淀粉酶活性有抑制作用,证明温度对酶活性有影响。

酶的性质实验报告酶的性质实验报告引言:酶是一类生物催化剂,能够在生物体内加速化学反应的进行。
酶具有高效、选择性和可逆性等特点,对于生物体的正常生理功能起着至关重要的作用。
本实验旨在通过观察酶的性质,深入了解酶的催化作用机制以及其在生物体内的重要性。
一、酶的特性酶是一种特殊的蛋白质,其催化作用的效果非常显著。
酶能够在相对较低的温度和压力下加速化学反应的进行,这是因为酶能够降低反应的活化能。
酶对于底物的选择性也非常高,只催化特定的底物进行反应,这是因为酶与底物之间的空间构象和电荷分布能够相互匹配。
此外,酶的催化作用是可逆的,即酶可以催化反应的正向和逆向过程。
二、酶的催化作用酶的催化作用主要通过底物与酶的结合形成酶-底物复合物来实现。
在酶-底物复合物中,酶通过改变底物的构象或者提供催化活性位点来降低反应的活化能,从而加速反应的进行。
实验中,我们通过观察酶对底物的催化作用,可以更直观地了解酶的催化机制。
三、酶的温度特性酶的催化作用受到温度的影响较大。
在本实验中,我们分别将酶溶液置于不同的温度下进行观察。
结果显示,酶的活性在一定温度范围内随温度的升高而增加,但当温度超过一定范围后,酶的活性会迅速下降。
这是因为高温会破坏酶的三维结构,使酶失去催化活性。
因此,在实际应用中,我们需要根据酶的特性来选择合适的温度条件。
四、酶的pH特性酶的催化作用还受到pH值的影响。
不同的酶对于酸碱度的适应范围不同,这与酶的结构和功能密切相关。
在实验中,我们调整了不同pH值的缓冲液,并将酶溶液加入其中进行反应。
结果显示,酶的活性在特定的pH值范围内最高,而在酸性或碱性条件下,酶的活性会显著下降。
这是因为酶的活性位点对于氢离子浓度非常敏感,酸碱度的改变会影响酶的结构和功能。
五、酶的浓度特性酶的催化活性还与酶的浓度密切相关。
在实验中,我们分别取不同浓度的酶溶液进行反应,并观察反应速率的变化。
结果显示,酶的活性随着酶浓度的增加而增加,但当酶浓度达到一定范围后,酶的活性不再增加。

认识酶的实验报告一、实验目的本实验旨在通过探究酶的性质和功能,加深对酶作用的认识,并进一步了解酶的作用机制。
二、实验原理1. 酶的定义:酶是一种能够加速生物体内生物化学反应速率的蛋白质。
2. 酶的特性:酶具有专一性、高效性和可逆性。
3. 酶促反应:酶与底物发生特异性结合,形成酶底物复合物,通过酶的催化作用,反应速率得到加快。
三、实验步骤1. 实验材料准备:酶溶液、底物溶液、试管、试管架、试管夹、显色剂等。
2. 实验步骤:- 步骤一:取两支试管,分别加入相同体积的酶溶液和底物溶液,并将其放入不同的试管架中。
- 步骤二:将试管架放入恒温槽中,保持温度恒定。
- 步骤三:同时开始计时器,并在不同的时间点分别取出试管,加入显色剂。
- 步骤四:观察试管中颜色的变化,并记录下时间和变化情况。
四、实验结果根据实验过程中记录的数据计算得出的结果如下表所示:时间(秒)试管一颜色变化试管二颜色变化0 无变化无变化10 逐渐变淡无变化20 变得非常浅逐渐变淡30 几乎透明变得非常浅40 透明透明50 透明透明60 透明透明五、实验讨论通过实验我们可以得出以下结论:1. 酶的作用是加速生物体内生物化学反应的速率,同时具有专一性、高效性和可逆性。
2. 本实验中,试管中的酶溶液通过与底物的特异性结合,催化反应,使底物的颜色变淡或透明。
3. 随着时间的增加,试管一和试管二中的底物都逐渐变淡或透明,说明酶的催化作用随时间的增加而增强。
六、实验总结通过本次实验,我们更加深入地理解了酶的性质和功能。
酶作为生物体内的催化剂,在代谢和生产过程中起着非常重要的作用。
同时,我们也学会了如何进行酶的活性检测实验,通过观察底物的变化情况来评估酶的催化效果。
然而,本次实验的结果可能受到实验条件的限制,如实验温度、酶浓度等因素。
因此,在今后的实验中,我们应该更加精确地控制实验条件,以获取更准确的实验结果。
总之,通过认识酶的实验,我们进一步了解了酶的作用机制,提高了对酶的认识和理解,并为今后的研究和应用提供了基础。

酶的基本性质实验报告酶的基本性质实验报告引言:酶是一类生物催化剂,能够加速和调控生物体内的化学反应速率。
酶的研究对于理解生物体的代谢过程以及开发新药和生物技术具有重要意义。
本实验旨在探究酶的基本性质,包括催化活性、温度和pH值对酶活性的影响。
实验一:酶的催化活性材料与方法:1. 取一小块新鲜牛肉,切成细丝。
2. 准备一杯水,将牛肉丝放入其中。
3. 在室温下观察牛肉丝的变化。
结果与讨论:经过一段时间,我们可以观察到牛肉丝开始变得更加松软。
这是因为牛肉中的酶分解了蛋白质,使其变得更易消化。
这个实验说明了酶具有催化作用,能够加速化学反应的进行。
实验二:温度对酶活性的影响材料与方法:1. 准备三个试管,分别标记为A、B、C。
2. 在试管A中加入一定量的淀粉溶液。
3. 在试管B中加入一定量的淀粉溶液和一滴淀粉酶。
4. 在试管C中加入一定量的淀粉溶液和一滴淀粉酶。
5. 将试管A放入冰箱,试管B放在室温下,试管C放在加热器上加热。
结果与讨论:经过一段时间,我们可以观察到试管A中的淀粉溶液没有发生明显的变化,试管B中的淀粉溶液开始变得混浊,而试管C中的淀粉溶液变得更加透明。
这是因为酶的活性受温度的影响。
在低温下,酶的活性较低,无法有效催化淀粉的降解。
在适宜的温度下,酶的活性最高,可以充分发挥催化作用。
然而,当温度过高时,酶的结构可能发生变化,导致酶的活性降低甚至失活。
实验三:pH值对酶活性的影响材料与方法:1. 准备三个试管,分别标记为A、B、C。
2. 在试管A中加入一定量的牛奶。
3. 在试管B中加入一定量的牛奶和一滴乳酸酶。
4. 在试管C中加入一定量的牛奶和一滴乳酸酶。
5. 分别在试管A、B、C中加入不同pH值的缓冲液。
结果与讨论:经过一段时间,我们可以观察到试管B中的牛奶开始变酸,而试管C中的牛奶保持了原有的味道。
这是因为酶的活性受pH值的影响。
在适宜的pH值下,酶的活性最高,可以催化乳酸的产生。
然而,当pH值偏离适宜范围时,酶的结构可能发生变化,导致酶的活性降低甚至失活。

酶的特性实验报告一、实验目的本实验旨在探究酶的特性,包括酶的高效性、专一性以及酶的作用条件(温度、pH 值等)对酶活性的影响,加深对酶的性质和功能的理解。
二、实验原理1、酶的高效性:酶具有极高的催化效率,能显著加快化学反应的速率。
通常情况下,酶的催化效率比无机催化剂高得多。
2、酶的专一性:一种酶只能催化一种或一类化学反应,这是由于酶的活性中心具有特定的结构和化学性质,只能与特定的底物结合并发生反应。
3、酶的作用条件:酶的活性受到多种因素的影响,如温度、pH 值等。
在一定范围内,酶的活性随着温度的升高而增强,但超过一定温度范围,酶会因变性而失活;同样,不同的酶在不同的 pH 值条件下活性也不同。
三、实验材料与设备1、材料新鲜的猪肝(用于提取过氧化氢酶)3%的过氧化氢溶液淀粉溶液蔗糖溶液淀粉酶溶液斐林试剂碘液pH 缓冲液(包括pH 为1、2、3、4、5、6、7、8、9、10 的溶液)2、设备恒温水浴锅试管量筒滴管酒精灯三脚架石棉网温度计四、实验步骤(一)酶的高效性实验1、取两支洁净的试管,分别编号为 1 号和 2 号。
2、向 1 号试管中加入 2 mL 3%的过氧化氢溶液,向 2 号试管中加入 2 mL 3%的过氧化氢溶液和少量新鲜猪肝研磨液。
3、观察并记录两支试管中产生气泡的快慢。
(二)酶的专一性实验1、取三支洁净的试管,分别编号为 3 号、4 号和 5 号。
2、向 3 号试管中加入 2 mL 淀粉溶液,向 4 号试管中加入 2 mL 蔗糖溶液,向 5 号试管中加入 2 mL 淀粉溶液和 2 mL 淀粉酶溶液。
3、将 3 号、4 号和 5 号试管在 37℃恒温水浴锅中保温 15 分钟。
4、取出 3 号和 5 号试管,各加入 2 滴碘液,观察溶液颜色的变化。
5、取出 4 号试管,加入 2 mL 斐林试剂,在酒精灯上加热煮沸,观察溶液颜色的变化。
(三)酶的作用条件实验1、温度对酶活性的影响取六支洁净的试管,分别编号为 6 号、7 号、8 号、9 号、10 号和11 号。
酶的特性实验报告引言:酶是一类生物催化剂,能够加速化学反应速率而本身不被消耗。
它们在生物体内广泛存在,并在许多生物过程中扮演关键角色。
为了更好地理解酶的特性、功能和应用,本实验旨在探究酶的性质和特征。
实验一:酶的催化活性与温度的关系方法:1. 准备一份酶提取物,并将其分装至数个试管中。
2. 室温下,将每个试管分别置于不同温度的水浴中,如10℃、30℃和50℃。
同时设置一个对照组试管在室温下。
3. 在每个试管中加入相等量的底物(如淀粉溶液),并记录反应时间。
4. 在适当的时间间隔内,从每个试管中取出一滴反应液,加入碘试液。
5. 观察反应液颜色变化,并记录下每个试管的反应时间。
结果和讨论:随着温度的增加,酶的催化作用逐渐增强。
在低温下,酶的活性相对较低,导致催化反应速率较慢。
而在较高温度下,酶的活性逐渐增强,反应速率加快。
然而,当温度过高时,酶蛋白质可能被破坏,导致反应速率下降。
因此,温度对酶的催化活性有一定的影响,但存在最适温度范围。
实验二:酶的催化活性与酸碱度的关系方法:1. 准备一份酶提取物,并将其分装至数个试管中。
2. 在各个试管中加入不同pH值的酸或碱溶液,如pH3的盐酸或pH9的氢氧化钠溶液。
3. 在每个试管中加入相等量的底物(如蛋白质溶液),并记录反应时间。
4. 在适当的时间间隔内,从每个试管中取出一滴反应液,进行适当的染色检测,并记录颜色变化和反应时间。
结果和讨论:酶的催化活性与酸碱度有密切关系。
在适当的pH范围内,酶的催化活性最高,就是所谓的最适pH。
当pH偏离最适点时,酶的活性会下降。
这是因为酶的活性和构象高度依赖于其周围环境的酸碱度。
过高或过低的酸碱度会改变酶的原子结构,从而影响其催化活性。
实验三:酶的催化活性与底物浓度的关系方法:1. 准备一份酶提取物,并将其分装至数个试管中。
2. 在每个试管中,加入不同浓度的底物溶液,如0.1M、0.2M和0.3M的蔗糖溶液。
3. 在每个试管中加入相等量的酶提取物,并记录反应时间。
酶的特性实验报告酶的特性实验报告引言:酶是一类催化生物化学反应的蛋白质,它们在生物体内起着至关重要的作用。
本实验旨在通过观察和分析酶的特性,进一步了解酶的功能和性质。
实验材料和方法:1. 实验材料:淀粉溶液、碘液、酵母浸膏、蔗糖溶液、酶提取液、试管、试管架、滴管、显微镜等。
2. 实验方法:a. 将淀粉溶液分别加入两个试管中,加入少量碘液,观察颜色变化。
b. 在两个新的试管中分别加入蔗糖溶液和酵母浸膏,加入酶提取液,观察气泡的产生。
c. 利用显微镜观察酵母浸膏中的酵母细胞。
实验结果和讨论:1. 淀粉溶液与碘液的反应:加入碘液后,淀粉溶液由透明变为深蓝色,表明淀粉溶液中存在淀粉,而碘液可以与淀粉形成蓝色复合物。
这是因为淀粉是由α-葡聚糖分子组成的多糖,碘液能够与淀粉分子中的α-1,4-葡聚糖链形成蓝色的碘化淀粉复合物。
2. 蔗糖溶液和酵母浸膏的反应:加入酶提取液后,蔗糖溶液中没有观察到气泡的产生,而酵母浸膏中观察到大量气泡的产生。
这是因为酵母浸膏中含有酵母细胞,而酵母细胞中存在酵母酶,可以催化蔗糖的分解产生二氧化碳气泡。
而蔗糖溶液中没有气泡的产生,说明蔗糖在缺乏酵母酶的情况下无法被分解。
3. 酵母细胞的观察:在显微镜下观察酵母浸膏中的酵母细胞,可以看到它们呈现出圆形或椭圆形的形状。
酵母细胞是一种单细胞真菌,它们通常以酵母浸膏的形式存在。
酵母细胞具有细胞膜、细胞质和细胞核等结构,是一种典型的真核细胞。
结论:通过实验观察和分析,我们可以得出以下结论:1. 碘液可以与淀粉形成蓝色的碘化淀粉复合物,用于检测淀粉的存在。
2. 酵母浸膏中的酵母细胞含有酵母酶,可以催化蔗糖的分解产生二氧化碳气泡。
3. 酵母细胞是一种单细胞真菌,具有典型的真核细胞结构。
总结:酶作为生物体内的催化剂,在许多生物化学反应中发挥着重要的作用。
通过本次实验,我们进一步认识了酶的特性和功能。
淀粉与碘液的反应和蔗糖的分解反应验证了酶的催化作用,而酵母细胞的观察则展示了酵母细胞的结构和存在酵母酶的能力。
一、实验目的通过本实验,了解酶的特性和作用机理,掌握酶的催化活性、专一性、温度和pH 值对酶活性的影响,以及酶的激活剂和抑制剂对酶活性的影响。
二、实验原理酶是一种生物催化剂,具有高效性、专一性和可调节性等特点。
酶的催化活性受多种因素影响,如温度、pH值、底物浓度、激活剂和抑制剂等。
本实验通过观察不同条件下酶的催化活性变化,探讨酶的特性。
三、实验材料与仪器1. 实验材料:(1)淀粉溶液、蔗糖溶液、酵母浸膏、酶提取液(2)碘液、班氏试剂、氢氧化钠、盐酸、硫酸铵、氯化钠、硫酸铜(3)恒温水浴锅、试管、试管架、滴管、显微镜等2. 实验仪器:(1)恒温水浴锅:用于控制实验温度(2)试管、试管架:用于盛装实验试剂(3)滴管:用于移取试剂(4)显微镜:用于观察酶活性变化四、实验方法与步骤1. 酶的催化活性实验(1)取两只试管,分别加入0.5%淀粉溶液和0.5%蔗糖溶液(2)向两只试管中分别加入等量的酶提取液(3)将两只试管放入恒温水浴锅中,分别在37℃和50℃下反应30分钟(4)取出试管,加入碘液,观察颜色变化2. 酶的专一性实验(1)取两只试管,分别加入0.5%淀粉溶液和0.5%蔗糖溶液(2)向两只试管中分别加入等量的唾液淀粉酶(3)将两只试管放入恒温水浴锅中,分别在37℃下反应30分钟(4)取出试管,加入班氏试剂,观察颜色变化3. 温度对酶活性的影响实验(1)取三只试管,分别加入0.5%淀粉溶液(2)向三只试管中分别加入等量的酶提取液(3)将三只试管分别放入0℃、37℃和50℃的恒温水浴锅中,反应30分钟(4)取出试管,加入碘液,观察颜色变化4. pH值对酶活性的影响实验(1)取三只试管,分别加入0.5%淀粉溶液(2)向三只试管中分别加入等量的酶提取液(3)向三只试管中分别加入不同pH值的缓冲溶液(4)将三只试管放入恒温水浴锅中,分别在37℃下反应30分钟(5)取出试管,加入碘液,观察颜色变化5. 激活剂和抑制剂对酶活性的影响实验(1)取两只试管,分别加入0.5%淀粉溶液(2)向两只试管中分别加入等量的酶提取液(3)向其中一只试管中加入适量的激活剂硫酸铵,另一只试管中加入适量的抑制剂氯化钠(4)将两只试管放入恒温水浴锅中,分别在37℃下反应30分钟(5)取出试管,加入碘液,观察颜色变化五、实验结果与分析1. 酶的催化活性实验在37℃下,淀粉溶液加入酶提取液后颜色变蓝,说明酶具有催化活性;在50℃下,淀粉溶液加入酶提取液后颜色变浅,说明高温抑制了酶的活性。
第6讲酶的本质、特性及相关实验探究考纲考情——知考向核心素养——提考能最新考纲1.酶在代谢中的作用(Ⅱ)2.实验:探究影响酶活性的因素生命观念比较酶、激素等物质的异同,建立辩证统一和普遍联系的观念科学思维与酶有关的曲线分析近三年考情2018·全国卷Ⅰ(1、6)、2018·全国卷Ⅲ(30)、2017·全国卷Ⅱ(3)、2016·全国卷Ⅰ(3)、2016·全国卷Ⅱ(29)科学探究与酶有关的实验设计与分析社会责任分析酶在生产、生活中的应用实例,让学生关注科学、技术和社会发展考点一酶的本质和作用机理1.酶的本质及作用■助学巧记巧记酶概念的“二、一、一、一”2.比较过氧化氢在不同条件下的分解(1)实验流程(2)变量分析3.酶的作用机理分析4.酶本质的探索历程(连一连)1.(中图版必修1 P59“探究活动”拓展)在“比较过氧化氢酶和Fe3+的催化效率”实验中为什么要以新鲜肝脏研磨液为实验材料?若用煮熟的肝脏研磨液为实验材料能否达到预期的实验效果?为什么?提示新鲜的猪肝含有丰富的过氧化氢酶,能迅速地催化过氧化氢分解,产生大量的氧气,与Fe3+的催化形成鲜明对比。
如果肝脏不新鲜,那么肝脏细胞内的过氧化氢酶会在细菌的作用下分解,影响实验效果。
用煮熟的肝脏研磨液为实验材料不能达到预期的实验效果,是因为高温破坏了酶的结构,使酶丧失了活性。
2.(中图版必修1 P59“分析讨论”拓展)酶作为生物催化剂,与无机催化剂相比,在发挥作用过程中有哪些共同特点?酶除了具有催化功能外,可以调节生命活动吗?提示共同点:①化学反应前后其数量和性质不变;②加快化学反应的速率,缩短达到化学平衡的时间,但不能改变平衡点;③二者都能降低化学反应的活化能。
催化(降低化学反应的活化能)是酶唯一的功能,它不具调节功能,也不作为能源(或组成)物质。
结合酶的化学本质、分布及功能,考查归纳与概括能力1.(2017·全国卷Ⅱ,3)下列关于生物体中酶的叙述,正确的是()A.在细胞中,核外没有参与DNA合成的酶B.由活细胞产生的酶在生物体外没有催化活性C.从胃蛋白酶的提取液中沉淀该酶可用盐析的方法D.唾液淀粉酶催化反应最适温度和保存温度是37 ℃解析DNA的合成主要发生在细胞核中,此外在线粒体和叶绿体中也能合成,因此细胞核、线粒体和叶绿体中都有参与DNA合成的酶,A错误;只要给予适宜的温度、pH等条件,由活细胞产生的酶在生物体外也具有催化活性,B错误;盐析可使蛋白质在水溶液中的溶解度降低,但不影响蛋白质的活性。
酶的特性实验报告结果酶的特性实验报告结果引言:酶是一种生物催化剂,在生物体内发挥着重要的作用。
为了深入了解酶的特性,我们进行了一系列的实验。
本报告将详细介绍实验的目的、方法和结果,并对实验结果进行分析和讨论。
实验目的:1. 研究酶的催化作用特性。
2. 探究酶活性受到温度和pH值的影响。
3. 分析酶的底物浓度对酶活性的影响。
实验方法:1. 实验一:酶的催化作用特性a. 准备一系列浓度不同的酶底物溶液。
b. 分别加入一定量的酶液,反应一定时间。
c. 通过测定反应物浓度的变化,计算出酶催化作用的速率。
2. 实验二:酶活性与温度的关系a. 准备一定浓度的酶底物溶液。
b. 将酶底物溶液分别置于不同温度下,反应一定时间。
c. 通过测定反应物浓度的变化,计算出不同温度下酶的活性。
3. 实验三:酶活性与pH值的关系a. 准备一定浓度的酶底物溶液。
b. 将酶底物溶液分别调节至不同pH值下,反应一定时间。
c. 通过测定反应物浓度的变化,计算出不同pH值下酶的活性。
实验结果:1. 实验一:酶的催化作用特性我们分别使用了不同浓度的酶底物溶液进行反应,结果表明酶底物浓度越高,酶催化作用的速率越快。
这是因为酶底物浓度的增加可以提供更多的底物分子与酶结合,从而增加催化反应的速率。
2. 实验二:酶活性与温度的关系我们将酶底物溶液置于不同温度下进行反应,结果显示酶活性随温度的升高而增加,但在超过一定温度后酶活性开始下降。
这是因为温度的升高可以增加酶的分子运动速度,提高反应速率,但过高的温度会破坏酶的三维结构,使其失去活性。
3. 实验三:酶活性与pH值的关系我们调节了酶底物溶液的pH值进行反应,结果显示酶活性在不同pH值下有所差异。
大多数酶在中性pH值附近表现出最佳活性,而在酸性或碱性条件下,酶的活性会下降。
这是因为酶的活性受到酶分子的电荷状态和离子交互作用的影响。
讨论与分析:通过实验结果的分析,我们可以得出以下结论:1. 酶底物浓度的增加可以提高酶催化作用的速率。