实验3酶切与连接
- 格式:doc
- 大小:592.50 KB
- 文档页数:2

主要包括酶切、连接和转化三个步骤。
下载提示:该文档是本店铺精心编制而成的,希望大家下载后,能够帮助大家解决实际问题。
文档下载后可定制修改,请根据实际需要进行调整和使用,谢谢!本店铺为大家提供各种类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by this editor. I hope that after you download it, it can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you! In addition, this shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!分子生物学实验技术:酶切、连接和转化的完整步骤引言在分子生物学研究中,酶切、连接和转化是常见的实验技术,用于DNA的操作和重组。

第二次分子生物学实验报告DNA的酶切、连接、转化和重组子的筛选与鉴定一、实验目的1、学习和掌握限制性内切酶的分类、特性与作用原理,掌握载体和外源目的DNA酶切的操作技术。
2、学习利用T4 DNA 连接酶把酶切后的载体片段和外源目的DNA 片段连接起来,构建体外重组DNA 分子的技术,了解并掌握几种常用的连接方法。
3、掌握利用CaCl2 制备感受态细胞的方法;学习和掌握热击法转化E. coli 的原理与方法。
4、学习并掌握使用红白菌落法筛选获得重组子以及α互补筛选法的原理及方法。
5、学习和掌握使用试剂盒抽提质粒的方法;6、复习琼脂糖凝胶电泳的原理和方法;7、通过对重组子进行重组质粒DNA 的抽提与酶切鉴定,进一步确定重组质粒中含有外源目的DNA 片段,并验证重组子是期望的重组子。
二、实验原理1、限制性内切酶限制性核酸内切酶是一类能够识别双链DNA 分子中的某种特定核苷酸序列,并由此切割DNA 双链结构的酶,主要是从原核生物中分离纯化出来的。
在限制性核酸内切限制酶的作用下,侵入细菌的“外源”DNA 分子便会被切割成不同大小的片段,而细菌自己固有的DNA 由于修饰酶(通常是一种甲基化酶)的保护作用,则可免受限制酶的降解。
目前已经鉴定出3 种不同类型的限制性核酸内切酶,即Ⅰ型酶、II 型酶和III 型酶。
Ⅰ型酶切割位点是随机的,至少距识别位点1000bp。
Ⅲ型限制酶的切割位点距识别序列3'端为24—26bp。
Ⅱ型限制酶的切割位点一般在识别序列上或与之靠近,而且具有序列特异性,故在基因克隆中有特别广泛的用途。
Ⅱ型核酸内切限制酶具有3个基本的特性:①在DNA 分子双链的特异性识别序列部位切割DNA 分子,产生链的断裂;②2个单链断裂部位在DNA 分子上的分布通常不是彼此直接相对的;③断裂结果形成的DNA 片段往往具有互补的单链延伸末端。
限制性核酸内切酶对DNA 底物的酶切作用是否完全,直接关系到连接反应、重组体分子的筛选和鉴定等实验结果。


酶切连接法
酶切连接法是一种分子生物学技术,用于将不同的 DNA 片段连接在一起。
该方法通常包括以下步骤:
1. 酶切:使用特定的限制酶将待连接的 DNA 片段进行切割,产生特定的粘性末端。
2. 纯化:通过凝胶电泳或其他方法,将切割后的 DNA 片段进行纯化,去除杂质和未切割的 DNA。
3. 连接:将纯化后的 DNA 片段与载体 DNA(如质粒或病毒载体)在连接酶的作用下进行连接。
连接酶能够将粘性末端连接在一起,形成新的 DNA 分子。
4. 转化:将连接后的 DNA 分子导入宿主细胞中,如大肠杆菌或酵母细胞。
转化可以通过热激法、电穿孔法或化学转化法等方法进行。
5. 筛选:通过选择性培养基或其他方法,筛选出含有连接后的 DNA 分子的宿主细胞。
6. 鉴定:对筛选出的宿主细胞进行鉴定,确认其中含有连接后的 DNA 分子。
酶切连接法是一种常用的 DNA 克隆技术,可以用于构建基因文库、表达载体、基因敲除等实验。
该方法具有高效、简便、快速等优点,是分子生物学研究中不可或缺的技术之一。

DNA的酶切与连接1. 实验目的了解DNA限制性内切酶和连接的作用原理,学习和掌握利用限制性内切酶进行DNA 消化和片段的方法和技术。
2. 实验原理DNA限制性内切酶和连接酶是遗传工程中实现DNA的切割和重组的重要工具酶,也是基因工程技术赖以生存的基础。
1970年Smith H·O等从流感病毒中提取了第一个限制性内切酶Hind II,其作用于外源DNA后,切割产生平末端。
人们经过研究发现,限制性内切酶可以识别双链DNA分子上的特异序列,通常识别区具有回纹结构,并使两个特定核苷酸之间的磷酸二酯键断裂。
目前已经从微生物中发现了200多种限制性内切酶,其中大部分可以切割DNA形成粘性末端。
如EcoR I,可以识别6个碱基的序列:▼5’ ――――――GA TTC――――――3’3’ ――――――CTTAAG――――――5’▲切割后形成的片段5’――――――G AA TTC――――――3’3’――――――CTTAA G――――――5’当限制性内切酶作用于DNA时可以形成的酶切片段数为:片段数目= 切点数+1 (线状DNA)片段数目= 切点数(环状DNA)切点出现的频率为1/4s(S为识别顺序所含的碱基数目)DNA连接酶则可以将切开的DNA片段连接起来,此时需要接口两端具有磷酸根。
对粘性末端的单链可以进行点接,对于平末端来说也可以进行连接,但是需要较多的酶。
在基因工程中,可以利用同一种限制性内切酶分别切割目标DNA和运载体,然后利用T4DNA 连接酶将目标序列整合到运载体中,使DNA中的3’-OH与5’-P生成磷酸二酯键。
3. 实验用具及材料电泳仪、恒温水浴锅、紫外检测仪、微量移液器、Eppendorf离心管10×酶切反应缓冲液、T4DNA连接酶缓冲液、溴酚蓝指示液、EB电泳缓冲液、PBR322质粒DNA、pXZ6质粒DNA,λphage DNA、DNA Marker EcoRI Hind III。


质粒重组实验报告质粒重组实验报告引言:质粒重组是一种重要的实验技术,可以将外源基因导入到宿主细胞中,用于研究基因功能、蛋白质表达等方面。
本实验旨在通过质粒重组技术,将外源基因成功导入到大肠杆菌中,并通过酶切、连接、转化等步骤验证重组质粒的构建。
材料与方法:1. 外源基因:选择了编码了绿色荧光蛋白(GFP)的质粒pGFP。
2. 宿主细胞:采用大肠杆菌作为宿主细胞。
3. 酶切酶:使用限制酶EcoRI和BamHI进行酶切反应。
4. 连接酶:使用T4 DNA连接酶进行连接反应。
5. 培养基:含有抗生素的LB培养基。
实验步骤:1. 酶切反应:将pGFP质粒和EcoRI、BamHI酶切酶按照指定条件进行酶切反应,以得到线性化的质粒和目标基因片段。
2. 连接反应:将线性化的质粒和目标基因片段加入连接酶缓冲液中,按照指定条件进行连接反应,形成重组质粒。
3. 转化:将重组质粒加入含有大肠杆菌的培养基中,通过热激转化法使质粒进入细胞。
4. 筛选:将转化后的细胞均匀涂布在含有抗生素的LB平板上,筛选出含有重组质粒的菌落。
5. 验证:通过PCR、酶切等方法对筛选出的菌落进行验证,确认质粒重组成功。
结果与讨论:经过酶切、连接、转化等步骤,成功构建了质粒重组实验系统。
在LB平板上筛选出了多个抗生素耐受的菌落,表明转化成功。
通过PCR验证,检测到了目标基因片段的特异扩增带,证明重组质粒中成功导入了外源基因。
进一步进行酶切验证,发现重组质粒经过连接反应后,酶切位点发生改变,与未连接的质粒有明显差异。
这些结果表明,质粒重组实验成功构建了重组质粒,并将外源基因导入到大肠杆菌中。
质粒重组实验的成功对于基因功能研究和蛋白质表达具有重要意义。
通过重组质粒,可以将外源基因导入到宿主细胞中,进而研究其在生物体内的功能和表达情况。
例如,可以通过重组质粒实现基因敲除、基因表达调控等功能,从而深入了解基因在生物体内的作用机制。
同时,重组质粒还可以用于蛋白质表达,通过外源基因的转录和翻译,使宿主细胞产生目标蛋白质,用于研究其结构、功能等方面。

质粒DNA酶切、连接、转化、筛选、鉴定(2011-04-29 10:42:22)转载▼质粒DNA酶切、连接、转化、筛选、鉴定实验目的1、学习和掌握限制性内切酶的特性2、掌握对重组质粒进行限制性内切酶酶切的原理和方法3、掌握利用CaCl2制备感受态细胞的方法4、学习和掌握热击法转化E.coli的原理和方法5、掌握α互补筛选法的原理6、学习用试剂盒提取重组质粒DNA的方法7、复习琼脂糖凝胶电泳的原理及方法实验原理重组质粒的构建需要对DNA分子进行切割,并连接到合适的载体上进行体外重组。
限制性核酸内切酶和DNA连接酶的发现与应用,为重组质粒的构建提供了有力的工具。
限制性核酸内切酶酶切分离法适于从简单基因组中分离目的基因。
质粒和病毒等DNA 分子小的只有几千碱基,大的也不超过几十万碱基,编码的基因较少,获得目的基因的方法也比较简单。
DNA连接酶催化两双链DNA片段相邻的5’-磷酸和3’-羟基间形成磷酸二酯键。
在分子克隆中最有用的DNA连接酶是来自T4噬菌体的DNA 连接酶:T4 DNA连接酶。
T4 DNA连接酶在分子克隆中主要用于:1、连接具有同源互补粘性末端的DNA片段;2、连接双链DNA分子间的平端;3、在双链平端的DNA分子上添加合成的人工接头或适配子。
目的DNA片段与载体DNA片段之间的连接方式(以T4DNA连接酶为例)主要有以下几种:(一)、具互补粘性末端片段之间的连接大多数的核酸内切限制酶都能够根据识别位点切割DNA分子,形成1~4核苷酸单链的粘性末端。
当载体和外源DNA用同一种限制性内切酶切割时,产生相同的粘性末端,连接后仍保留原限制性内切酶的识别序列;如果用两种能够产生相同的粘性末端的限制酶(同尾酶)切割时,虽然可以有效地进行连接,但是获得的重组DNA分子消失了原来用于切割的那两种限制性核酸内切酶的识别序列,这样不利于从重组子上完整地将插入片段重新切割下来。
(二)、平末端的连接载体分子和外源DNA插入片段并不一定总能产生出互补的粘性末端。

酶切本实验室条件下酶切连接经验之谈1、PCR产物可以切胶回收后酶切,用Elution buffer溶解即可,不影响后续实验。
2、50ulPCR产物切胶回收后用35ul Elution buffer溶解后只需取一半体积用于后续实验即可满足要求。
3、PCR产物可以用乙醇沉淀法获得DNA用于后续反应,但需取少于一半的量用于后续实验,否则会不能完全切开而导致实验失败。
4、双酶切时,若2种酶不是同一厂家时,可以根据Thermo厂家该2种酶的共同buffer,选用Tango缓冲液,一般50ul体系各加1ul酶,而快切酶只需0.5ul,切3小时即可。
5、添加酶切试剂时,应先将buffer和样品振荡均匀后再加入相应的酶,轻弹混匀即可。
6、观察酶切后的载体片段会比质粒大很多,PCR产物双酶切后的片段也比未酶切时要大,并且酶切后产物有时会呈现稍微弥散的宽带,由此可以判断是否切开。
7、部分限制性内切酶对甲基化的DNA不能切割,如FbaI和MboI等,一般生物公司提供的内切酶说明中均有说明。
大多数酶切位点的甲基化不影响切割,而有些会影响,如XbaI, BclI等。
而且甲基化只发生在特定序列,以XbaI为例,只有在位点序列旁出现GA或TC,该XbaI位才会被甲基化。
而要解除这种限制修饰作用通常有两种方法:(1)选用上述酶的同功酶,如Sau3AI,DNA识别切割位点与MboI相同;但不受甲基化影响;(2)利用甲基化酶缺失的受体细胞进行DNA的制备,如E.coli JM110和链霉菌等,前者Dam和Dcm甲基化酶已敲出,而后者细胞内本就没有甲基化酶,从这些细胞中抽提的DNA就能被上述酶切割。
8:E.coli JM110要排除dam,dcm甲基化的影响,需要用特定的dam-,dcm-的菌株,如JM110如果由JM110或SCS110等甲基化缺失的菌株产生的质粒,则不会被甲基化.若酶切不成功可以考虑以下因素的影响a)有些内切酶对PCR产物酶切效率较低b)双酶切无共同buffer时,可以采用分步酶切c)PCR产物直接双酶切不成功,可以选择先做TA克隆后再双酶切d)当载体的2个酶切位点很接近,或者其中一个酶切效率很差时,可以对载体进行去磷酸化,该酶为牛小肠碱性磷酸酶,在大多数限制酶缓冲液中均有活性e)导致“星星活性”可能是体系中甘油浓度过高、高PH、较低的离子强度所致。

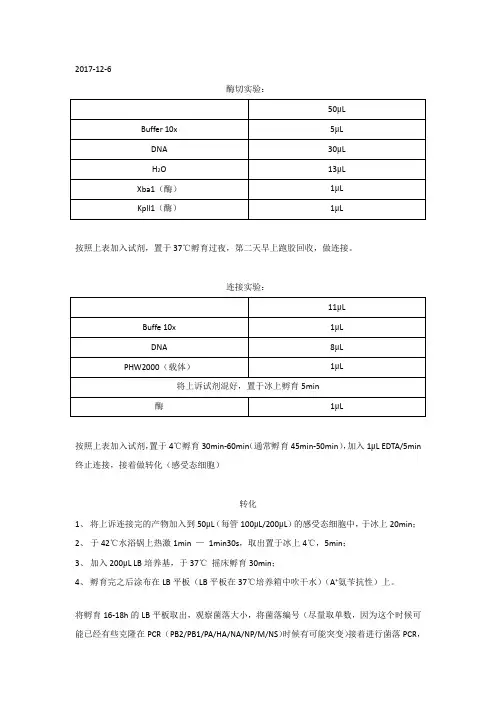
2017-12-6酶切实验:按照上表加入试剂,置于37℃孵育过夜,第二天早上跑胶回收,做连接。
连接实验:按照上表加入试剂,置于4℃孵育30min-60min(通常孵育45min-50min),加入1μL EDTA/5min 终止连接,接着做转化(感受态细胞)转化1、将上诉连接完的产物加入到50μL(每管100μL/200μL)的感受态细胞中,于冰上20min;2、于42℃水浴锅上热激1min —1min30s,取出置于冰上4℃,5min;3、加入200μL LB培养基,于37℃摇床孵育30min;4、孵育完之后涂布在LB平板(LB平板在37℃培养箱中吹干水)(A+氨苄抗性)上。
将孵育16-18h的LB平板取出,观察菌落大小,将菌落编号(尽量取单数,因为这个时候可能已经有些克隆在PCR (PB2/PB1/PA/HA/NA/NP/M/NS)时候有可能突变)接着进行菌落PCR,再将PCR产物进行琼脂糖电泳,确认该菌落是否是目的菌落。
PCR程序:95℃3min(2-3min是为了让大肠杆菌破裂释放核酸,如果95℃只设定了30s则大肠杆菌没法破裂,核酸释放不出来,PCR则很可能不成功;但是如果设立的时间为5min 则时间过于长,对酶不好);95℃30s,55℃30s;72℃1min30s,cycle x 30-35;72℃7min。
点突变(2017-12-18):设计引物:从需要突变的点左边和右边各选择12个碱基,碱基尽量以GC结尾(尽量不要以AT结尾)Sample(PR8 HA质粒)PCR体系(所用酶为PFu(F 530S (100))PCR程序:95℃30s;95℃30s,50℃(50-55)1min,68℃5min(载体3kb+ HA 1.7kb,该酶的效率为1kb/1min)cycle x 12-18(时常设定为15-18);72℃5min。
待PCR完毕,加入1uL DpnI(这种酶能特异性识别甲基化位点,当质粒进入细菌后会产生甲基化位点,所以新生成带突变位点的产物是不会被酶切的),置于37℃过夜(17:00放入孵箱,第二天早上8:00取出),接着做连接。
实验三质粒DNA的酶切鉴定南京大学生命科学院一、实验目的1、学习和掌握限制性内切酶的特性2、学习酶解的操作方法,初步理解限制性内切酶是DNA重组技术的关键工具3、进一步熟练掌握琼脂糖凝胶电泳的方法二、实验原理限制性核酸内切酶是一种工具酶,这类酶的特点是能够识别双链DNA分子特异性核酸序列,并能在这个特异性核苷酸序列内切断DNA双链,形成一定长度和顺序的DNA 片段。
限制性核酸内切酶是体外剪切基因片段的重要工具,与核酸聚合酶、连接酶以及末端修饰酶等一起称为工具酶。
限制性核酸内切酶不仅是DNA重组中重要的工具,而且还可以用于基因组酶切图谱的鉴定。
寄主控制的限制与修饰现象限制与修饰系统是细胞的一种防卫手段。
各种细菌都能合成一种或几种能够切割DNA双链的核酸内切酶,它们以此来限制外源DNA存在于自身细胞内,但合成这种酶的细胞自身的DNA不受影响,因为这种细胞还合成了一种修饰酶,对自身的DNA进行了修饰,限制性酶对修饰过的DNA不能起作用。
这种现象被称为寄主控制的限制与修饰现象。
限制性核酸内切酶的类型及特性按限制酶的组成、与修饰酶活性关系以及切断核酸的情况不同,分为三类:第一类(I型)限制性内切酶能识别专一的核苷酸顺序,并在识别点附近的一些核苷酸上切割DNA分子中的双链,但是切割的核苷酸顺序没有专一性,是随机的。
这类限制性内切酶在DNA重组技术或基因工程中用处不大,无法用于分析DNA结构或克隆基因。
这类酶如EcoB、EcoK等。
第二类(II型)限制性内切酶能识别专一的核苷酸顺序,并在该顺序内的固定位置上切割双链。
由于这类限制性内切酶的识别和切割的核苷酸都是专一的。
因此,这种限制性内切酶是DNA重组技术中最常用的工具酶之一。
这种酶识别的专一核苷酸顺序最常见的是4个或6个核苷酸,少数也有识别5个核苷酸以及7个、8个、9个、10个和11个核苷酸的。
II 型限制性内切酶的识别顺序是一个回文对称顺序,即有一个中心对称轴,从这个轴朝二个方向“读”都完全相同。
实验3酶切与连接实验三、酶切与连接⼀、实验⽬的与原理简介限制性内切酶在基因⼯程中主要应⽤地以下两个⽅⾯:制作基因酶切图谱和进⾏基因克隆。
制作基因图谱,就是利⽤特定的酶切出特定的条带;⽽利⽤基因克隆时选择酶应注意以下⼏个⽅⾯:1)克隆⽚段的长度;2)克隆⽚段中切点的情况3)载体上切点的情况;4)切割与连接⽅式;5)接头状态。
酶切⽅式可分为部分酶切和完全酶切两种:1)部分酶是指同⼀DNA ⽚段上有些被切开⽽另⼀些未被切开,此法主要应⽤于基因的克隆。
⽤部分酶切法是基于基因内部可能有此酶的位点。
进⾏部分酶切可通过两个⽅式:⼀是不同的时间内在同⼀酶反应管中取样终⽌反应,利⽤时间来控制酶切的程度。
另⼀种是在其余条件相同时控制酶的稀释度,利⽤不同酶浓度控制酶切程度,这种⽅法因易于控制反应⽽被⼴泛应⽤。
2)完全酶切法适⽤于如载体切割、酶切图谱的制作、基因的鉴定与DNA ⽚段的分离⼯作。
完全酶切⼜可分为单酶切、多酶切两种。
在多酶切反应中当2种或2种以上的酶有相同的反应条件时,可同时进⾏酶切,不然须在前⼀种酶作⽤完成后将其失活,⽽后进⾏第⼆种酶切反应,这样可以避免⽚段混乱现象的出现。
⼆、材料和试剂限制性内切酶NotI 、EcoRI ;10×Buffer , PCR 产物、pPIC9K 质粒、10×T4连接Buffer 、T4 Ligase 、DDW 、琼脂糖、电泳缓冲液、Goldview 染液、胶回收试剂盒;电泳仪、恒温⽔浴锅、EP 管、移液枪、灭菌枪头、紫外检测仪三、实验步骤1)PCR 产物双酶切(NotI ,EcoRI ),pPI9K 质粒双酶切(NotI ,EcoRI );PCR 体系如下:2)然后电泳检测后在紫外检测仪下观察(UV ,260nm )。
3)切胶回收(尽量不要切到不含⽬的⽚段的胶),按照胶回收试剂盒标准操作。
4)回收产物电泳检测后进⾏连接:连接体系: 10×T4连接Buffer 1µl⽬的基因 6µl质粒载体 2µl产物酶切体系pPI9K 质粒酶切体系 DDW4.6µl DDW 7µl 10×HBuffer1µl 10×H Buffer 1µl ⽬的⽚段4µl pPI9K 质粒 1.6µl NotI quickcut 0.2µl NotI quickcut 0.2µlEcoRI quickcut 0.2µl(37℃15min) EcoRI quickcut0.2µl(37℃15min)T4 Ligase 1µl混合后16℃,过夜连接。
酶切酶连原理全文共四篇示例,供读者参考第一篇示例:酶切酶连是一种利用特定酶将DNA切割成片段的技术,常被用于DNA重组、基因克隆、DNA测序等实验中。
酶切酶切原理基于DNA 和酶之间的特异性相互作用,通过将DNA暴露给特定的酶,可实现对DNA进行精确的切割。
本文将详细介绍酶切酶连原理以及其在生物学研究中的应用。
酶切酶是一类可以识别特定DNA序列并切割这些序列的酶。
常用的酶切酶包括EcoRI、HindIII、BamHI等。
这些酶通常都是细菌产生的,用于细菌自我保护机制中。
酶切酶在体外环境下可以识别特定的DNA序列,然后将DNA切割成两段或多段。
这些切割点通常在特定序列的周围,形成粘性末端或平滑末端切口。
酶切酶的切割原理是基于DNA的序列特征。
DNA是由四种碱基(腺嘌呤、鸟嘌呤、胞嘧啶和胸腺嘧啶)组成的核苷酸序列。
当酶与DNA序列匹配时,它会识别并结合到特定的序列上。
酶切酶通常识别4~8个碱基组成的特定序列,被称为酶切位点。
一旦酶与DNA结合,它会切割DNA链,形成特定的切口。
酶切酶的切口可以是粘性末端切口或平滑末端切口。
粘性末端切口是指在切口的两端形成单链突出的DNA片段,这种切口有助于DNA重组。
平滑末端切口是指在切口的两端形成平滑的DNA片段,这种切口适合进行DNA连接反应。
利用酶切酶可以实现对DNA的精确切割,进而实现多种生物学实验,如基因克隆、DNA测序、PCR扩增等。
在基因克隆中,酶切酶被用来将感兴趣的DNA序列切割成片段,然后将片段插入质粒中。
在DNA测序中,酶切酶用来切割DNA,生成不同长度的片段,有助于测序。
在PCR扩增中,酶切酶可以用来切除重复序列,避免扩增产物出现。
酶切酶连原理是一种基于DNA序列特异性的技术,可以实现对DNA的精确切割。
通过利用酶切酶,我们可以在实验室中对DNA进行定制处理,满足各种生物学实验的需要。
酶切酶连技术的发展为生物学研究提供了强大的工具,带来了许多创新和突破。
酶切鉴定实验报告酶切鉴定实验报告引言:酶切鉴定是一种常用的分子生物学技术,通过酶切作用将DNA分子切割成特定的片段,从而确定DNA的序列和结构。
本实验旨在通过酶切鉴定技术,对DNA进行切割并进行分析,以进一步了解DNA的特性和应用。
材料与方法:实验所需材料包括DNA样品、限制性内切酶、缓冲液、电泳仪等。
首先,将DNA样品与限制性内切酶和缓冲液混合,反应一段时间后,将反应产物进行电泳分离。
接着,通过电泳仪观察DNA片段的迁移距离,并与已知的DNA标准进行对比,从而确定DNA的大小和序列。
结果与讨论:实验结果显示,经过酶切作用后,DNA样品被切割成多个片段。
通过电泳分离,我们观察到这些片段在凝胶上形成了明显的条带。
根据条带的迁移距离,我们可以初步确定DNA片段的大小。
进一步分析发现,不同的限制性内切酶对DNA的切割方式各不相同。
有些酶会将DNA切割成等长的片段,而有些酶则会产生不等长的片段。
这是由于限制性内切酶对DNA的特定序列具有识别和切割的能力。
通过比较不同酶切产生的片段大小,我们可以推断出DNA的序列和结构。
此外,我们还发现不同的DNA样品在酶切鉴定实验中表现出不同的特点。
有些DNA样品在特定的酶切条件下会产生多个片段,而有些则只会产生少数片段。
这可能是由于DNA样品中存在不同的限制性内切酶切割位点或序列变异导致的。
通过进一步的研究,我们可以深入了解这些DNA样品的特性和变异情况。
酶切鉴定技术在生物学研究和医学诊断中具有广泛的应用。
例如,在基因工程领域,科学家们可以利用酶切鉴定技术对重组DNA进行构建和验证。
通过切割和连接不同的DNA片段,他们可以构建出具有特定功能的重组DNA,并用于生物制药和基因治疗等领域。
此外,酶切鉴定技术还可以用于检测和鉴定病原微生物的DNA,从而帮助医生进行疾病的诊断和治疗。
结论:本实验通过酶切鉴定技术对DNA进行了切割和分析,初步确定了DNA的大小和序列。
通过观察不同酶切产生的DNA片段,并与已知的DNA标准进行对比,我们可以进一步了解DNA的特性和应用。
实验三、酶切与连接
一、实验目的与原理简介
限制性内切酶在基因工程中主要应用地以下两个方面:制作基因酶切图谱和进行基因克隆。
制作基因图谱,就是利用特定的酶切出特定的条带;
而利用基因克隆时选择酶应注意以下几个方面:
1)克隆片段的长度;2)克隆片段中切点的情况3)载体上切点的情况;
4)切割与连接方式;5)接头状态。
酶切方式可分为部分酶切和完全酶切两种:
1)部分酶是指同一DNA 片段上有些被切开而另一些未被切开,此法主要应用于基因 的克隆 。
用部分酶切法是基于基因内部可能有此酶的位点。
进行部分酶切可通过两个方式:一是不同的时间内在同一酶反应管中取样终止反应,利用时间来控制酶切的程度。
另一种是在其余条件相同时控制 酶的稀释度,利用不同酶浓度控制酶切程度,这种方法因易于控制反应而被广泛应用。
2)完全酶切法适用于如载体切割、酶切图谱的制作、基因的鉴定与DNA 片段的分离工作。
完全酶切又可分为单酶切、多酶切两种。
在多酶切反应中当2种或2种以上的酶有相同 的反应条件时,可同时进行酶切,不然须在前一种酶作用完成后将其失活,而后进行第二种酶切反应,这样可以避免片段混乱现象的出现。
二、材料和试剂
限制性内切酶NotI 、EcoRI ;10×Buffer , PCR 产物、pPIC9K 质粒、10×T4连接Buffer 、T4 Ligase 、DDW 、琼脂糖、电泳缓冲液 、Goldview 染液、胶回收试剂盒;电泳仪、恒温水浴锅、EP 管、移液枪、灭菌枪头、紫外检测仪
三、实验步骤
1)PCR 产物双酶切(NotI ,EcoRI ),pPI9K 质粒双酶切(NotI ,EcoRI );PCR 体系如下:
2)然后电泳检测后在紫外检测仪下观察(UV ,260nm )。
3)切胶回收(尽量不要切到不含目的片段的胶),按照胶回收试剂盒标准操作。
4)回收产物电泳检测后进行连接:
连接体系: 10×T4连接Buffer 1μl
目的基因 6μl
质粒载体 2μl
产物酶切体系
pPI9K 质粒酶切体系 DDW
4.6μl DDW 7μl 10×H
Buffer
1μl 10×H Buffer 1μl 目的片段
4μl pPI9K 质粒 1.6μl NotI quickcut 0.2μl NotI quickcut 0.2μl
EcoRI quickcut 0.2μl(37℃15min) EcoRI quickcut
0.2μl(37
℃15min)
T4 Ligase 1μl
混合后16℃,过夜连接。
完成后放入4℃冰箱可,备用。
四、注意事项
1、加样次序一般应为:水+缓冲液+DNA+酶。
2、限制性内切酶的量不要过多,最多不超过部体积的1/10,否则易发生酶的星号反应。
所谓酶的星号反应就是指改变酶切条件时酶的识别位点专一性下降,导致酶切图谱混乱的现象。
3、内切酶的选择和使用方案须根据具体的实验情况来精心设计。
4、限制性内切酶和连接酶都极易失活,须在冰盒上操作,同时防止污染。