第三章第二讲 氮的循环 专题
- 格式:docx
- 大小:1.48 MB
- 文档页数:5

氮及其化合物一、选择题1. 解析 硝酸是一种具有强氧化性的强酸,并且浓度越大,氧化性越强。
浓硝酸可使蓝色石蕊试纸先变红后退色,故选项A 错;硝酸是一种氧化性酸,可氧化很多还原性物质,所以硝酸与Na 2S 反应不能生成H 2S ,与Na 2CO 3反应能生成CO 2,所以选项B 、C 错;选项D 准确。
2.答案 C 解析 A 项,NO 在空气中不能稳定存有,易被O 2氧化为NO 2;B 项,n (NO)=1 mol ×23=23mol ,N (NO)=23N A ;C 项,pH =1时,NO -3氧化Fe 2+;D 项,溶液变黄,Fe 被HNO 3氧化为Fe 3+。
3. 解析 1个NH 4+中含有10个电子,A 错;NH 4+中N 元素的化合价为-3价,化合价最低在氧化还原反应中常作还原剂;B 错误;0.1 L 3 mol·L -1的NH 4NO 3溶液中的氮原子数为0.6 N A ;C 准确;铵根离子中,氮与氢原子之间为共价键,D 错。
答案 C4.解析 3体积的NO 2通过饱和NaHCO 3溶液,发生的反应有3NO 2+2NaHCO 3===2NaNO 3+H 2O +NO +2CO 2,剩余气体通过浓硫酸后除去H 2O ,通过Na 2O 2时发生反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2,此时剩余气体为1体积O 2和1体积NO ,排水法收集气体时发生反应4NO +3O 2+2H 2O===4HNO 3,显然O 2过量,剩余14体积O 2。
答案 C 5. 答案 B 解析 蛋白质遇浓硝酸显黄色,此反应常用于检验蛋白质,A 准确。
NH 4Cl分解生成的HCl 和NH 3遇冷又生成NH 4Cl(在试管中凝结),B 错。
NO 2不溶于CCl 4,Br 2易溶于CCl 4,根据CCl 4层的颜色区分红棕色气体是NO 2或是Br 2,C 准确。
在常温下,稀硝酸能氧化铜,而浓硫酸不能氧化铜,由此可推出稀硝酸的氧化性强于浓硫酸,D 准确。

第三章第二节氮的循环(1)一、氮气及氮的氧化物1.氮气占空气体积的。
在放电条伴下跟氧气化合生成NO直接跟化合生成化学方程式:N2分子的结构很,N2化学性质。
2.N2的化学性质N2 + H2→N2 + O2→N2+Mg→氮的固定是指的方法,氮的固定主要有自然固氮和人工固氮。
自然固氮的途径主要有两种:和,人工固氮包括和练习1、起氮的固定作用的化学反应是()A .NH3经催化氧化生成NOB .NO与O2反应生成NO2C .N2与H2在一定条件下反应生成NH3 D. NH3与NO2作用生成N23.NO的性质无色有毒、不溶于水的气体,能与血红蛋白作用。
NO + O2→不与碱作用生成盐,为不成盐氧化物。
4.NO2的性质(1)______色有毒、有_______气味的气体。
(2)二氧化氮与水反应:练习2、将盛有氮气和二氧化氮混合气体的试管倒立于水中,经过足够时间后,试管内气体体积缩小为原体积的一半,则原混合气体中氮气和二氧化氮的体积比是。
[思考]1.在新疆与青海交界处有一山谷,人称“魔鬼谷”。
经常电闪雷鸣,狂风暴雨,把人畜击毙。
然而谷内却是牧草茂盛,四季常青。
这是为什么?2. Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大发展,因此这三位教授荣获1998年诺贝尔医学及生理学奖。
关于NO的下列叙述不正确的是()A.NO可以是某些含低价N物质的氧化产物B.NO不是亚硝酸酸酐C.NO可以是某些高价N物质的还原的产物D.NO是红棕色气体[思考]3.NO2是否时硝酸的酸酐?说明理由。
填表:二、31、物理性质:色有气味的气体,密度比空气,溶于水且能快速溶解,常温常压下1体积水能溶解约体积氨气。
(1)练习3会看到烧瓶中的液体呈喷泉状喷出,最终几乎充满整个烧瓶。
则a和b不可能是()A、HCl和水B、O2和水C、NH3和水D、CO2和NaOH2、氨的化学性质(1)NH3与水的反应。
NH3·H2O很不稳定,受热会分解。






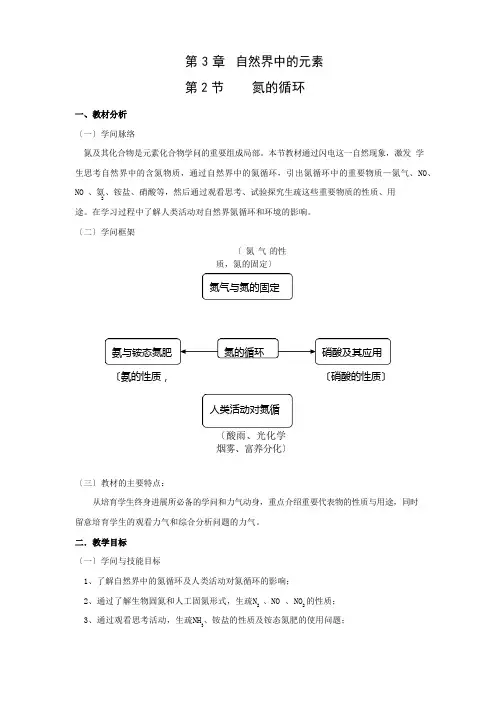
氮气与氮的固定氨与铵态氮肥氮的循环 硝酸及其应用人类活动对氮循第 3 章 自然界中的元素第 2 节氮的循环一、教材分析〔一〕学问脉络氮及其化合物是元素化合物学问的重要组成局部。
本节教材通过闪电这一自然现象,激发 学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO 、NO 、氨、铵盐、硝酸等,然后通过观看思考、试验探究生疏这些重要物质的性质、用 2途。
在学习过程中了解人类活动对自然界氮循环和环境的影响。
〔二〕学问框架〔 氮 气 的性质,氮的固定〕〔氨的性质,〔硝酸的性质〕〔酸雨、光化学烟雾、富养分化〕〔三〕教材的主要特点:从培育学生终身进展所必备的学问和力气动身,重点介绍重要代表物的性质与用途,同时留意培育学生的观看力气和综合分析问题的力气。
二.教学目标〔一〕学问与技能目标1、了解自然界中的氮循环及人类活动对氮循环的影响;2、通过了解生物固氮和人工固氮形式,生疏N 2 、NO 、NO 2 的性质;3、通过观看思考活动,生疏NH 3、铵盐的性质及铵态氮肥的使用问题;4、通过观看思考活动,生疏 HNO 的性质。
3〔二〕过程与方法目标1、培育学生通过观看试验现象,总结分析物质性质的力气;2、初步体会物质的浓度对化学反响产物的影响,进一步生疏试验中变量把握的思想。
〔三〕情感态度与价值观目标1、通过介绍合成氨进展的艰辛历程,体会从试验室争论到工业生产的过程,渗透化学与技术关系的教育;2、通过介绍酸雨,光化学烟雾和富养分化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。
三、重点、难点〔一〕学问上重点、难点重点:氮气、氨、铵盐和硝酸的性质。
难点:硝酸的氧化性。
〔二〕方法上重点、难点培育学生通过观看试验现象总结分析物质性质的力气,并使学生初步体会物质的浓度对化学反响产物的影响,进一步生疏试验中变量把握的重要性。
四、教学预备〔一〕学生预备1、预习其次节-氮的循环2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。


氮及其化合物化学辅导第九周资料辅导老师__________辅导学生___________________________________________________一、选择题1.下列有关硝酸化学性质的叙述中,正确的是 ( )。
A .浓、稀硝酸都能使蓝色石蕊试纸最终变为红色B .硝酸能与Na 2CO 3反应,但不生成CO 2C .硝酸可与Na 2S 反应制得H 2S 气体D .浓硝酸因分解放出的NO 2又溶解于硝酸而呈黄色2.下列说法正确的是( )。
A .CO 、NO 、NO 2都是大气污染气体,在空气中都能稳定存在B .1 mol Cu 和足量稀HNO 3反应产生N A 个NO 分子(N A 为阿伏加德罗常数)C .pH =1的溶液中,Fe 2+、NO -3、SO 2-4、Na +不能大量共存D .铁溶于稀HNO 3,溶液变黄,发生离子反应为3Fe +8H ++2NO -3===3Fe 2++2NO↑+4H 2O 3.铵盐是一类重要的氮的化合物,设N A 表示阿伏加德罗常数的值,下列叙述正确的是( )。
A .1 mol NH 4+含有的电子数为11N AB .NH 4+中N 元素的化合价为-3,在氧化还原反应中常作氧化剂C .0.1 L 3 mol·L -1的NH 4NO 3溶液中氮原子数等于0.6N AD .硫酸铵中既含有离子键,又含有共价键,而氯化铵中只含有离子键4.把3体积NO 2气体依次通过①饱和NaHCO 3溶液;①浓硫酸;①Na 2O 2后(假设每一步的反应都是充分的),再用排水法收集残留气体,则收集到的气体是( )。
A .1体积NOB .1体积NO 2和12体积O 2 C.14体积O 2 D.13体积NO 5.氮的多样性主要体现在含氮化合物及其性质的多样性上,下列说法不正确的是( )。
A.用浓硝酸与蛋白质的颜色反应鉴别部分蛋白质B.实验室可采用如图所示装置制取NH3C.实验室可用CCl4检验NO2和溴蒸气D.在常温下,稀硝酸的氧化性强于浓硫酸的6.已知常温常压下在1 L水中可溶解40 L NO2,NO2能与NaOH溶液发生反应:2NaOH+2NO2===NaNO3+NaNO2+H2O。
以下各种尾气吸收装置中,不适合吸收NO2气体的是()二、非选择题7.某兴趣小组用如图装置探究氨的催化氧化。
(1)氨催化氧化的化学方程式为______________________________________________。
(2)加热玻璃管2一段时间后,挤压1中打气球鼓入空气,观察到2中物质呈红热状态;停止加热后仍能保持红热,该反应是________反应(填“吸热”或“放热”)。
(3)为保证在装置4中观察到红棕色气体,装置3应装入________;若取消3,在4中仅观察到大量白烟,原因是_________________________________________________________。
(4)为实现氨的催化氧化,也可用装置5替换装置________(填装置代号);化合物X为________(只写一种),Na2O2的作用是____________________________。
8.某化学活动小组想通过如图所示装置(夹持装置已略去)进行实验,探究Na2O2与NO反应的产物。
实验前,他们查阅有关资料得到如下信息:①2NaNO 3=====①2NaNO 2+O 2↑;①NaNO 2为白色粉末状固体,既有氧化性又有还原性;①NaNO 2溶液显弱碱性(原因:强碱弱酸盐的水解)。
实验开始时,先在A 装置中加入适量的碳酸钙和足量稀硝酸,待不再有气体产生时,将铜丝插入稀硝酸中。
请回答下列问题:(1)A 装置中放入碳酸钙的目的是_____________________________________。
(2)装置B 、C 中的试剂分别是:B________、C________,E 的作用是______________________________________________________________。
(3)如何检验反应中是否有氧气生成? _______________________________。
(4)假如Na 2O 2已反应完全,为确定D 中固体产物的成分,甲同学将固体溶于水后,经测定发现溶液显强碱性,再向溶液中加入酸性高锰酸钾溶液,紫色退去。
由此现象推断固体产物中可能含有的物质是________(填化学式)。
(5)乙同学取适量固体于试管中密闭加热,发现白色固体部分变为淡黄色。
此现象说明固体中还可能含有的成分是________(填化学式)。
根据以上推测,请写出Na 2O 2与NO 反应的化学方程式_________________________________。
氮及其化合物一、选择题1. 解析 硝酸是一种具有强氧化性的强酸,并且浓度越大,氧化性越强。
浓硝酸可使蓝色石蕊试纸先变红后退色,故选项A 错;硝酸是一种氧化性酸,可氧化许多还原性物质,因此硝酸与Na 2S 反应不能生成H 2S ,与Na 2CO 3反应能生成CO 2,所以选项B 、C 错;选项D 正确。
2.答案 C 解析 A 项,NO 在空气中不能稳定存在,易被O 2氧化为NO 2;B 项,n (NO)=1 mol×23=23mol ,N (NO)=23N A ;C 项,pH =1时,NO -3氧化Fe 2+;D 项,溶液变黄,Fe 被HNO 3氧化为Fe 3+。
3. 解析 1个NH 4+中含有10个电子,A 错;NH 4+中N 元素的化合价为-3价,化合价最低在氧化还原反应中常作还原剂;B 错误;0.1 L 3 mol·L -1的NH 4NO 3溶液中的氮原子数为0.6 N A ;C 正确;铵根离子中,氮与氢原子之间为共价键,D 错。
答案 C4.解析 3体积的NO 2通过饱和NaHCO 3溶液,发生的反应有3NO 2+2NaHCO 3===2NaNO 3+H 2O +NO +2CO 2,剩余气体通过浓硫酸后除去H 2O ,通过Na 2O 2时发生反应2Na 2O 2+2CO 2===2Na 2CO 3+O 2,此时剩余气体为1体积O 2和1体积NO ,排水法收集气体时发生反应4NO +3O 2+2H 2O===4HNO 3,显然O 2过量,剩余14体积O 2。
答案 C 5. 答案 B 解析 蛋白质遇浓硝酸显黄色,此反应常用于检验蛋白质,A 正确。
NH 4Cl分解生成的HCl 和NH 3遇冷又生成NH 4Cl(在试管中凝结),B 错。
NO 2不溶于CCl 4,Br 2易溶于CCl 4,根据CCl 4层的颜色区分红棕色气体是NO 2或是Br 2,C 正确。
在常温下,稀硝酸能氧化铜,而浓硫酸不能氧化铜,由此可推出稀硝酸的氧化性强于浓硫酸,D 正确。
6.解析 由于常温常压下在1 L 水中NO 2可溶解40 L ,即易溶于水,所以在吸收装置中需要防止倒吸,只有B 中不能防止倒吸。
答案 B二、非选择题7. 答案 (1)4NH 3+5O 2=====催化剂①4NO +6H 2O(2)放热(3)浓硫酸 生成的NO 与O 2反应生成NO 2,NO 2与水反应生成HNO 3,NH 3与HNO 3反应生成了NH 4NO 3(4)1 NH 4Cl 与HCl 反应生成氧气(合理答案即可)解析 氨的催化氧化,首先要制备NH 3和O 2,可得出装置1的作用:制备NH 3和O 2。
在装置2中NH 3和O 2在催化剂、加热条件下,反应生成NO 和H 2O 。
(3)利用装置3除去H 2O 及未反应的NH 3,在装置4中NO 被氧化为NO 2。
若取消装置3,在装置4中生成的NO 与O 2反应生成NO 2,NO 2与水反应生成HNO 3,NH 3与HNO 3反应生成了NH 4NO 3。
(5)装置5是制备NH 3和O 2。
8. 解析 本题探究NO 与过氧化钠的反应,实验设计必须考虑如下因素:①产生NO 时,要除尽装置中的空气;①装置必须干燥,防止水与过氧化钠反应;①排尽装置中的二氧化碳,防止二氧化碳与过氧化钠反应;①采取措施,防止空气进入装置。
新信息挖掘:反应①暗示如果产物中有硝酸钠,受热会产生氧气;信息①暗示若D 中固体呈黄色,一定有硝酸钠、亚硝酸钠以外的物质生成;亚硝酸钠具有还原性,加入强氧化剂如酸性高锰酸钾溶液,会发生反应,高锰酸钾溶液由红色变成无色。
信息①暗示亚硝酸钠溶液呈弱碱性,若产物溶于水呈强碱性,说明有强碱生成。
若显中性,说明没有亚硝酸钠生成。
由以上分析,若Na 2O 2已反应完全,D 中固体产物溶于水,溶液显强碱性说明含有Na 2O ,向溶液中加入酸性KMnO 4溶液,紫色退去,说明存在还原性物质,即可能有NaNO 2,D中白色固体产物密闭加热部分变为淡黄色,说明其中还有NaNO 3,2NaNO 3=====①2NaNO 2+O 2↑、生成的O 2再次把Na 2O 氧化为Na 2O 2而显淡黄色,由此可知Na 2O 2与NO 反应的产物有NaNO 3、NaNO 2和Na 2O ,其反应的化学方程式为:2Na 2O 2+2NO===NaNO 3+NaNO 2+Na 2O答案 (1)使碳酸钙与稀硝酸反应生成CO 2,排除装置中的空气(2)NaOH 溶液 浓硫酸 防止空气中的CO 2、水蒸气进入装置D 中,干扰产物的判断 (3)将带火星的木条放在E 装置的气体出口处,观察木条是否复燃,若复燃,则说明有氧气生成;若不复燃,说明无氧气产生(4)Na 2O 、NaNO 2(5)NaNO 3 2Na 2O 2+2NO===NaNO 3+NaNO 2+Na 2O。