第2节 氮的循环
- 格式:ppt
- 大小:854.50 KB
- 文档页数:35

第1讲氮的循环第二节氮的循环(1)氮气的物理性质:在通常状况下,氮气是一种无色无味、难溶于水的气体。
在空气中约占其体积的78%(2)化学性质:在通常情况下,氮气的化学性质不活泼,很难与其他物质发生反应。
但在一定条件下,氮气能与氧气、氢气等物质发生反应。
反应方程式:(3)使空气中游离态的氮转化为含氮化合物的方法叫氮的固定,简称固氮。
分为自然固氮和人工固氮。
(4)氮的氧化物有六种:N2O、NO、N2O3、NO2、N2O4、N2O5 。
NO是无色、难溶于水的气体,易被空气中的氧气氧化为NO2:______________ ;NO2是红棕色、有刺激性气味有毒的气体,易溶于水,重要的反应有:(5)氨是没有颜色、有刺激性气味的气体,比空气轻,极易溶于水而且能快速溶解,在常温下1体积水大约能溶700体积的氨气。
易液化,常作制冷剂。
(6)氨的喷泉实验要成功,需保证烧瓶和烧杯液体之间有足够大的压强差,为此需注意三方面:①氨气要收集满②氨和烧瓶都要干燥③气密性要良好(7)氨的化学性质:a、与水反应______________________,溶液显碱性。
b、与酸反应NH3+HCl==NH4Cl 将分别蘸有浓盐酸和浓氨水的两根玻璃棒靠近(不要接触),会有白烟产生,原因是挥发出来的HCl和NH3两气体相遇,生成了NH4Cl固体小颗粒。
这也是检验氨气的方法之一。
c、与O 2反应______ ___________________(8)氨的实验室制法原理:装置:固——固反应加热装置(与制取O2装置相同)收集方法:只能用向下排空气法干燥方法:用碱石灰、固体NaOH等检验方法:①用湿润的红色石蕊试纸(变蓝)②蘸有浓盐酸的玻璃棒接近瓶口(产生白烟)棉花团的作用:防止NH3与空气形成对流,提高了收集NH3的纯度。
(9)铵盐都是白色晶体,都溶于水。
不稳定,受热易分解:与碱反应都能生成氨气,离子方程式为:,产生的气体能使红色石蕊试纸变蓝,故一般用这个原理来检验铵盐。






氮的循环1 氮在自然界中的循环1.主要形式(1)游离态→化合态①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
2.氮气与氮的固定(1)氮气的物理性质:无色无味气体,难溶于水,与空气密度相近。
(2)氮气的化学性质:①与O 2的反应在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮(NO )。
反应式为:N 2+O 22NO说明:在雷雨天气,汽车的发动机中均可以发生该反应。
在该反应中,N 2表现出还原性。
②与H 2反应N 2+3H 2高温、高压催化剂2NH 3说明:a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。
在该反应中,N 2表现出氧化性。
b 在氮气跟氢气反应生成氨的同时,氨气也在分解生成氮和氢气。
像这样同时向正反两个方向进行的反应称为可逆反应。
在可逆反应的化学方程式中用“”代替“=”。
(3)氮的固定① 定义:将空气中游离的氮转变成氮的化合物的方法叫做氮的固定。
② 分类:(3)NO 和NO 2氮的固定 自然固氮 人工固氮 高能固氮(闪电,约占10%) 生物固氮(约占90%) 合成氨 仿生固氮2 氨与铵态氮肥1.氨(1)物理性质:无色、有刺激性气味比空气轻;极易溶于水,在常温、常压下1体积水能溶解约700体积氨气。
(2)化学性质:①碱性:氨与水、酸反应时显碱性与水反应:NH3+H2O NH3·H2O NH4++OH-与酸反应:NH3+HCl=NH4Cl说明:a氨溶于水,大部分与水结合成一水合氨(NH3·H2O),一水合氨少部分电离,因此,氨水显弱碱性。
氨气是中学阶段唯一的一种碱性气体,利用这一点,可以检验NH3。

第二节氮的循环(第一课时)☆课程目标:(1)了解自然界中的氮循环及人类活动对氮循环的影响;(2)通过了解生物固氮和人工固氮形式,认识N2、NO、NO2的性质。
重点难点:氮气、氮的氧化物(NO、NO2)的性质。
☆课前预习·导学一、氮在自然界中的循环1、氮的存在形态氮是地球上含量丰富的一种元素,以的形式存在于大气中,以的形式存在于动植物体、土壤和水体中。
2、氮在自然界中的循环(1)在自然界中豆科植物根部的,把空气中的氮气转变为等含氮的化合物。
植物的根从土壤中吸收和,经过复杂的生物转化形成各种最后转化为。
动植物遗体中的蛋白质被微生物分解成,回到,被植物利用。
在放电条件下,空气中少量的和化合生成并随水进入土壤和水体。
(2)人们通过化学方法把空气中氮气转化为,再根据需要进一步转化成各种。
(3)化石燃料燃烧、森林和农作物的枝叶燃烧产生的如通过大气进入陆地和海洋,参与氮的循环。
二、氮循环中的重要物质1、氮气(1)物理性质(2)化学性质a与O2反应:b与N2反应:可逆反应:在相同条件下能同时向正反两个方向进行的反应。
2氮的固定氮的固定:使空气中的氮转化为,化学方程式固氮氮的固定固氮化学方程式生物固氮:自然界中的一些微生物种群(如豆科植物的根瘤菌)将空气中的氮气通过生物化学过程转化为含氮化合物,约占自然固氮的90%。
☆课堂训练·检测1.下列几种固氮方式中属于人工固氮的()A.闪电时空气中的氮气转化为一氧化氮B.豆科作物根瘤菌将氮气转化为化合态氮C. NO与O2反应制备NO2D.由N2与H2在一定条件下反应合成NH3解析:自然固氮:通过闪电或一些微生物种群将空气中的氮气通过生物化学过程转化为含氮的化合物3、NO、NO的性质比较结合的能力比一样氧。
不过,人们也发现了它在生物学方面的独特作用。
一氧化氮分子作为一种传递神经信息的“”,在血管扩张、免疫、增强记忆力等方面有着极其重要的作用。
相互转变:☆课堂训练·检测1、以下气体因为与血液中血红蛋白作用引起中毒的是(双选)()A、NOB、COC、NO2D、NH32、通常情况下,把下列气体混合,能发生反应的是()A、NO和O2B、NH3和N2C、N2和H2D、O2和N23、我国“神州5号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。

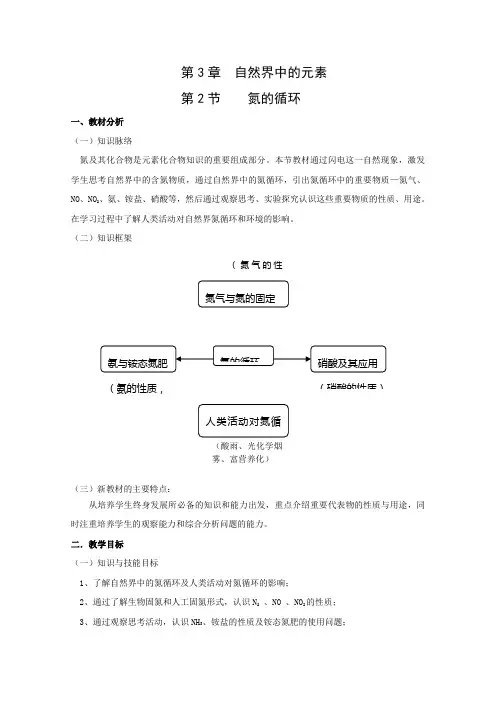
第3章自然界中的元素第2节氮的循环一、教材分析(一)知识脉络氮及其化合物是元素化合物知识的重要组成部分。
本节教材通过闪电这一自然现象,激发学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO、NO2、氨、铵盐、硝酸等,然后通过观察思考、实验探究认识这些重要物质的性质、用途。
在学习过程中了解人类活动对自然界氮循环和环境的影响。
(二)知识框架(氮气的性(氨的性质,(硝酸的性质)(酸雨、光化学烟雾、富营养化)(三)新教材的主要特点:从培养学生终身发展所必备的知识和能力出发,重点介绍重要代表物的性质与用途,同时注重培养学生的观察能力和综合分析问题的能力。
二.教学目标(一)知识与技能目标1、了解自然界中的氮循环及人类活动对氮循环的影响;2、通过了解生物固氮和人工固氮形式,认识N2、NO 、NO2的性质;3、通过观察思考活动,认识NH3、铵盐的性质及铵态氮肥的使用问题;4、通过观察思考活动,认识 HNO3的性质。
(二)过程与方法目标1、培养学生通过观察实验现象,总结分析物质性质的能力;2、初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的思想。
(三)情感态度与价值观目标1、通过介绍合成氨发展的艰辛历程,体会从实验室研究到工业生产的过程,渗透化学与技术关系的教育;2、通过介绍酸雨,光化学烟雾和富营养化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。
三、重点、难点(一)知识上重点、难点重点:氮气、氨、铵盐和硝酸的性质。
难点:硝酸的氧化性。
(二)方法上重点、难点培养学生通过观察实验现象总结分析物质性质的能力,并使学生初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的重要性。
四、教学准备(一)学生准备1、预习第二节-氮的循环2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。
重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的?(二)教师准备1、教学媒体、课件;2、补充实验。
