第二节氮的循环
- 格式:doc
- 大小:184.00 KB
- 文档页数:9



氮的循环1 氮在自然界中的循环1.主要形式(1)游离态→化合态①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
2.氮气与氮的固定(1)氮气的物理性质:无色无味气体,难溶于水,与空气密度相近。
(2)氮气的化学性质:①与O 2的反应在放电条件下,氮气跟氧气能直接化合生成无色的一氧化氮(NO )。
反应式为:N 2+O 22NO说明:在雷雨天气,汽车的发动机中均可以发生该反应。
在该反应中,N 2表现出还原性。
②与H 2反应N 2+3H 2高温、高压催化剂2NH 3说明:a 该反应是工业上合成氨的反应原理,具有非常重要的现实意义。
在该反应中,N 2表现出氧化性。
b 在氮气跟氢气反应生成氨的同时,氨气也在分解生成氮和氢气。
像这样同时向正反两个方向进行的反应称为可逆反应。
在可逆反应的化学方程式中用“”代替“=”。
(3)氮的固定① 定义:将空气中游离的氮转变成氮的化合物的方法叫做氮的固定。
② 分类:(3)NO 和NO 2氮的固定 自然固氮 人工固氮 高能固氮(闪电,约占10%) 生物固氮(约占90%) 合成氨 仿生固氮2 氨与铵态氮肥1.氨(1)物理性质:无色、有刺激性气味比空气轻;极易溶于水,在常温、常压下1体积水能溶解约700体积氨气。
(2)化学性质:①碱性:氨与水、酸反应时显碱性与水反应:NH3+H2O NH3·H2O NH4++OH-与酸反应:NH3+HCl=NH4Cl说明:a氨溶于水,大部分与水结合成一水合氨(NH3·H2O),一水合氨少部分电离,因此,氨水显弱碱性。
氨气是中学阶段唯一的一种碱性气体,利用这一点,可以检验NH3。

第二节氮的循环第一课时氮的循环氮气一、教学设计说明本节课通过闪电这一自然现象,引出氮在自然界的循环,让学生解释氮循环示意图,了解氮循环主要过程,逐渐接触含氮的物质,体会氮循环的重要意义。
在基础上,初步掌握氮循环中的重要物质之一-----氮气的性质,了解氮的固定及其分类。
本节课的教学过程设计:首先通过联想质疑闪电这一自然现象,激发学生思考自然界中的含氮物质。
其次,通过学生活动,了解氮循环的主要环节,体会氮循环的重要意义。
关于氮气性质的教学,密切结合学生已有的经验,在氮循环的基础上展示其中的主要过程,探讨发生的主要化学反应,以及这些化学反应有哪些重要的应用,最后,让学生了解氮的固定及其分类,认识氮固定的重要意义。
二、教学目标1、知识与技能目标(1)通过自然界中的氮循环,了解氮循环的基本过程,认识氮循环过程中的重要物质。
掌握氮气的性质;了解氮的固定及氮固定的主要形式。
(2)了解氮的两种的氧化物一氧化氮和二氧化氮的颜色、状态、溶解性;掌握一氧化氮与本节课是在氮循环的基础上,继续学习氮循环中的重要物质——氨和铵盐。
通过实验,掌握氨和铵盐的性质,知道实验室制氨的原理及氨的检验方法,知道氨根离子的检验方法。
认识铵态氮肥的使用问题,了解它们在生产中的应用。
本节课的教学过程:通过演示实验,让学生解释现象,总结性质。
并从化合价变化角度判断氧化还原反应及氧化剂和还原剂。
二、教学目标:☆知识与技能目标1、知识目标了解NH3的物理性质;掌握NH3的化学性质;了解NH3的用途。
2、能力目标(1)通过对氨溶于水产生喷泉现象的实验探究,使学生加深对氨的性质的理解,理解喷泉产生的“动力”,培养学生运用知识解决新情景下新问题的能力。
(2)通过引导学生观察、分析实验现象,培养学生观察能力和分析推理能力。
☆过程与方法目标1、通过对实验现象的推理分析,培养学生一切从实际出发,由表及里,以严密的逻辑推理得出结论的思维方法。
2、利用丰富的实验素材,引导学生形成问题意识,培养学生积极思考、参与讨论和交流的良好习惯。

LOGO普通高中课程标准实验教科书化学1(必修)第三章第二节氮的循环知识回顾1.碳在自然界中的存在形态?2.碳酸钠、碳酸氢钠有哪些化学性质?联想·质疑闪电闪电时空气中会发生哪些化学反应?产生了哪些物质?这些反应和生成的物质对人类的生产和生活有什么意义?一、氮在自然界中的循环二、氮循环中重要物质及其变化1.氮气与氮的固定N2分子中,两个氮原子之间共用三对电子,使每个原子都达到稳定结构常温下性质稳定高温高压催化剂,放电氮的化合物在雷电交加的雨天放电N2+O2 2NO(NO是有毒、无色、难溶入水)2NO+O2 = 2NO2是有毒、红棕色、与水反应)(NO23NO2+H2O = 2HNO3+NONO与NO2的比较NO NO2物理性质化学性质无色有刺激性气味气体难溶于水,剧毒!红棕色有刺激性气味气体,能溶于水,剧毒!2NO+O2=2NO23NO2+H2O=2HNO3+NO在高温、高压和有催化剂N2+3H2 2NH3(可逆反应)催化剂高温高压游离态化合态氮的固定放电如:N 2+O 2 2NO N 2+3H 2 2NH 3小结:氮的固定人工固氮生物固氮高能固氮 自然固氮 氮的固定讨论与交流1.现给你一试管二氧化氮,其它药品和仪器自选,根据前面所学的反应,请你设计实验,要求尽可能多的使二氧化氮被水吸收。
2.你的设计对工业上生产硝酸有什么启示?充分利用原料,减少污染物的排放4NO2+O2+2H2O= 4HNO3课堂练习1.在一烧瓶中将NO2和O2以4:1的体积比(标准状况)混合,倒置于足量水中充分反应后所得0.036溶液的物质的量浓度为 mol/L2.将12mlNO2和O2的混合气体通入足量的水中,充分反应后余气2ml(气体均在相同状态下测定)求原各气体的体积。
NO2 8ml、O2 4ml或NO2 10.8ml、O2 1.2ml2.氨与铵态氮肥观察与思考实验实验现象结论NH3的喷泉实验NH3与HCl 形成红色喷泉产生大量白烟氨气极易溶于水1:680生成NH4Cl固体思考:1.氨溶解于水仅是简单的溶解过程吗?喷泉呈现红色说明了什么?2.[实验2]中的现象为什么会发生?这个实验说明浓氨水和浓盐酸各具有什么性质?3.氨中氮元素的化合价是-3价,请从化合价的角度分析,氨还可能具有什么性质?它可能与哪些物质发生反应?(1)氨的性质①物理性质:没有颜色、有刺激性气味的气体;在标准状况下,密度为0.771g·L-1,比空气轻;极易溶于水且能快速溶解,在常温、常压下1体积水能溶解约700体积的氨气。

第二节氮的循环(第一课时)☆课程目标:(1)了解自然界中的氮循环及人类活动对氮循环的影响;(2)通过了解生物固氮和人工固氮形式,认识N2、NO、NO2的性质。
重点难点:氮气、氮的氧化物(NO、NO2)的性质。
☆课前预习·导学一、氮在自然界中的循环1、氮的存在形态氮是地球上含量丰富的一种元素,以的形式存在于大气中,以的形式存在于动植物体、土壤和水体中。
2、氮在自然界中的循环(1)在自然界中豆科植物根部的,把空气中的氮气转变为等含氮的化合物。
植物的根从土壤中吸收和,经过复杂的生物转化形成各种最后转化为。
动植物遗体中的蛋白质被微生物分解成,回到,被植物利用。
在放电条件下,空气中少量的和化合生成并随水进入土壤和水体。
(2)人们通过化学方法把空气中氮气转化为,再根据需要进一步转化成各种。
(3)化石燃料燃烧、森林和农作物的枝叶燃烧产生的如通过大气进入陆地和海洋,参与氮的循环。
二、氮循环中的重要物质1、氮气(1)物理性质(2)化学性质a与O2反应:b与N2反应:可逆反应:在相同条件下能同时向正反两个方向进行的反应。
2氮的固定氮的固定:使空气中的氮转化为,化学方程式固氮氮的固定固氮化学方程式生物固氮:自然界中的一些微生物种群(如豆科植物的根瘤菌)将空气中的氮气通过生物化学过程转化为含氮化合物,约占自然固氮的90%。
☆课堂训练·检测1.下列几种固氮方式中属于人工固氮的()A.闪电时空气中的氮气转化为一氧化氮B.豆科作物根瘤菌将氮气转化为化合态氮C. NO与O2反应制备NO2D.由N2与H2在一定条件下反应合成NH3解析:自然固氮:通过闪电或一些微生物种群将空气中的氮气通过生物化学过程转化为含氮的化合物3、NO、NO的性质比较结合的能力比一样氧。
不过,人们也发现了它在生物学方面的独特作用。
一氧化氮分子作为一种传递神经信息的“”,在血管扩张、免疫、增强记忆力等方面有着极其重要的作用。
相互转变:☆课堂训练·检测1、以下气体因为与血液中血红蛋白作用引起中毒的是(双选)()A、NOB、COC、NO2D、NH32、通常情况下,把下列气体混合,能发生反应的是()A、NO和O2B、NH3和N2C、N2和H2D、O2和N23、我国“神州5号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。

第3章自然界中的元素第2节氮的循环一、教材分析(一)知识脉络氮及其化合物是元素化合物知识的重要组成部分。
本节教材通过闪电这一自然现象,激发学生思考自然界中的含氮物质,通过自然界中的氮循环,引出氮循环中的重要物质—氮气、NO、NO2、氨、铵盐、硝酸等,然后通过观察思考、实验探究认识这些重要物质的性质、用途。
在学习过程中了解人类活动对自然界氮循环和环境的影响。
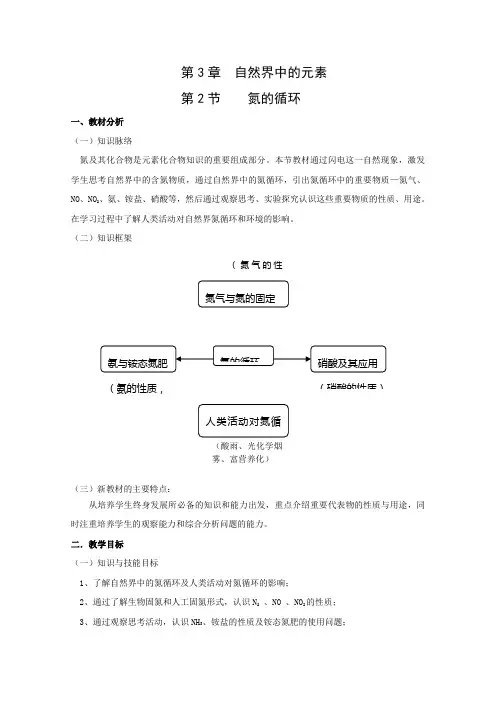
(二)知识框架(氮气的性(氨的性质,(硝酸的性质)(酸雨、光化学烟雾、富营养化)(三)新教材的主要特点:从培养学生终身发展所必备的知识和能力出发,重点介绍重要代表物的性质与用途,同时注重培养学生的观察能力和综合分析问题的能力。
二.教学目标(一)知识与技能目标1、了解自然界中的氮循环及人类活动对氮循环的影响;2、通过了解生物固氮和人工固氮形式,认识N2、NO 、NO2的性质;3、通过观察思考活动,认识NH3、铵盐的性质及铵态氮肥的使用问题;4、通过观察思考活动,认识 HNO3的性质。
(二)过程与方法目标1、培养学生通过观察实验现象,总结分析物质性质的能力;2、初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的思想。
(三)情感态度与价值观目标1、通过介绍合成氨发展的艰辛历程,体会从实验室研究到工业生产的过程,渗透化学与技术关系的教育;2、通过介绍酸雨,光化学烟雾和富营养化等环境问题,了解人类活动对氮循环的影响,树立保护环境的意识。
三、重点、难点(一)知识上重点、难点重点:氮气、氨、铵盐和硝酸的性质。
难点:硝酸的氧化性。
(二)方法上重点、难点培养学生通过观察实验现象总结分析物质性质的能力,并使学生初步体会物质的浓度对化学反应产物的影响,进一步认识实验中变量控制的重要性。
四、教学准备(一)学生准备1、预习第二节-氮的循环2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。
重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的?(二)教师准备1、教学媒体、课件;2、补充实验。


