2019高考化学二轮冲刺复习精讲第一部分必考部分第6讲电化学基础真题追踪含解析
- 格式:doc
- 大小:25.40 KB
- 文档页数:13
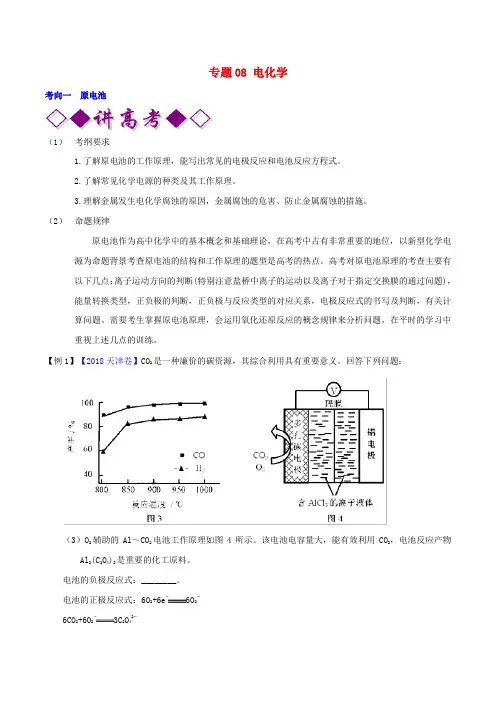
专题08 电化学考向一原电池(1)考纲要求1.了解原电池的工作原理,能写出常见的电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
3.理解金属发生电化学腐蚀的原因,金属腐蚀的危害、防止金属腐蚀的措施。
(2)命题规律原电池作为高中化学中的基本概念和基础理论,在高考中占有非常重要的地位,以新型化学电源为命题背景考查原电池的结构和工作原理的题型是高考的热点。
高考对原电池原理的考查主要有以下几点:离子运动方向的判断(特别注意盐桥中离子的运动以及离子对于指定交换膜的通过问题),能量转换类型,正负极的判断,正负极与反应类型的对应关系,电极反应式的书写及判断,有关计算问题。
需要考生掌握原电池原理,会运用氧化还原反应的概念规律来分析问题,在平时的学习中重视上述几点的训练。
【例1】【2018天津卷】CO2是一种廉价的碳资源,其综合利用具有重要意义。
回答下列问题:(3)O2辅助的Al~CO2电池工作原理如图4所示。
该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________。
电池的正极反应式:6O2+6e−6O2−6CO2+6O2−3C2O42−反应过程中O2的作用是________。
该电池的总反应式:________。
【答案】Al–3e–=Al3+(或2Al–6e–=2Al3+)催化剂 2Al+6CO2=Al2(C2O4)3【解析】(3)明显电池的负极为Al,所以反应一定是Al失电子,该电解质为氯化铝离子液体,所以Al失电子应转化为Al3+,方程式为:Al–3e–=Al3+(或2Al–6e–=2Al3+)。
根据电池的正极反应,氧气再第一步被消耗,又在第二步生成,所以氧气为正极反应的催化剂。
将方程式加和得到,总反应为:2Al+6CO2=Al2(C2O4)3。
【例2】【2016年高考新课标Ⅱ卷】Mg-AgCl电池是一种以海水为电解质溶液的水激活电池。

1/17第6讲电化学根底考向一新型化学电源的分析与推断1. 〔2021 •全国卷H〕我国科学家研发了一种室温下“可呼吸〞的Na—CO 2二次电池.将NaCIO4溶于有机溶剂作为电解液,钠和负载碳纳米管的锲网分别作为电极材料,电池的总反响为:3C02+4Na2Na 2C03 + Co以下说法错误的选项是0 A.放电时,CI04向负极移动B.充电时释放CO 2,放电时吸收C.2C.放电时,正极反响为:3CO2+4e===2CO3 + CD.充电时,正极反响为:Na + e===Na[解析]高氯酸根离子是阴离子,电池放电时为原电池装置,阴离子向负极移动,A正确;由题图结合电池总反响知,充电时释放二氧化碳,放电时吸收二氧化碳,B正确;放电时,正极反响可以理解为"CO2/172得到4e复原为C,余下的两个.进一步结合CO 2生成CO 3 〞:3CO2 + 4e===2CO3 + C, C正确;充电时电池的正极与外接电源的正极相连,作电解池的阳极,发生失电子的氧化反响,应为碳失电子生成CO2, D错误.[答案]D2.〔2021 •全国卷H〕全固态锂硫电池能量密度高、本钱低,其工作原理如下图,其中电极a常用掺有石墨烯的S8材料,电池反响为:16Li+xS 8===8Li 2Sx〔2<x<8〕.以下说法错误的选项是0 A.电池工作时,正极可发生反应:2Li 2s6+2Li+2e===3Li 2S4B.电池工作时,外电路中流过0.02mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提升电极a的导电性D.电池充电时间越长,电池中Li3/172s 2的量越多[解析]原电池工作时,正极发生一系列得电子的复原反响,即:Li 2s 8fLi2s 6fLi2s 4fLi2S2,其中可能有2Li 2s6+2Li + 2e===3Li 2S4, A项正确;该电池工作时,每转移0.02 mol电子,负极有0.02 mol Li〔质量为O14g〕被氧化为Li,那么负极质量减少0.14g, B项正确;石墨烯能导电,用石墨烯作电极,可提升电极a的导电性,C项正确;充电过程中,Li 2S2的量逐渐减少,当电池充满电时,相当于到达平衡状态,电池中Li 2S2的量趋于不变,故不是电池充电时间越长,电池中Li 2s4/172的量越多,D项错误.[答案]D3. (2021 •全国卷I )微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如下图.以下有关微生物电池的说法错误的选项是()++ -+ -A.正极反响中有CO 2生成B.微生物促进了反响中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反响为 C 6H 120 6 + 60 2===6CO 2 + 6H 20[解析]由题意可知,微生物电池的原理是在微生物作用下.2与C5/176H 1206发生氧化复原反响,将化学能转化为电能,B正确;氧气在正极反响,由于质子交换膜只允许H通过,那么正极反响为:02+4e + 4H===2H 20,没有CO2生成,A项错误;负极发生反响:C6H 1206-24e --------- F + + 6H 2O===6CO2 + 24H, H在负极区生成,移向正极区,在正极被消耗,C项正确;总反响+ +为:C 6H 120 6 + 60 2===6CO 2 + 6H20, D项正确.[答案]A4. (1)(2021 •天津卷)CO6/172是一种廉价的碳资源,其综合利用具有重要意义.答复以下问题:2辅助的Al —C.2电池工作原理如下图.该电池电容量大,能有效利用C.2, 电池反响产物Al 2(C 20 4)3是重要的化工原料.电池的负极反响式:o电池的正极反响式:6O2 + 6e===6O2; 6CO2 + 6O 2===3C 20 4+ 60 2反响过程中.2的作用是o该电池的总反响式:o7/17〔2〕〔2021 •北京卷〕实验证实Ag + Fe===Ag + Fe能发生,装置如下图.其中甲溶液是,操作及现象是o〔3〕〔2021 •江苏卷〕铁炭混合物在水溶液中可形成许多微电池.将含有Cr 207的酸性废水通过铁炭混合物,在微电池正极上Cr 20 7转化为Cr〔4〕〔2021 •天津卷〕氢能是开展中的新能源,它的利用包括氢的制备、储存和应用三个环节.答复以下问题:与汽油相比,氢气作为燃料的优点是__________________________________〔至少答出两点〕.但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反响式:.〔5〕〔2021 •四川卷〕FeS.4在一定条件下可制得FeS2〔二硫化亚铁〕纳米材料.该材料可用于制造高容量锂电池,电池放电时的总反响为4Li + FeS2===Fe + 2Li 2S,正极反响式是o 2 — 3 + 2—F2 + 3+_____ 2 _,其电极反响式为[解析](1)0 2辅助的Al —CO8/172电池中,AI是活泼金属,作负极,发生氧化反响,电极反响式为Al —3e二二二AI.由电池的正极反响式可知,02先生成0 2, 02与C02反响生成C2.4—3+ ——2—和0 2,据此推测,该过程中.2的作用是催化剂.根据正、负极反响式及得失电子守恒得电池的总反响式为2AI + 6CO2===AI 2(C 20 4)3o[答案]3e===AI(或2A— 6e===2AI)催化剂2AI + 6CO 2===AI2(C2O 4) 3(2)FeSO9/174溶液取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深.⑶Cr 207 + 14H + 6e===2Cr+7H 20⑷污染小,可再生,来源广,资源丰富,燃烧热值高(任写其中2 个)H2 + 2OH-2e ——2— + —3 +一3+—3 + ===2H 20 (5)FeS2+4Li+4e===Fe + 2Li 2s(或FeS 2+4e===Fe + 2S)考向二电解原理在工农业生产中的应用5. (2021 •全国卷H)用电解氧化法可以在铝制品外表形成致密、耐腐蚀的氧化膜,电+ ——2-解质溶液一般为H 2SO 4—H 2C10/17204混合溶液.以下表达错误的选项是0A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反响式为:AI + 3e===AID.硫酸根离子在电解过程中向阳极移动[解析]利用电解氧化法在铝制品外表形成致密的AI 203薄膜,即待加工铝质工件作阳极,A项正确;阴极与电源负极相连,对阴极电极材料没有特殊要求,可选用不锈钢网等,B项正确;电解质溶液呈酸性,阴极上应是H放电,C项错误;在电解过程中,电解池中的阴离子向阳极移动,D项正确.[答案]C6.(2021 •全国卷I)焦亚硫酸钠(Na 2s 205)在医药、橡胶、印染、食品等方面应用广泛.答复以下问题:制备Na 2s 205也可采用三室膜电解技术,装置如下图,其中S.11/172碱吸收液中含有NaHSO 3和Na 2S03.阳极的电极反响式为+3+-电解后,室的NaHSO3浓度增加.将该室溶液进行结晶脱水,可得到Na 2s 20 5.[解析]装置图中左侧与电源正极相连,为三室膜电解槽的阳极, 由于阳极室的溶液为稀硫酸,故阳极发生的反响为2H2O-4e===4H + O2 t ,生成的H穿过阳离子交换膜进入a室与S0 2碱吸收液中的S0 3反响生成HS.3,那么a室中NaHSO 3浓度增加.[答案]2H 2O-4e===4H + O12/17 2 t a-+2——- + +7. (1)(2021 •浙江卷)研究证实,C02也可在酸性水溶液中通过电解生成甲醇,那么生成甲醇的反响发生在极,该电极反响式是O(2)(2021 •天津卷)化工生产的副产物氢也是氢气的来源.电解法制取有广泛用途的通电Na 2FeO4,同时获得氢气:Fe + 2H 2O + 2OH=====FeO 4 + 3H2t ,工作原理如图1所示.装置通电后,铁电极附近生成紫红色FeO4,银电极有气泡产生.假设氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质.:Na2FeO4只在强碱性条件下稳定,易被H 2复原.13/17①电解一段时间后,c(OH)降低的区域在(填“阴极室〞或“阳极室〞②电解过程中,须将阴极产生的气体及时排出,其原由于③ c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na 2FeO4)低于最高值的原因:o[解析](1)根据题意,二氧化碳在酸性水溶液中通过电解生成甲醇,C0 2中C呈+ 4价,CH30H中C呈一2价,结合反响前后碳元素化合价变化,可知碳元素的化合价降低,得到电子,故该电极为阴极,电极反响式为co2 + 6H + 6e===CH 30H + H20o⑵①根据题意,银电极有气泡产生是H得电子生成H2,发生复原反响,那么铁电极上0H发生氧化反响,溶液中的0H 减少,因此电解一段时间后,c(OH)降低的区域在阳极室.②H2具有复原性,根据题意:Na 2FeO4只在强碱性条件下稳定,易被H2复原.因此,电解过程中,须将阴极产生的气体及时排出,防止Na14/172FeO 4 与H2反响使产率降低.③根据题意Na 2FeO4只在强碱性条件下稳定,在M点:c(OH)低,Na 2FeO4稳定性差,且反响慢;在N点:c(OH)过高,铁电极上有Fe(OH)3生成,使Na2FeO4产率降低.[答案]⑴阴CO 2 + 6H + 6e===CH 30H + H 20(2)①阳极室②预防Na 2FeO 4与H2反响使产率降低③M点:c(OH)低,Na 2FeO4稳定性差,且反响慢或N点;c(OH)过高,铁电极上有Fe(0H)3或(Fe203)生成,使Na2FeO4产率降低考向三金属的腐蚀与防护8.(2021 •上海卷)研窕电化学腐蚀及防护的装置如下图.以下有关说法错误的选项是0A. d为石墨,铁片腐蚀加快B. d为石墨,石墨上电极反响为:.2 + 2H 2O + 4e=二二40HC. d为锌块,铁片不易被腐蚀一一+ -+ -+ --2一一2-D. d为锌块,铁片上电极反响为:2H + 2e===H2 f16/17[解析]A项,当d为石墨时,铁片为负极,腐蚀加快,正确;B项,当d为石墨时,石墨为原电池的正极,其电极反响为02 + 2H2O+4e===4OH,正确;C项,当d为锌块时,铁片为原电池的正极而受到保护,称为牺牲阳极的阴极保护法,正确;D项,当d为锌块时,铁片为正极,电极反响为:02 + 2H2O+4e===4OH,错误.[答案]D9.〔2021 •福建卷〕铁及其化合物与生产、生活关系密切.右图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图.⑴该电化学腐蚀称为.⑵图中A、B、C、D四个区域,生成铁锈最多的是〔填字母〕. [解析]⑴海水接近于中性,那么铁闸发生的是吸氧腐蚀.〔2〕外表海水中.2浓度较大,腐蚀得较快,故B处产生的铁锈最多.[答案]⑴吸氧腐蚀〔2〕B题型特点:选择题填空题考向评析:常以新型电源为命题背景,考查原电池的构成及工作原理;以电解原理在工农业生产中的应用为背景,考查电解池的工作原理及电解规律;以贴近日常生活的实例为背景,考查两种电化学腐蚀的原理及区别以及常见防腐方法.17/17做题启示:二轮复习时应抓住燃料电池中介质对电极反响式的影响;新型高能充电电池四个电极式的关系等命题要点进行落实, 强化电极方程式书写练习. ----------+-。
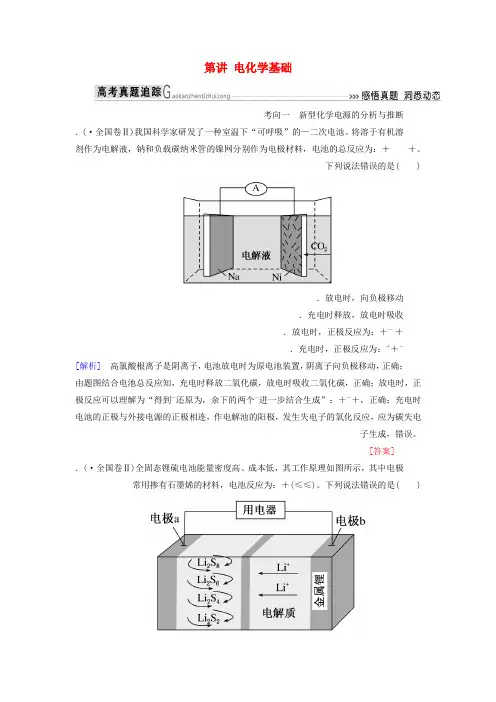
第讲电化学基础考向一新型化学电源的分析与推断.(·全国卷Ⅱ)我国科学家研发了一种室温下“可呼吸”的—二次电池。
将溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:++。
下列说法错误的是( ).放电时,向负极移动.充电时释放,放电时吸收.放电时,正极反应为:+-+.充电时,正极反应为:++-[解析] 高氯酸根离子是阴离子,电池放电时为原电池装置,阴离子向负极移动,正确;由题图结合电池总反应知,充电时释放二氧化碳,放电时吸收二氧化碳,正确;放电时,正极反应可以理解为“得到-还原为,余下的两个-进一步结合生成”:+-+,正确;充电时电池的正极与外接电源的正极相连,作电解池的阳极,发生失电子的氧化反应,应为碳失电子生成,错误。
[答案] .(·全国卷Ⅱ)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极常用掺有石墨烯的材料,电池反应为:+(≤≤)。
下列说法错误的是( ).电池工作时,正极可发生反应:+++-.电池工作时,外电路中流过电子,负极材料减重.石墨烯的作用主要是提高电极的导电性.电池充电时间越长,电池中的量越多[解析] 原电池工作时,正极发生一系列得电子的还原反应,即:→→→,其中可能有+++-,项正确;该电池工作时,每转移电子,负极有 (质量为 )被氧化为+,则负极质量减少,项正确;石墨烯能导电,用石墨烯作电极,可提高电极的导电性,项正确;充电过程中,的量逐渐减少,当电池充满电时,相当于达到平衡状态,电池中的量趋于不变,故不是电池充电时间越长,电池中的量越多,项错误。
[答案] .(·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是( ).正极反应中有生成.微生物促进了反应中电子的转移.质子通过交换膜从负极区移向正极区.电池总反应为++[解析] 由题意可知,微生物电池的原理是在微生物作用下与发生氧化还原反应,将化学能转化为电能,正确;氧气在正极反应,由于质子交换膜只允许+通过,则正极反应为:+-++,没有生成,项错误;负极发生反应:--+++,+在负极区生成,移向正极区,在正极被消耗,项正确;总反应为:++,项正确。

高三化学二轮复习《电化学》专题训练一、选择题(每小题3分,共54分)1、用惰性电极电解NaCl溶液,下列叙述正确的是( )A.电解时在阳极得到氯气,在阴极得到金属钠B.若在阳极附近的溶液中滴入KI溶液,溶液呈褐色C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色D.电解一段时间后,将全部电解质溶液转移到烧杯中,充分搅拌后溶液呈中性2、(2019年北京顺义)Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-===Li2S+Fe。
有关该电池的下列说法中,正确的是( )A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价B.该电池的总反应式为2Li+FeS===Li2S+FeC.负极的电极反应式为Al-3e-===Al3+D.充电时,阴极发生的电极反应式为Li2S+Fe-2e-===2Li++FeS3、(2019年北京海淀).MFC(Microbial Fuel Cell)是一种利用微生物将有机物中的化学能直接转化成电能的装置,其在废水处理和新能源开发领域具有广阔的应用前景。
如图为污水(主要溶质为葡萄糖)处理的实验装置,下列有关该装置的说法正确的是( )A.为加快处理速度,装置需在高温环境中工作B.负极的电极反应式为C6H12O6+6H2O-24e-===6CO2+24H+C.放电过程中,H+由正极向负极移动D.装置工作过程中,溶液的酸性逐渐增强4、(2019年北京西城)下图是一种新型的光化学电源,当光照射光电极时,通入O2和H2S即产生稳定的电流(H2AQ和AQ是两种有机物)。
下列说法不正确...的是A.负极的电极反应为2I-− 2e-== I2B.总反应为 H2S + O2 ==== H2O2 + SC.H+通过阳离子交换膜从正极区进入负极区D.电源工作时发生了光能、化学能、电能间的转化5、Cu2O是一种半导体材料,基于绿色化学理论设计的制取Cu2O的电解池示意图如图,电解总反应为2Cu+H2O=====电解Cu2O+H2↑。


1 / 17第6讲电化学基础考向一新型化学电源的分析与推断1.(2018·全国卷Ⅱ)我国科学家研发了一种室温下“可呼吸”的Na—CO 2二次电池。
将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na2Na 2CO3+C。
下列说法错误的是() A.放电时,ClO 4向负极移动B.充电时释放CO 2,放电时吸收CO 2C.放电时,正极反应为:3CO 2+4e===2CO 3+CD.充电时,正极反应为:Na+e===Na[解析]高氯酸根离子是阴离子,电池放电时为原电池装置,阴离子向负极移动,A正确;由题图结合电池总反应知,充电时释放二氧化碳,放电时吸收二氧化碳,B正确;放电时,正极反应可以理解为“CO2 / 172得到4e还原为C,余下的两个O进一步结合CO 2生成CO 3”:3CO 2+4e===2CO3+C,C正确;充电时电池的正极与外接电源的正极相连,作电解池的阳极,发生失电子的氧化反应,应为碳失电子生成CO2,D错误。
[答案]D2.(2017·全国卷Ⅱ)全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS 8===8Li 2Sx(2≤x≤8)。
下列说法错误的是() A.电池工作时,正极可发生反应:2Li 2S6+2Li+2e===3Li 2S 4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g C.石墨烯的作用主要是提高电极a的导电性D.电池充电时间越长,电池中Li3 / 172S 2的量越多[解析]原电池工作时,正极发生一系列得电子的还原反应,即:Li 2S 8→Li2S 6→Li2S 4→Li2S2,其中可能有2Li 2S6+2Li+2e===3Li 2S4,A项正确;该电池工作时,每转移0.02 mol电子,负极有0.02 mol Li(质量为0.14 g)被氧化为Li,则负极质量减少0.14g,B项正确;石墨烯能导电,用石墨烯作电极,可提高电极a的导电性,C项正确;充电过程中,Li2S2的量逐渐减少,当电池充满电时,相当于达到平衡状态,电池中Li 2S2的量趋于不变,故不是电池充电时间越长,电池中Li 2S4 / 172的量越多,D项错误。
[答案]D3.(2015·全国卷Ⅰ)微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。
下列有关微生物电池的说法错误的是()++-+--2--2-2-+--2--A.正极反应中有CO 2生成B.微生物促进了反应中电子的转移C.质子通过交换膜从负极区移向正极区D.电池总反应为C 6H 12O 6+6O 2===6CO 2+6H 2O[解析]由题意可知,微生物电池的原理是在微生物作用下O 2与C5 / 176H 12O6发生氧化还原反应,将化学能转化为电能,B正确;氧气在正极反应,由于质子交换膜只允许H通过,则正极反应为:O2+4e+4H===2H 2O,没有CO2生成,A项错误;负极发生反应:C 6H 12O6-24e--+++6H 2O===6CO2+24H,H在负极区生成,移向正极区,在正极被消耗,C项正确;总反应++为:C 6H 12O 6+6O 2===6CO 2+6H2O,D项正确。
[答案]A4.(1)(2018·天津卷)CO6 / 172是一种廉价的碳资源,其综合利用具有重要意义。
回答下列问题:O2辅助的Al-CO2电池工作原理如图所示。
该电池电容量大,能有效利用CO 2,电池反应产物Al 2(C 2O 4)3是重要的化工原料。
电池的负极反应式:_________________________。
电池的正极反应式:6O 2+6e===6O 2;6CO 2+6O 2===3C 2O 4+6O 2反应过程中O2的作用是_________________________。
该电池的总反应式:________________________。
7 / 17(2)(2017·北京卷)实验证明Ag+Fe===Ag+Fe能发生,装置如下图。
其中甲溶液是__________,操作及现象是_____________。
(3)(2016·江苏卷)铁炭混合物在水溶液中可形成许多微电池。
将含有Cr 2O7的酸性废水通过铁炭混合物,在微电池正极上Cr 2O 7转化为Cr_________________________________。
(4)(2016·天津卷)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。
回答下列问题:与汽油相比,氢气作为燃料的优点是__________________________________(至少答出两点)。
但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:_______________________________。
(5)(2015·四川卷)FeSO 4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。
该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2===Fe+2Li2S,正极反应式是_____________________。
2-3+2-+2+3+---2-,其电极反应式为[解析](1)O 2辅助的Al-CO8 / 172电池中,Al是活泼金属,作负极,发生氧化反应,电极反应式为Al-3e===Al。
由电池的正极反应式可知,O2先生成O 2,O 2与CO 2反应生成C 2O4-3+--2-和O 2,据此推测,该过程中O2的作用是催化剂。
根据正、负极反应式及得失电子守恒得电池的总反应式为2Al+6CO2===Al 2(C 2O 4) 3。
[答案](1)Al-3e===Al(或2Al-6e===2Al)催化剂2Al+6CO 2===Al 2(C 2O 4) 3(2)FeSO9 / 174溶液取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,后者红色更深。
(3)Cr 2O7+14H+6e===2Cr+7H 2O(4)污染小,可再生,来源广,资源丰富,燃烧热值高(任写其中2个)H 2+2OH-2e--2-+-3+-3+-3+===2H 2O (5)FeS2+4Li+4e===Fe+2Li 2S(或FeS 2+4e===Fe+2S)考向二电解原理在工农业生产中的应用5.(2017·全国卷Ⅱ)用电解氧化法可以在铝制品表面形成致密、耐腐蚀的氧化膜,电+--2-解质溶液一般为H 2SO 4—H 2C10 / 172O4混合溶液。
下列叙述错误的是() A.待加工铝质工件为阳极B.可选用不锈钢网作为阴极C.阴极的电极反应式为:Al+3e===Al D.硫酸根离子在电解过程中向阳极移动[解析]利用电解氧化法在铝制品表面形成致密的Al 2O3薄膜,即待加工铝质工件作阳极,A项正确;阴极与电源负极相连,对阴极电极材料没有特殊要求,可选用不锈钢网等,B项正确;电解质溶液呈酸性,阴极上应是H放电,C项错误;在电解过程中,电解池中的阴离子向阳极移动,D项正确。
[答案]C6.(2018·全国卷Ⅰ)焦亚硫酸钠(Na 2S 2O5)在医药、橡胶、印染、食品等方面应用广泛。
回答下列问题:制备Na 2S 2O5也可采用三室膜电解技术,装置如图所示,其中SO11 / 172碱吸收液中含有NaHSO 3和Na 2SO3。
阳极的电极反应式为+3+-_____________________________________________________。
电解后,________室的NaHSO3浓度增加。
将该室溶液进行结晶脱水,可得到Na 2S 2O 5。
[解析]装置图中左侧与电源正极相连,为三室膜电解槽的阳极,由于阳极室的溶液为稀硫酸,故阳极发生的反应为2H2O-4e===4H+O2↑,生成的H穿过阳离子交换膜进入a室与SO 2碱吸收液中的SO 3反应生成HSO 3,则a室中NaHSO 3浓度增加。
[答案]2H 2O-4e===4H+O12 / 172↑a-+2---++7.(1)(2016·浙江卷)研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在________极,该电极反应式是______________________________________________。
(2)(2016·天津卷)化工生产的副产物氢也是氢气的来源。
电解法制取有广泛用途的通电Na 2FeO4,同时获得氢气:Fe+2H 2O+2OH=====FeO 4+3H2↑,工作原理如图1所示。
装置通电后,铁电极附近生成紫红色FeO 4,镍电极有气泡产生。
若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
已知:Na2FeO4只在强碱性条件下稳定,易被H 2还原。
13 / 17①电解一段时间后,c(OH)降低的区域在________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因为________________________________________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,任选M、N两点中的一点,分析c(Na 2FeO4)低于最高值的原因:_______________。
[解析](1)根据题意,二氧化碳在酸性水溶液中通过电解生成甲醇,CO 2中C呈+4价,CH3OH中C呈-2价,结合反应前后碳元素化合价变化,可知碳元素的化合价降低,得到电子,故该电极为阴极,电极反应式为CO2+6H+6e===CH 3OH+H2O。
(2)①根据题意,镍电极有气泡产生是H得电子生成H2,发生还原反应,则铁电极上OH发生氧化反应,溶液中的OH 减少,因此电解一段时间后,c(OH)降低的区域在阳极室。
②H2具有还原性,根据题意:Na 2FeO4只在强碱性条件下稳定,易被H2还原。
因此,电解过程中,须将阴极产生的气体及时排出,防止Na14 / 172FeO 4与H2反应使产率降低。
③根据题意Na 2FeO4只在强碱性条件下稳定,在M点:c(OH)低,Na 2FeO4稳定性差,且反应慢;在N点:c(OH)过高,铁电极上有Fe(OH) 3生成,使Na 2FeO 4产率降低。
[答案](1)阴CO 2+6H+6e===CH 3OH+H 2O(2)①阳极室②防止Na 2FeO 4与H2反应使产率降低③M点:c(OH)低,Na 2FeO4稳定性差,且反应慢或N点;c(OH)过高,铁电极上有Fe(OH) 3或(Fe15 / 172O3)生成,使Na 2FeO 4产率降低考向三金属的腐蚀与防护8.(2015·上海卷)研究电化学腐蚀及防护的装置如图所示。