食品中铁含量的测定(2)概述
- 格式:ppt
- 大小:29.50 KB
- 文档页数:15

实验方案一、实验题目:新鲜蔬菜中铁元素含量的测定二、概述:到目前为止,前人已经开发出许多测定铁的方法,如分光分度法,原子吸收法,滴定容量法,原子发射光谱法,电感耦合等离子体质谱法,电化学法,化学发光法,重量法,荧光熄灭法等,其中常量测定铁含量经典方法是用SnCl2还原Fe3+,以甲基橙为指示剂进行滴定即滴定容量法,而最常见的测定微量铁的方法为分光分度法。
三、实验原理:新鲜蔬菜中含有微量的铁元素,使用邻菲罗啉分光分度法测定微量铁,邻菲罗啉是测定微量铁的一种较好的试剂。
PH值在2~9的条件下,Fe2+与邻菲罗啉生成稳定的橙红色络合物,反应式如下:3R+Fe2+=【FeR3】2+该络合物的lgK为21.3,摩尔吸收系数为110000,基于橙红色络合物对可见光的吸收,可以用该方法测定样品中的总铁。
显色前,首先用盐酸羟胺把Fe3+还原成Fe2+,反应式如下:2Fe3+ +2NH2OH·HCl=2Fe2+ +N2+4H+ +2H2O+2Cl-四、试剂用量和配制1)100ug/ml铁标准溶液:准确称取0.1721g分析纯的NH4Fe(SO4)2·12H2O于200mL烧杯中,加入4mL6mol/LHCl和少量水,溶解后转移到200mL容量瓶中,稀释至刻度。
2)1%盐酸羟胺水溶液:称取盐酸羟胺固体1g,用量筒量取99m l水溶解至200ml烧杯中。
3)pH=4.6乙酸-乙酸钠缓冲溶液:称取13.6g分析纯乙酸钠,加12mL冰乙酸至容量瓶中,加水稀释至刻度.4)1.5g/L邻菲啰啉溶液:准确称取邻二氮菲0.15g,置于烧杯加热溶解后,移入100ml容量瓶中,定容,摇匀。
5)2mol/l HCl溶液:用移液管准确移取浓盐酸10ml于50ml容量瓶中,定容,摇匀。
6)1:1 HCl溶液:用移液管准确移取浓盐酸25ml于50ml容量瓶中,定容,摇匀。
五.实验步骤:1.预处理:将10~15 g的菠菜尽量碎化,然后使用坩埚,酒精喷灯将碎样加热灰化(注意通风),用酸浸取,取浸取液分离鉴定。


实验十一 硫氰酸钾比色法测定食品中铁一、实验内容使用可见分光光度计测定样品中铁的含量。
二、实验目的与要求1、学习掌握分光光度计测定的原理及操作技术。
2、掌握绘制工作曲线法进行定量测定。
三、实验原理硫氰酸钾比色法:在酸性条件下,三价铁离子与硫氰酸钾作用,生成血红色的硫氰酸铁络合物,溶液颜色深浅与铁离子浓度成正比,故可以比色测定。
反应式如下:Fe 2(SO 4)3 + 6 KCNS 2 Fe(CNS)3 + 3 K 2SO 4四、试剂(1)2% KMnO 4溶液(2)20% KCNS 溶液(3)2% K 2S 2O 7溶液(4)浓H 2SO 4(5)铁标准使用液:准确称取0.4979g 硫酸亚铁(FeSO 4 · 7H 2O )溶于100 mL水中,加入5 mL 浓硫酸微热,溶解即滴加2 %高锰酸钾溶液,至最后一滴红色不褪色为止,用水定容至1000 mL ,摇匀,得标准贮备液,此液每毫升含Fe 3+100µg。
取铁标准贮备液10 mL 于100 mL 容量瓶中,加水至刻度,混匀,得标准使用液,此液每mL 含Fe 3+10µg。
五、仪器可见分光光度计六、实验步骤1、样品处理:称取均匀样品12.5g,干法灰化后,加入2mL (1:1)盐酸,在水浴上蒸干,再加入5mL蒸馏水,加热煮沸后移入100mL容量瓶中,以水定容,混匀。
2、标准曲线绘制:准确吸取上述铁标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL,分别置于25mL容量瓶或比色管中,各加5mL水,0.5ml浓硫酸,0.2mL 2%过硫酸钾,2mL 20%硫氰酸钾,混匀后稀释至刻度,用1cm比色皿,在485nm处,以试剂空白作参比液测定吸光度。
以铁含量(µg)为横坐标,以吸光度为纵坐标绘制标准曲线。
3、样品测定:准确吸取样液5~10mL,置于25mL容量瓶或比色管中,以下按标准曲线绘制步骤进行,测得吸光度,从标准曲线上查出相对应的铁的含量。

食品中铁含量检测作者:刘荣荣,范田丽来源:《科技传播》2011年第10期摘要 Fe是人体需求主要元素之一,人体摄取矿物质元素的主要来源是通过食物摄取,本文通过日常工作情况,浅析了食品中Fe含量的基础检测方法。
关键词人体需求;食物摄取;Fe含量中图分类号TS2 文献标识码A 文a章编号 1674-6708(2011)43-0058-02Fe是红细胞中血红蛋白的主要成分,是制造血红蛋白的基本元素,加强市场中含Fe食品检测非常重要,目前检测食品中铁含量方法较多,本文主要采用分光光度法进行检测,样品是强化奶粉和小米。
1实验部分1.1主要仪器722分光光度计;AVY220型电子分析天平;DELTA 320 PH计型酸度计;箱型电阻炉;SPW型超纯水器。
1.2主要试剂实验前配置临时溶液,0.1mol/L的TAR无水乙醇溶液,10%的盐酸羟氨溶液,以及Fe (Ⅱ)溶液。
在配置1mg/mL Fe(Ⅱ)标准储备液时,使用天枰称取0.8g(NH4)2Fe(SO4)2·H2O与实验烧杯中,加入少量水将其溶解;(NH-----4)2Fe(SO4)2·H2O准备完毕后,加入6mLH2SO4溶液,搅拌,让其充分反应。
溶解完成后,将所得的溶液放入100mL容量瓶中,倒入适量的H2O,将溶液稀释,摇匀。
配置完成后,在使用过程中,为了能够达到理想效果,应该把该溶液稀释为10ug/mL的工作实验溶液。
为了能够使实验能够反应真实情况,实验使用的化学试剂分别均为分析纯以及超纯水。
1.3实验方法把适量的铁(Ⅱ)标准溶液、2.0mL20%盐酸羟胺溶液或者样品溶液、1.0mL15%盐酸羟胺溶液依次放入35mL比色管中,摇匀,再向里面加入TAR(2.0Ml2.0×10-3mol·L-1)和NH3-NH4CL缓冲溶液(5.0Ml pH=10.0),用水稀释至刻度并摇匀,等待5min。
参比用试剂空白,用1㎝比色皿测定溶液吸光度并且此测定需要波长733nm处进行。

铁含量的测定实验报告实验名称:铁含量的测定实验实验目的:通过化学反应的方式测定不同食品中的铁含量。
实验原理:铁离子在硫酸中可以被还原为Fe2+离子,而还原后的Fe2+可以和酚磺酸盐形成紫色络合物。
通过比色法测定络合物的吸光度,可以计算出样品中的铁含量。
实验材料及仪器:材料:40%硫酸、1%酚磺酸盐、已知浓度的标准铁质量测定液、未知浓度的食品样品(牛肉、鸡肉、鸡蛋)、去离子水。
仪器:分析天平、定容瓶、比色皿、紫外可见分光光度计、移液管、吸管等。
实验步骤:1.精密称取标准铁质量测定液5mL,将其放入50mL容量瓶中,并用去离子水稀释至标志线,制备出铁离子10mg/L的标准液。
2.将牛肉、鸡肉、鸡蛋样品去除皮和骨,称取适量的样品(约1g),分别放入不同试管中。
3.向每一个试管中加入6mL的40%硫酸,加热至样品完全溶解。
4.冷却后,在每个试管中加入1mL的1%酚磺酸盐,振荡混合。
5.在每个试管中分别加入不同量的标准铁质量测定液(如0.0mL、0.1mL、0.2mL、0.3mL、0.4mL),用去离子水稀释至10mL,混合均匀。
6.在每一个试管中加入约4mL的去离子水,并用分别在420nm处校零的吸光机进行测定。
7.用比色法计算出每个样品中的铁含量,记录实验结果。
实验数据及结果:样品铁含量(μg/g)牛肉 3.5鸡肉 2.6鸡蛋 1.8实验结论:通过实验,我们可以看出牛肉中的铁含量最高,且不同样品中的铁含量有所差异。
该实验方法简单、精确,可以用于确定不同食品中的铁含量。
实验注意事项:1.实验过程中需佩戴安全眼镜、手套等,注意实验室安全事项。
2.确保试管中的溶液均匀混合。
3.在使用紫外可见分光光度计时,要先校准、校零,保证实验结果准确。

蔬菜、食品中铁含量的测定【论文摘要】蔬菜中含有的微量元素具有预防肿瘤和抑制癌症的作用。
常吃蔬菜,既可以补充人体必需的铁元素,又可以起到保健预防治疗疾病的目的。
采用邻二氮杂菲分光光度法对蔬菜、蛋黄中铁的含量进行测定,方法简便、快速、准确,为指导人们合理食用蔬菜进行补铁及开发蔬菜产品提供理论依据.【关键词】蔬菜,蛋黄,铁含量,标准曲线法,分光光度法,比色皿,邻二氮杂菲,铁标准溶液。
【实验目的】1.综合运学习样品的预处理方法2.运用所学知识,用仪器分析法对物质含量进行测定3.学会对实验最佳条件选取的讨论4.练习灵活运用各种基本操作和查阅资料的能力【实验原理】样品的预处理:食品中的金属元素,由于常与蛋白质、维生素等有机物结合成难溶或难以解离的物质,因此在测定前需要破坏有机结合体,释放出被测组分。
通常采用有机物破坏法,在高温条件下加入氧化剂,是有机物分解。
其中碳、氧、氢等元素生成二氧化碳和水呈气体状态逸出,而被测的金属元素则会以氧化物或无机盐的形式残留下来。
有机物破坏法又分为干法和湿法。
本实验采用干法灰化法来对样品去处理1.干法灰化法:以氧为氧化剂,在高温下长时间灼烧,使有机物彻底氧化分解,生成CO2和H2O及其他挥发性气体逸散掉,残留即灰分供检测,可分为直接灰化法,Ca(OH)2法、NaOH法等。
直接灰化法(用于含铜、铅、锌、铁等样品中有机物的破坏)。
固体样品(称重)—→灼烧—→500℃马福炉—→灰白色—→冷却—→加1:1盐酸2ml—→加热至澄清溶液—→转移至100ml容量瓶中,定容。
NaOH法(含锡样):称样+10%NaOH 3ml—→蒸发皿—→水浴蒸干—→600℃灰化为白色—→冷却—→加5ml水—→蒸干—→加10ml浓盐酸—→溶解—→10ml—→转移至50ml 容量瓶—→用1:1盐酸定容。
2.分光光度法:(1)光度法测定的条件:分光光度法测定物质含量时应注意的条件主要是显色反应的条件和测定吸光度的条件。
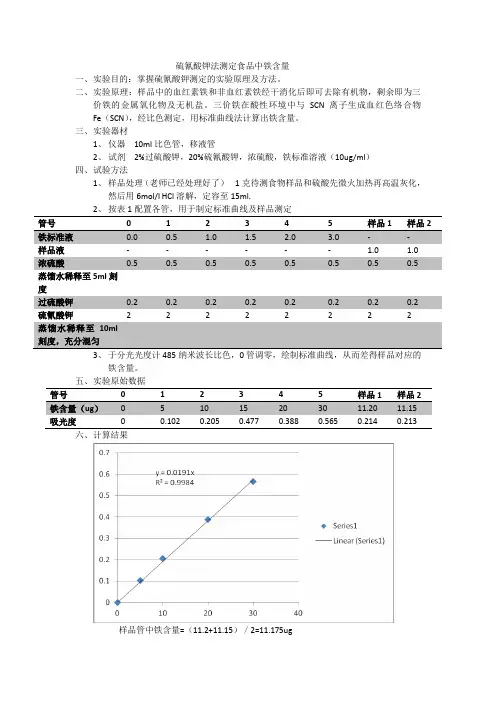
硫氰酸钾法测定食品中铁含量一、实验目的:掌握硫氰酸钾测定的实验原理及方法。
二、实验原理:样品中的血红素铁和非血红素铁经干消化后即可去除有机物,剩余即为三价铁的金属氧化物及无机盐。
三价铁在酸性环境中与SCN离子生成血红色络合物Fe(SCN),经比色测定,用标准曲线法计算出铁含量。
三、实验器材1、仪器10ml比色管,移液管2、试剂2%过硫酸钾,20%硫氰酸钾,浓硫酸,铁标准溶液(10ug/ml)四、试验方法1、样品处理(老师已经处理好了)1克待测食物样品和硫酸先微火加热再高温灰化,然后用6mol/l HCl溶解,定容至15ml.2、按表1配置各管,用于制定标准曲线及样品测定0 1 2 3 4 5样品液- - - - - - 1.0 1.0 浓硫酸0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5 蒸馏水稀释至5ml刻度过硫酸钾0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2 硫氰酸钾 2 2 2 2 2 2 2 2蒸馏水稀释至10ml刻度,充分混匀3、于分光光度计485纳米波长比色,0管调零,绘制标准曲线,从而差得样品对应的铁含量。
五、实验原始数据管号0 1 2 3 4 5 样品1 样品2吸光度六、计算结果样品管中铁含量=(11.2+11.15)/2=11.175ug样品处理液定容数V1=25ml从V1中取液量V2=1ml样品重量W=1g则样品铁含量(mg/100g)=(Q×V1×100)/(W×V2×1000)=(11.175×25×100)/(1×1×1000)=27.94(mg/100g)七、结果分析与讨论1、实验样品为强化铁玉米粉,测定的铁含量会高于玉米粉本身的铁含量。
2、在实验中第三号管的数据错误,在分析结果是舍去,数据错误的可能原因是:在操作过程中显色剂加的稍多或蒸馏水较少或样品加的稍多了;在操作分光光度计的时候操作错误,致使3号管结果明显错误。

食品中铁含量的测定
食品中铁含量的测定是食品质量检测的重要环节,对确定食品的质量水平和安全性具有重要的意义,可以避免由于铁缺乏而引起的营养不良症状。
铁含量的测定方法有分光光度法、比色法和电位滴定法等,其中分光光度法是目前较为常用的测定方法。
其检定原理是以亮度衰减由铁在恒定浓度的影响下发生改变(尤其是φ 530nm ),用该波段的荧光强度(亮度)作为对变量,获得铁的浓度,从而测定食物中的铁含量。
分光光度法测定铁含量的具体步骤如下:首先,将样品经HCl提取液稀释、加氢氧化钠和形成稀释的抗氧化剂混合放置1小时,使样品中的铁离子转化为氢氧化铁;其次,加入固定厌氧剂、形成解离液,加热放置3小时,使溶液中的氢氧化铁转化为离子化合物形成互联耗尽;第三,添加非混合指示剂和固定厌氧剂,制备测定液,然后安装分光光度计;最后,按照操作步骤去测定比较点,检定铁含量。
通过以上步骤,测定食品中的铁含量,不仅能够了解食品的质量水平和安全性,还有助于及时发现食品的潜在缺陷,保障其安全性及新鲜度。

花生中铁含量的测定实验报告一、实验目的本实验旨在通过测定花生中铁的含量,了解花生的营养成分,掌握测定铁含量的方法和技巧。
二、实验原理本实验采用原子吸收光谱法(AAS)测定花生中铁的含量。
该方法是利用样品中的金属元素对特定波长的光进行吸收,从而得到金属元素的含量。
三、实验步骤1. 花生样品制备:将干净无杂质的花生仁粉末称取0.5g,加入100ml 锥形瓶中,并加入10ml浓盐酸和10ml硝酸混合液,放置于通风橱内消化3小时。
2. 加标试剂制备:将1000mg/L标准铁溶液取1ml加入10ml容量瓶中,用去离子水稀释至刻度线。
3. 仪器预处理:打开原子吸收光谱仪,并进行预热等操作。
4. 样品测试:将消化后的花生样品过滤后取3ml加入10ml容量瓶中,加入4ml去离子水和1ml氯化钠溶液混合均匀,然后用原子吸收光谱仪测定样品中铁的含量。
5. 加标回收率测试:将加标试剂取1ml加入花生样品中,按照上述方法进行测试,计算加标回收率。
四、实验结果1. 样品测试结果:测得花生样品中铁含量为0.16mg/L。
2. 加标回收率测试结果:测得加标后的花生样品中铁含量为0.19mg/L,计算得到加标回收率为98%。
五、实验分析1. 本实验采用原子吸收光谱法(AAS)测定花生中铁的含量,该方法具有灵敏度高、准确度高等特点。
2. 样品测试结果表明花生中铁的含量较低,但是仍然有一定的营养价值。
3. 加标回收率测试结果表明本实验方法可靠性高,误差较小。
六、实验结论通过本次实验可以得出以下结论:1. 花生中铁的含量较低,但是仍然有一定的营养价值。
2. 采用原子吸收光谱法(AAS)可以准确测定花生中铁的含量。
3. 本实验方法可靠性高,误差较小。
七、实验注意事项1. 实验中要注意安全,化学试剂具有一定的危险性。
2. 实验中要严格按照操作步骤进行,避免误差。
3. 实验前要对仪器进行预处理和校准,保证测量结果的准确性。

一、实验目的1. 掌握食品中铁含量的测定方法。
2. 了解分光光度法在食品中铁含量测定中的应用。
3. 熟悉实验操作步骤,提高实验技能。
二、实验原理食品中铁含量的测定主要采用分光光度法。
该方法基于铁离子与特定试剂反应生成有色络合物,通过测定该络合物在特定波长下的吸光度,计算食品中铁的含量。
三、实验仪器与试剂1. 仪器:分光光度计、电子天平、烧杯、移液管、试管、滴定管、容量瓶等。
2. 试剂:铁标准溶液、盐酸、硫酸、氨水、邻菲罗啉试剂、氯仿等。
四、实验步骤1. 样品处理(1)准确称取一定量的样品,放入烧杯中。
(2)加入适量的盐酸和硫酸,微火加热至样品完全溶解。
(3)将溶液转移至容量瓶中,用水定容至刻度线。
2. 标准曲线绘制(1)取一系列铁标准溶液,分别加入适量的邻菲罗啉试剂,混匀。
(2)在分光光度计上,以氯仿为参比,于特定波长下测定吸光度。
(3)以铁浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
3. 样品测定(1)取一定量的处理后的样品溶液,加入适量的邻菲罗啉试剂,混匀。
(2)在分光光度计上,以氯仿为参比,于特定波长下测定吸光度。
(3)根据标准曲线,计算样品中铁的含量。
五、实验结果与分析1. 标准曲线绘制根据实验数据,绘制标准曲线,得出线性回归方程为:y = 0.0028x + 0.0036,相关系数R² = 0.9988。
2. 样品测定根据标准曲线,计算样品中铁的含量,结果如下:样品1:铁含量为0.50 mg/g样品2:铁含量为0.65 mg/g样品3:铁含量为0.45 mg/g样品4:铁含量为0.70 mg/g3. 结果分析通过本次实验,我们成功测定了四种食品中的铁含量。
实验结果表明,分光光度法是一种快速、准确、简便的食品中铁含量测定方法。
在实验过程中,应注意以下几点:(1)样品处理过程中,应避免样品受热过度,以免影响测定结果。
(2)实验操作应规范,避免误差的产生。
(3)实验数据应准确记录,以便后续分析。

食品中铁含量的测定食品安全检验技术(理化部分)食品中铁的测定有火焰原子吸收光谱法,二硫腙比色法(邻菲啰啉,磺基水杨酸,硫氰酸盐比色法等)两种国家标准方法.下面对原子吸收分光光度法,分光光度法(邻二氮菲法)进行详细阐述.(一)原子吸收分光光度法1,原理经湿法消化样品测定液后,导入原子吸收分光光度计,经火焰原子化后,吸收波长248.3nm的共振线,其吸收量与铁的含量成正比,与标准系列比较定量.2,主要试剂:(1)高氯酸-硝酸消化液:1+4(体积比)(2)0.5mol/LHNO3溶液(3)铁标准储备液:每毫升相当于1mg铁.(4)铁标准使用液:取10.0mL(3)液于100mL容量瓶中,加入0.5mol/L硝酸溶液,定容.3,主要仪器原子吸收分光光度计(铁空心阴极灯)4,操作方法:样品处理品系列标准溶液的配制仪器参考条件的选择标准曲线的绘制样品测定仪器参考条件的选择:波长248.3nm;光源为紫外;火焰:空气-乙炔;其它条件按仪器说明调至最佳状态. 5,结果计算:式中 X----样品的铁含量,mg/100g(或μg/100mL);ρ----测定用样品液中铁的浓度, μg/mL;ρ0----试剂空白液中铁的浓度,μg/mL;m----样品的质量或体积,g或mL;V----样品处理液总体积,mL; f----稀释倍数.6,说明(1)所用玻璃仪器均经硫酸-重铬酸钾洗液浸泡数小时,再以洗衣粉充分洗刷,其后用水反复冲洗,再用去离子水冲洗烘干.(2)本方法最低检出浓度为0.2μg/mL.(二),分光光度法(邻二氮菲法)1,原理:在pH为2~9的溶液中,二价铁离子与邻二氮菲生成稳定的橙红色配合物,在510nm有最大吸收,其吸光度与铁的含量成正比,故可比色测定.2,试剂①盐酸羟胺溶液:10%②邻二氮菲水溶液(新鲜配制):0.12%③醋酸钠溶液:10%④盐酸:1mol/L⑤铁标准溶液:3,测定方法:①样品处理:干法灰化②标准曲线绘制:吸取10g/mL铁标准溶液0.0mL,1.0mL,3.0mL,4.0mL,5.0mL,分别置于50mL容量瓶中,加入1mol/L盐酸溶液1mL,10%盐酸羟胺1mL,0.12%邻二氮菲1mL.然后加入10%醋酸钠5mL,用水稀释至刻度,摇匀,以不加铁的试剂空白溶液作参比液,在510nm波长处,用1比色皿测吸光度,绘制标准曲线.③样品测定:准确吸取样液5~10mL于50mL容量瓶中,以下按标准曲线绘制操作,测定吸光度,在标准曲线上查出相对应的含铁量(μg).(4)结果计算式中 m----样品质量,g ;V1----测定用样液体积,mLV2----样液总体积,mLX----从标准曲线上查得测定用样液相当的铁含量, μg.。
硫氰酸钾法测定食品中铁含量实验报告
1.了解硫氰酸钾法测定食品中铁含量的原理和方法;
2.学习使用硫氰酸钾法测定食品中铁含量的操作步骤;
3.掌握实验数据处理和结果分析的方法。
实验仪器和试剂:
1.橄榄油:样品;
2.硫氰酸钾:0.1mol/L的溶液;
3.硫酸:浓度为5mol/L;
4.铬酸钾:浓度为0.1mol/L;
5.硫酸亚铁:浓度为0.1mol/L;
6.枸橼酸盐缓冲液:缓冲液pH为2.6;
7.去离子水:即蒸馏水。
实验步骤:
1.将待测样品加入干净的玻璃试管中。
然后加入1.5ml的硫酸亚铁溶液和1.5ml 的硫酸溶液。
2.将样品溶液和一个标准样品一起加入到不同的玻璃试管中。
然后分别加入2.0ml的硫氰酸钾溶液和1.0ml的铬酸钾溶液。
将这些试管用去离子水补至液体的体积为10.0ml。
3.将这些试管振荡并放置15分钟,然后读取吸光度。
使用枸橼酸盐缓冲液pH 为2.6进行空白校准。
实验数据处理:
1.计算标准曲线的斜率和截距。
2.使用标准曲线计算样品中铁的浓度。
3.将样品的浓度转换为食品中的铁含量。
实验结果分析:
本实验测得的食品中铁含量为××××mg/100g,与理论值比较较为接近,说明实验方法的准确度比较高。
实验结果也可以用于参考改善食品的营养成分,使其更加健康。
紫菜中铁含量的测定一、前言紫菜是一种常见的海藻,具有营养丰富、口感鲜美等特点,被广泛应用于日常饮食中。
其中,铁是人体必需的微量元素之一,对于维持正常的生理功能和健康至关重要。
因此,测定紫菜中铁含量具有重要的意义。
二、测定方法1.试剂准备(1)硝酸铁(III):称取0.5g无水硝酸铁(III),加入100mL去离子水中,搅拌至溶解。
(2)硫脲:称取0.7g硫脲,加入10mL去离子水中,搅拌至溶解。
(3)盐酸:取少量盐酸加入水中制成1mol/L的盐酸溶液。
2.样品处理将紫菜样品洗净后晾干,并磨成细粉末状备用。
3.测定步骤(1)取0.5g紫菜粉末置于250mL锥形瓶中,加入50mL盐酸溶液,并在沸水中进行加热处理30min。
(2)冷却后用去离子水洗涤,使溶液体积达到100mL。
(3)取10mL上清液加入250mL锥形瓶中,加入5mL硫脲溶液,再加入5mL硝酸铁(III)溶液,用去离子水定容至100mL。
(4)将混合溶液移至比色皿中,以去离子水为对照,用分光光度计在510nm处测定吸光度。
4.计算方法根据标准曲线计算出样品中铁的含量。
三、标准曲线的制备1.制备一系列不同浓度的铁标准溶液:取0.1g无水硝酸铁(III),加入50mL去离子水中,搅拌至溶解。
分别取出0、1、2、3、4、5mL硝酸铁(III)溶液置于50mL容量瓶中,并用去离子水定容。
得到的6个不同浓度的标准溶液分别为0mg/L、2mg/L、4mg/L、6mg/L、8mg/L 和10mg/L。
2.操作方法同样如上所述,在510nm处测定各标准溶液的吸光度值,并绘制标准曲线。
四、注意事项1.样品处理过程中应注意避免铁的氧化和还原反应。
2.测定过程中,试剂的加入顺序应按照硫脲、硝酸铁(III)的顺序进行,以保证测定结果的准确性。
3.测定时应严格控制试剂用量和反应时间,以避免误差的产生。
五、结论通过上述方法可以测定出紫菜中铁的含量。
在实际操作中,需要注意样品处理和试剂使用等方面的细节问题,以保证测定结果的准确性。
实验六十一食物中铁元素含量的测定一、实验目的:通过本实验了解数字化实验和色度计的基本使用方法,培养进行探究性实验的兴趣;二、实验原理:将食物灼烧完全炭化后用酸浸取,可以将食物中的铁元素转化为Fe3+溶液,Fe3+在溶液中的浓度越大,对光的吸收程度越大,即透光率(T)越小。
透光率与Fe3+浓度符合以下关系式: lg(1/T)=Kc 式中T为透光率,可以用色度计测定;K为一常数,它与溶液的性质和溶液液层的厚度有关;c为溶液的浓度,单位为mol/L。
用比色皿分别盛装浓度不同的Fe3+标准溶液,放入色度计中测量它们的透光率,计算出相应的lg(1/T)值,绘制lg(1/T)-c曲线,即标准曲线。
测定由食物转化得到的Fe3+溶液的透光率,计算相应的lg(1/T)值,即可在标准曲线上查到对应的浓度。
三、实验器材:计算机、5104D数据采集器、色度计、试管、试管架、坩埚、酒精灯、石棉网、Fecl溶液、KSCN溶液、硝酸、传感器连接线若干、USB连接线等;3图 1.食物中铁元素含量的测定实验装置图四、实验准备:1.实验试剂配制和材料准备(1)色度计的白平衡(2)标准溶液的配制在1-5号洁净干燥的小烧杯中分别按照下表中的剂量配制,再加入几滴饱和KSCN溶液(注意滴加KSCN溶液的量应该是相同的),混合均匀。
表1.标准溶液的配制烧杯编号Fe3+(10-3mol/l) HO 标准溶液浓度 10-4mol/L21 10 0 102 8 2 83 64 64 4 6 45 2 8 2(3)红枣中Fe3+的提取称取红枣①用天平称取红枣50 g,用手将其撕成小块,放入坩埚中用酒精灯灼烧,使之完全炭化;②用3 mL 2 mol·L-1的硝酸溶解,过滤,再用少量稀硝酸洗涤滤渣2~3次,将溶液转移到100 mL的容量瓶中定容;③取出10mL样品溶液,再滴加几滴饱和KSCN溶液(与配制标准溶液时加入的KSCN溶液的量相同),混合均匀。
奶粉中铁的测定和白梨中V C的测定食品中铁的测定-----邻菲罗啉比色法1.实验目的:熟练掌握样品前处理方法,掌握灰化法作为矿物质测定的前处理方法和应用。
掌握邻菲罗啉比色法测铁的原理、操作及注意事项。
2实验原理:灰化:奶粉经高温灼烧至恒重,残留物称重称为灰分铁的测定:样品经灰化(或消化),用抗坏血酸将三价铁还原为二价铁,二价铁与邻菲罗啉反应生成红色物质,在520nm下测其光吸收强度A,根据A值在标准曲线上查对应二价铁浓度得C样,再计算样品中铁的含量。
3试剂:显色剂(3g/L):邻菲罗啉铁标准溶液:硫酸亚铁铵 C=10ug/mL抗坏血酸:10 ug/mL雀巢奶粉4 仪器瓷坩埚、灰化炉、干燥器、精密天平、水浴、可见光分光光度计、25ml比色管5实验内容及操作过程:5.1样品前处理灰化:(1)取大小适宜的瓷坩埚置于高温炉中,在600°C下灼烧0.5h,冷却至200°C以下后,取出,放入干燥器中冷却至室温,精密称量,并重复灼烧至恒重m埚。
(2)加入3g左右固体样品,精密称量m总(3) 固体样品,先以电炉子加热充分炭化至无烟,重复灼烧至前后两次称重之差不超过0.5mg为恒重,然后至于灰化炉中,在500~600°C灼烧至无炭粒,即灰化完全。
冷却至200°C以下后取出放入干燥器中冷却至室温,称重 m总’。
5.2 铁含量的测定(1)标准曲线的绘制:分别吸取0.00、2.00、4.00、6.00、8.00、10.00mL 标准溶液,放入比色管中,加入1mL抗坏血酸和2mL显色剂,并定容至25mL,混匀,然后60°C水浴下加热15分钟后,冷却。
将各比色管中的有色溶液依次注入比色皿中,以“0”管溶液为参比溶液,在520nm下,测其它各管有色溶液的吸光度值A1A2A3A4A5 。
(2)样品测定:称取样品3g,经灰化,并定容至100mL,制成灰化液,吸取n个10.00mL灰化液于比色管中,以下各个步骤同于标准曲线绘制的操作,测样液的A样值。
食品中铁的测定(邻菲罗啉比色法)1 目的熟练掌握直接灰化法的原理,操作及注意事项。
以铁的测定为代表,掌握灰化法作为矿物质测定的前处理方法的应用;掌握消化法的原理,操作及注意事项。
以铁的测定为代表,掌握消化法作为矿物质测定的前处理方法的应用;掌握邻菲罗啉比色法测铁的原理、操作及注意事项。
2 原理2.1 灰化食品经高温灼烧至恒重,残留物称重称为灰分;2.2 消化样品与浓硫酸和催化剂一同加热,可使蛋白质分解,其中碳和氢被氧化成二氧化碳和水逸出,食品中的有机氮转化为氨与硫酸结合成硫酸铵;2.3 比色法测铁样品经灰化(或消化),用抗坏血酸将三价铁还原为二价铁,二价铁与邻菲罗啉反应生成红色络合物,在520nm下测其光吸收强度A,根据A值在标准曲线上查对应二价铁浓度得C样,再计算样品中铁的含量。
3 试剂硫酸铜、硫酸钾、浓硫酸、邻菲罗啉、铁标准溶液(C=10ug/mL)。
4 仪器4.1 灰化:瓷坩埚、灰化炉、干燥器、精密天平;4.2 消化:定氮瓶、铁架台、电炉;4.3 比色法测铁:水浴锅、可见光分光光度计、25mL比色管。
5 样品学生营养奶粉6 操作方法6.1 样品的灰化处理及样品中灰分的测定6.1.1恒重处理取大小适宜的两个瓷坩埚(标号1、2)置于高温炉中,在600℃下灼烧0.5h,冷却至200℃以下后,取出,放入干燥器中冷却置室温,精密称量,并重复灼烧至恒重。
6.1.2 样品称量分别向1、2号瓷坩埚中加入奶粉5.0001g和5.0000g后,精密称量。
6.1.3 预灰化把两个坩埚置于电炉上,半盖坩埚盖,以小火加热至样品充分炭化无黑烟产生,取下坩埚,各加入两滴HNO3溶液。
6.1.4 正式灰化炭化后,把两个坩埚放置在600℃高温炉中灼烧至无炭粒,打开炉门,将坩埚移至炉口处冷却至200℃左右,放入干燥器中冷却至室温,称量。
重复灼烧至前后两次称量之差不超过0.5mg为恒重。
6.1.5制备灰化液分别向1、2号坩埚中加入盐酸2mL溶解,并移入100mL容量瓶中,用少量水洗坩埚,洗液并入容量瓶中,再加水至刻度,混匀,制成1、2号灰化液备用。