蔬菜中铁含量测定
- 格式:docx
- 大小:96.16 KB
- 文档页数:7

实验方案一、实验题目:新鲜蔬菜中铁元素含量的测定二、概述:到目前为止,前人已经开发出许多测定铁的方法,如分光分度法,原子吸收法,滴定容量法,原子发射光谱法,电感耦合等离子体质谱法,电化学法,化学发光法,重量法,荧光熄灭法等,其中常量测定铁含量经典方法是用SnCl2还原Fe3+,以甲基橙为指示剂进行滴定即滴定容量法,而最常见的测定微量铁的方法为分光分度法。
三、实验原理:新鲜蔬菜中含有微量的铁元素,使用邻菲罗啉分光分度法测定微量铁,邻菲罗啉是测定微量铁的一种较好的试剂。
PH值在2~9的条件下,Fe2+与邻菲罗啉生成稳定的橙红色络合物,反应式如下:3R+Fe2+=【FeR3】2+该络合物的lgK为21.3,摩尔吸收系数为110000,基于橙红色络合物对可见光的吸收,可以用该方法测定样品中的总铁。
显色前,首先用盐酸羟胺把Fe3+还原成Fe2+,反应式如下:2Fe3+ +2NH2OH·HCl=2Fe2+ +N2+4H+ +2H2O+2Cl-四、试剂用量和配制1)100ug/ml铁标准溶液:准确称取0.1721g分析纯的NH4Fe(SO4)2·12H2O于200mL烧杯中,加入4mL6mol/LHCl和少量水,溶解后转移到200mL容量瓶中,稀释至刻度。
2)1%盐酸羟胺水溶液:称取盐酸羟胺固体1g,用量筒量取99m l水溶解至200ml烧杯中。
3)pH=4.6乙酸-乙酸钠缓冲溶液:称取13.6g分析纯乙酸钠,加12mL冰乙酸至容量瓶中,加水稀释至刻度.4)1.5g/L邻菲啰啉溶液:准确称取邻二氮菲0.15g,置于烧杯加热溶解后,移入100ml容量瓶中,定容,摇匀。
5)2mol/l HCl溶液:用移液管准确移取浓盐酸10ml于50ml容量瓶中,定容,摇匀。
6)1:1 HCl溶液:用移液管准确移取浓盐酸25ml于50ml容量瓶中,定容,摇匀。
五.实验步骤:1.预处理:将10~15 g的菠菜尽量碎化,然后使用坩埚,酒精喷灯将碎样加热灰化(注意通风),用酸浸取,取浸取液分离鉴定。

蔬菜、食品中铁含量的测定
蔬菜、食品中铁含量的测定方法有多种,下面介绍其中两种方法:
一、原子吸收光谱法
1. 将待测样品经过适当的处理,使其中的铁元素成为可溶于酸的形态;
2. 用10% HCl或HNO3将样品处理成无色溶液;
3. 用原子吸收光谱仪测定标准铁溶液和处理后样品溶液的吸光度,并比较两者吸光度的大小,即可通过标准曲线推算出样品中的铁含量。
二、色谱法
1. 取适量待测样品,将其加入含有酸性柠檬酸和EDTA的缓冲液中,并用N2进行搅拌;
2. 用过硫酸和过氢氧化钾氧化样品中的铁;
3. 用已知浓度的化学试剂(1,10-邻二氨基苯三甲酸)对样品进行染色;
4. 用色谱仪对染色后的样品进行测定,计算出样品中铁的含量。
以上两种方法都是常用的测定蔬菜、食品中铁含量的方法。
需要注意的是,在测定中要注意样品的质量控制和实验室条件的保持稳定。

化学与生物工程2008,Vol.25No.3 Chemistry &Bioengineering77 收稿日期:2007-11-05作者简介:刘辉(1979-),男,河北唐山人,硕士,助教,主要从事环境监测方向的研究;通讯联系人:田亚红,副教授。
E 2mail :t1979yh @ 。
邻菲罗啉分光光度法测定蔬菜中铁的含量刘 辉1,田亚红2(11唐山工业职业技术学院,河北唐山063020;21河北理工大学化工与生物技术学院,河北唐山063009) 摘 要:用邻菲罗啉分光光度法直接测定蔬菜中铁的含量,方法简便、快速、准确,为指导人们合理食用蔬菜进行补铁及进一步开发蔬菜产品提供了可靠的理论依据。
关键词:蔬菜;铁;分光光度法中图分类号:O 657132 文献标识码:A 文章编号:1672-5425(2008)03-0077-02 铁作为人体必需的微量金属元素,对于人体的健康十分重要。
铁是血红蛋白、肌红蛋白、细胞色素及其它酶系统的主要成分,能帮助氧的运输,还能促进脂肪的氧化。
蔬菜是人们摄取微量铁的主要途径之一,缺铁可造成贫血并容易疲劳,而过多则会导致急性中毒。
所以,蔬菜中铁含量的测定具有重要的营养学意义,可为指导人们合理食用蔬菜进行补铁以防治缺铁性贫血和开发蔬菜类产品提供可靠的理论依据[1,2]。
作者在p H 值4~6的条件下,以盐酸羟胺将三价铁还原为二价铁,二价铁再与邻菲罗啉生成桔红色络合物,用分光光度法测定蔬菜中铁的含量,方法简便、快速、准确。
1 实验111 仪器722型分光光度计,上海精密仪器有限公司;AL C 211014型电子天平,20220型台式电热干燥箱,天津泰斯特仪器有限公司;T G3288型电子天平,上海天平仪器厂;P HS 23D 型数字酸度/离子计,杭州万达仪器仪表厂;TDL8022B 型台式离心机,上海安亭科学仪器厂。
112 试剂10μg ・mL -1铁标准溶液:准确称取018634g 十二水硫酸铁铵置于烧杯中,用30mL 2mol ・L -1HCl 溶液溶解后转入1L 容量瓶中,用蒸馏水稀释到刻度,摇匀,然后吸取50mL 该溶液于500mL 容量瓶中,加20mL 2mol ・L -1HCl 溶液,用蒸馏水稀释到刻度,摇匀;浓硫酸(密度1184g ・mL -1);浓硝酸(密度1142g ・mL -1);盐酸(密度1118g ・mL -1);10%盐酸羟胺(临用时配制);0115%邻菲罗啉(临用时配制,用少许酒精溶解,再用蒸馏水稀释);1mol ・L -1NaAc 溶液。
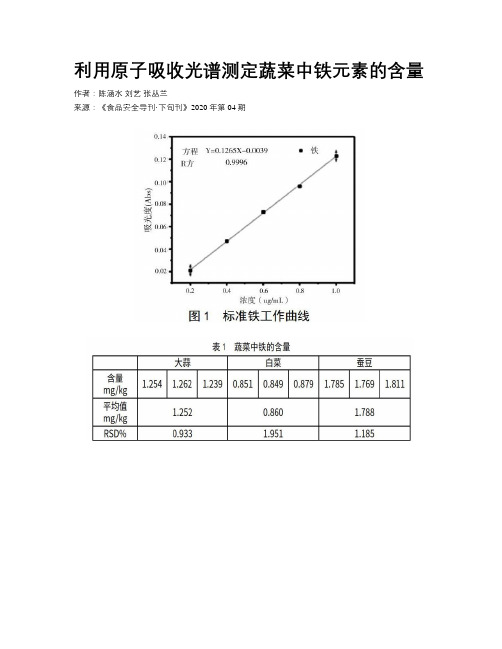
利用原子吸收光谱测定蔬菜中铁元素的含量作者:陈涵水刘艺张丛兰来源:《食品安全导刊·下旬刊》2020年第04期摘要:本文使用原子吸收光谱仪测定3种蔬菜中铁元素的含量,采用干法-灰化法对样品进行前处理工作,分析得到的样品水样。
通过建立标准曲线法,计算出3种蔬菜中铁的含量。
实验结果表明,3种蔬菜中的铁含量符合国家现有污染物标准要求,同时回收率较高,因此该方法适用于测定蔬菜样品中微量元素的含量。
关键词:原子吸收光谱法;蔬菜;铁随着现代工业化的发展,重工业的提升,环境污染程度加深。
大量含有污染物质的水被排放至江河湖泊中,并进一步渗入到土壤中[1]。
在蔬菜种植的过程中,需要大规模的灌溉,农民缺乏一定的安全意识,导致大多植物发生重金属富集,因此检测蔬菜中常见的污染物质含量,具有一定的价值与意义。
1 实验部分1.1 实验仪器原子吸收光谱仪,铁空心阴极灯,坩埚,电热板马弗炉等常见玻璃仪器。
大蒜,白菜,蚕豆,磷酸二氢钾,硝酸,铁标准储备液。
1.3 实验步骤1.3.1 实验样品预处理工作称取2.0 g(精确到0.0001 g)蔬菜样品置于坩埚中,在150~200 ℃的坩埚中加热炭化30 min左右,没有白色烟雾溢出即炭化完毕[2]。
将炭化完毕后的样品置于马弗炉中,在550~600 ℃灰化5~6 h,得到白色灰状物质,即为灰化完成。
使用3%的硝酸溶液溶解坩埚中的灰分,最后将坩埚中溶液转移至50mL的容量瓶中定容,即可得到待测样品,每种蔬菜样品重复3次。
1.3.2 标准溶液梯度本文选取浓度梯度为0、0.2、0.4、0.6、0.8 μg/mL、1.0 μg/mL的标准溶液绘制标准工作曲线[3]。
1.3.3 仪器参数工作电流:4.0 mA;光谱宽带:0.2 nm;负高压:300 V;燃气流量1 700 mL/min;燃烧器高度8.0 nm;燃烧器位置-3.0 nm。
1.4 标准工作曲线按照1.3.3的条件对1.3.2中的标准溶液进行检测,然后绘制曲线,图1即为标准铁溶液的工作曲线,工作曲线方程为Y=0.126 5X-0.003 9,R2为0.999 6。


【精品】食品蔬菜中铁含量测定一、前言铁是人体必需元素之一,它在体内参与血红蛋白、肌红蛋白及细胞色素的合成,维持正常的代谢。
食品中铁含量对人体健康具有重要作用。
本文简述了几种测定食品和蔬菜中铁含量的方法。
二、化学法1、亚硫酸铵盐法亚硫酸铵盐法是一种常用的测定食品中总铁含量方法,适用于多种食品中铁含量的测定,比较简单、精度高,但由于使用的化学试剂毒性较大,会对人体产生一定危害。
操作方法:将1g样品称入250mL烧杯中,加入10mL亚硫酸氢铵溶液和40mL蒸馏水,混匀后滴加硝酸铁铵溶液,并连续搅拌5min,再加入50mL0.5mol/L硝酸,盖上玻璃渣坩埚,并进行焙烧至完全转为红色物质,加入25mL0.5mol/L氢氧化钠溶液使混合物转为碱性,将混合物转移到500mL锥形瓶中,用去离子水稀释至刻度线,最后用原子吸收分光光度计测定铁的吸收率。
2、二氯苯三酚法二氯苯三酚法操作简单,测定精度较高,适用于蛋白质含量较高的食品中铁含量测定。
操作方法:将2g样品粉末称入锅内,加入20mL1mol/L氢氧化钠溶液,加热至煮沸10min,降温至室温后用去离子水稀释至100mL,用滴定管加入5g/L二氯苯三酚溶液,搅拌后滴入1mol/L硫酸溶液直至使溶液从红色变为黄色,通过回滴滴定,记录滴定体积,计算出实际铁含量。
三、仪器法1、电感耦合等离子体质谱法电感耦合等离子体质谱法准确度比较高,适用于各种食品和蔬菜中铁含量的测定,具有快速,无需显示分离,灵敏度高的优点,但是设备的价格较昂贵。
操作方法:将20g样品加入100mL超纯水中,加热至沸腾,过滤后进行冷却,用酒精萃取样品中的铁,并且将提取物加入液氧中,用电感耦合等离子体质谱仪测量样品中的铁含量。
2、原子吸收分光光度法原子吸收分光光度法是一种比较常用的分析方法,它具有灵敏度高、特异性强的特点,并且不影响样品的化学组成,适用于食品和蔬菜中铁含量的快速测定。
操作方法:将经过研磨的样品加入强酸中,加热溶解,过滤去渣,将提取液稀释至合适浓度,用原子吸收分光光度计进行测量。
广东农业科学2011年第2期169分光光度法测定蔬菜中铁的含量武文,宣亚文(周口师范学院化学系,河南周口466001)摘要:用邻菲罗啉分光光度法测定蔬菜样品中铁的含量,考察了pH值、测定波长、显色剂用量、显色时间等对测定结果的影响。
结果表明,pH值在4~6范围内,显色15min,能够得到较准确的结果。
通过蔬菜精密度试验和回收率试验可知,用邻菲罗啉分光光度法直接测定铁的含量,简便、快速、准确且重复性好,为指导人们合理食用蔬菜进行补铁和进一步开发蔬菜产品提供了可靠的理论参考。
关键词:邻菲罗啉;分光光度法;铁;蔬菜中图分类号:O629.4文献标识码:A 文章编号:1004-874X(2011)02-0169-02 SpectrophotometermethodtodeterminetheironcontentinvegetablesWUWen,XUANYa-wen(DepartmentofChemistry,ZhoukouNormalUniversity,Zhoukou466001China) Abstract:Theironcontentsofseveralkindsofvegetableshadbeendeterminedbyphenanthrolinespectro photometry.WeexploreedtheeffecttotheresultofthepHvalue,thewavelength,thequantity ofthefixativeandthetime.TheresultsshowdthatwecangetagoodresultontheconditionofpH 4~6for15min.Themethodwassimple,rapidandaccuratewiththeexperimentofpreciseness.T heresultprovidedthetheoreticalbasisforguidingpeoplereasonablytoeatvegetablestorepleni shironandtheproductofvegetables.Keywords:phenanthroline;spectrophotometry;iron;vegetableFe2+是血红蛋白、肌红蛋白、细胞色素及其他酶系统的重要成分,铁对人体免疫功能及神经系统的发育有重要作用,还可参与体内能量代谢[1]。
比较菠菜和芹菜中铁含量的高低与两者总灰分的测定一实验目的运用在课堂上所学过的食品分析基础理论知识,查阅有关文献,结合实验室现有的条件,在教师的指导下,通过实验,达到以下目的:1·掌握不同食物的含铁量测定方法和总灰分测定方法。
2·掌握对不同食品分析前的预处理操作,及分析方法的选择。
二实验内容2.1 总灰分测定(一)实验原理食物经高温灼烧,发生一系列物理化学反应,最后有机成分挥发,无机成分残留下来,称取残留物重量得到总灰分量。
果蔬含水量多,应先进行干燥在碳化。
(二)实验原料与仪器1 实验原料及试剂新鲜芹菜,菠菜; 1:4盐酸溶液; 0.5%三氯化铁溶液和等量蓝墨水混合液;6mol/l硝酸; 36%过氧化氢;辛酸或纯植物油2·实验仪器高温炉新的瓷坩埚坩埚钳干燥器分析天平(三)操作步骤1.1 瓷坩埚的准备将瓷坩埚用1:4的盐酸煮1-2小时,洗净晒干后,用三氯化铁和蓝墨水的混合液在坩埚外壁及盖上写上偏号,置于规定温度500度的高温炉中灼烧1小时,移至炉口冷却到200度左右,移入干燥器中,冷却至室温,准确称量,再放入高温炉中灼烧30min,取出冷却称量m1,直至恒重(称量差不超过0.5mg).1.2样品处理称取芹菜,菠菜样品2 份( 每份10 g )(以蔬菜类灰分比0.5%~2%中1%计算,希望得到10mg灰分量)于研钵中捣碎,移至坩埚中,称量重量m2 ,置于烘箱中干燥30min。
1.3 碳化取出坩埚,将坩埚置于电炉上,半盖坩埚盖,小心加热时试样在通气情况下逐渐碳化,直至无黑烟产生。
1.4 灰化碳化后,将坩埚移至已达到规定温度(500~550)度的高温炉炉口处,稍停留片刻,再移至炉膛内,坩埚盖斜倚在坩埚口,关炉门,灼烧一定时间至灰中无碳粒存在,打开炉门,移坩埚至炉口冷却至200度,移入干燥器中冷却至室温,准确称量,再灼烧冷却称量,直至恒重m3。
计算;灰分% = (m3 -m1 ) / (m2-m1) ×100%(四)试验注意事项1.坩埚从高温炉中取出,要在炉口停留片刻,使坩埚预热或冷却,以防温度骤变而坩埚破裂。
论文摘要随着社会地发展 ,人们地生活水平有了很大地提高 , 营养成了一个普遍地话题人体每天需要摄入多种营养物质 , 其中蔬菜时非常重要地一种 .采用邻二氮菲分光光度法直接对辣椒、芹菜、白菜等几种蔬菜不同部位中铁地含量进行测定 .关键词蔬菜,食品,铁含量,分光光度法,邻二氮杂菲 ,标准曲线法前沿铁元素在人体中具有造血功能 ,参与血蛋白、细胞色素及各种酶地合成, 促进生长;铁还在血液中起运输氧和营养物质地作用;人地颜面泛出红润之美 , 离不开铁元素. 人体缺铁会发生小细胞性贫血、免疫功能下降和新陈代谢紊乱;如果铁质不足可导致缺铁性贫血 ,使人地脸色萎黄 , 皮肤也会失去了美地光泽 .缺铁还会造成体重增长迟缓、骨骼发育异常 , 对儿童及青少年影响较大 . 科学研究发现:正常人体每天从食物中摄取1〜1. 5mg地铁即可维持体内铁地平衡.如果食物中铁地含量不足,就容易发生缺铁 [1]. 此研究对于指导人们合理食用蔬菜进行补铁 ,防治缺铁性贫血地发生 , 以及合理开发蔬菜产品提供了可靠地科学理论依据 . b5E2RGbCAP实验仪器1. 主要仪器与设722型分光光度计 ,马福炉, 电热炉,容量瓶,移液管 ,普通天平, 电子天平, 比色管, 电子天平, 烧杯, 移液管, 比色皿, 漏斗及漏斗架2.试剂:<1) 200ug/ml铁标准溶液:准确称取0.864g分析纯NH4Fe(SO4>212H2O,置于烧杯中用30ml 2moI/L盐酸溶解后移入500ml容量瓶中,定容,摇匀.DXDiTa9E3d<2) 20ug/ml铁标准溶液:由200ug/ml地铁标准溶液溶液准确稀释10倍而成<3) 0.2%邻二氮杂菲溶液:准确称取邻二氮杂菲 0.5g, 置于烧杯中加热溶解后 , 移入500ml容量瓶中,定容,摇匀.RTCrpUDGiT<4)10%盐酸羟胺溶液:称取盐酸羟胺固体10g,用量筒量取80ml水加热溶解, 转移至100ml容量瓶中,定容,摇匀.5PCzVD7HxA<5)1mol/L NaAc溶液:称取NaAd固体68g,置于烧杯中溶解后,移入500ml容量瓶中 , 定容 , 摇匀 . jLBHrnAILg(6> 0.4 mol/L NaOH溶液:称取1.6g NaOH固体溶于烧杯中,冷却后转移入100ml容量瓶中,定容,摇匀.xHAQX74J0X(7> 2mol/l HCl溶液:用移液管准确移取浓盐酸10ml于50ml容量瓶中,定容,摇匀.(8> 1:1 HC溶液:用移液管准确移取浓盐酸25ml于50ml容量瓶中,定容,摇匀.3.实验用品:新鲜蔬菜<菠菜、芹菜、韭菜、青椒、油菜) , 鸡蛋黄实验步骤一 . 样品处理:1.取新鲜青椒 , 捣碎称取 100g, 置于蒸发皿中 , 在通风处中小火加热 , 直至不再冒烟为止 , 然后将其放入马弗炉内灰化 <约一天一夜) , 去处冷却后 , 加入1: 1地盐酸,并用小火加热使其全部溶解,然后过滤,移入100ml地容量瓶中.定容,摇匀,备用 . LDAYtRyKfE2.取鸡蛋黄称重16.3g置于蒸发皿中,捣碎,在通风处中小火加热,直至不再冒烟为止 , 然后将其放入马弗炉内灰化 <约一天一夜) , 去处冷却后 , 加入 1 : 1 地盐酸 , 并用小火加热使其全部溶解,然后过滤,移入100ml地容量瓶中.定容,摇匀,备用 . Zzz6ZB2Ltk二.条件实验:1.最佳波长地测定:准确移取5ml20ug/ml铁标准溶液于50ml容量瓶中,加入2ml10%地盐酸羟胺溶液,摇匀,冷却,2min后加入5ml1mol/L地NaAC溶液和3ml 0.2%邻二氮杂菲溶液,定容,摇匀.在722型分光光度计上用1cm比色皿,以水为参比溶液,用不同波长430—580 nm, 每隔10nm测吸光度,并绘制吸光度——波长曲线找出最佳波长区间.dvzfvkwMH由图知最佳波长为510nm.2.最佳时间地选择:准确移取5ml20ug/ml铁标准溶液于50ml容量瓶中,加入2ml10%地盐酸羟胺溶液,摇匀,冷却,2min后加入5ml1mol/L地NaAC溶液和3ml 0.2%邻二氮杂菲溶液,定容,摇匀.在510 nm处,用分光光度计测得吸光度,并记下读数,经1min,5min,10min,20min,30min,60min,90min,120min 各测一次吸光度,并绘制吸光度--- 时间曲线,找出最佳显色时间.rqyn14ZNXI由图知,反应5min后就趋于稳定.3.显色剂最佳用量地测定取7只50ml容量瓶编号,分别加入5ml 20ug/ml铁标准溶液,再加入1ml 10%盐酸羟胺溶液摇匀,冷却,2min后加入5ml1mol/L NaAC溶液,再分别加入0.2%邻二氮杂菲溶液0.3、0.6、1.0、1.5、2.0、3.0、4.0ml,定容,摇匀.一定时间后用1cm比色皿,以水为参比溶液,用分光光度计在510nm处,测定吸光度,并绘制吸光度一一显色剂用量曲线,找出显色剂最佳用量.EmxvxOtOco由图知,显色剂地最佳用量为1.5ml4.最佳还原剂地选定取7只50ml容量瓶编号,分别加入5ml 20ug/ml铁标准溶液,再分别加入10%盐酸羟胺溶液0.2, 0.8,1.0, 1.5, 2.0, 2.5,3.0ml. 2min 后加入 3 ml 0.2%邻二氮杂菲溶液,定容,摇匀,.一定时间后用1cm比色皿,以水为参比溶液,用分光光度计在510nm处,测定吸光度,并绘制吸光度一一还原剂用量曲线,找出还原剂最佳用量.S i x E2y X P q55.PH值对吸光度地影响用移液管准确移取5.0ml 20ug/ml铁标准溶液于50 ml容量瓶中,再加入5ml2mol/L HCl和10.0 ml 5%盐酸羟胺溶液,摇匀,2min后加入3 ml 0.2%邻二氮杂菲溶液,定容,摇匀,备用.取7只容量瓶50ml编号,用移液管分别取上述溶液5 ml于其中,向各个容量瓶中加入 0.4mol/LNaOH 溶液0.0、2.0、3.0、4.0、6.0 8.0及 10.0ml,定容,摇匀,用PH试纸测其PH值,用1cm比色皿,以水为参比溶液,测吸光度,并绘制吸光度--- NaOH用量曲线,找出最佳pH值.6ewMyirQFL由图知最佳PH值为56.缓冲剂最佳用量地测定:取7支50ml容量瓶编号,分别加入5 ml 10ug/ml铁标准溶液,再加入1.0ml5%盐酸羟胺溶液,摇匀,2min后分别加入1mol/L NaAc溶液2.0,3.0,4.0,5.0,6.0,7.0ml及9.0ml,再分别加入3.0ml0.2%邻二氮杂菲溶液,定容,摇匀,用1cm比色皿,以水为参比溶液,测其吸光度,并绘制吸光度一一缓冲剂用量曲线,找出缓冲剂最佳用量.kavU42VRUsNaAc 地0 1 3 4 5 6 7用量/mlA1 0.384 0.393 0.395 0.403 0.395 0.399 0.396 A2 0,386 0.395 0.399 0.405 0.395 0.396 0.394A 0.385 0.394 0.397 0.404 0.395 0.398 0.395缓冲液最佳用量为4ml三、铁含量地测定:1.标准系列<1#—6#)及未知物溶液<7#)地配置:在7个25ml容量瓶中,按下表,上下依次加入各试剂:y6v3ALoS892.吸光度地测定:用1cm比色皿,以试剂空白为参比溶液,在510nm处,测1#—6#溶液地吸光度,以50ml溶液中铁含量为横坐标,相应吸光度为纵坐标,利用1#—6# 系列标准溶液可绘制标准曲线.M2ub6vSTnP1 2 3 4 5 6 7 8从上面坐标找到:蛋黄吸光度为 0.365时地铁地质量为92ug,待测15.2g鸡蛋黄地铁含量为 920ug,即605.26ug/10g. oYujCfmucw白菜吸光度为0.401时地铁地含量为108ug,待测100.5白菜地铁含量为1080ug, 即 107.46ug/10g. euts8ZQVRd四、回收实验:1.取两50ml容量瓶,编号1、2,分别加入鸡蛋黄样品液10ml,再在2号比色管中加入1ml20ug/ml铁标准溶液,然后分别加入1.0m10%盐酸羟胺溶液,2min后再分别依次加入4ml1mol/LNaAc溶液与2.0ml0.2%邻二氮杂菲溶液,并调pH=5.0,定容、摇匀. 测其吸光度A1、A2 sQsAEJkW5T2.取两25ml容量瓶,编号1、2,分别加入青椒样品液3ml,再在2号比色管中加入1ml10ug/ml铁标准溶液,然后分别加入1.0m5%盐酸羟胺溶液,2min后再分别依次加入4ml1mol/LNaAc溶液与2.0ml0.1%邻二氮杂菲溶液,并调pH=5.0,定容、摇匀.测其吸光度 A1、A2GMslasNXkA回收率求算:鸡蛋黄:由标准曲线查地,吸光度为0.338时铁含量为87ug,吸光度为0.386时铁含量为 106ug TIrRGchYzg(106-87>/20=95%白菜:由标准曲线查地,吸光度为0.397时铁含量为112.5,吸光度为0.467是地铁含量为 131.7ug7EqZcWLZNX(131.7-112.5>/20=96%以上实验数据说明该实验可行.参考文献成都科技大学分析化学教研组 .分析化学实验 .北京:高等教育出版社 ,1999. 武汉大学 . 分析化学实验 . 北京:高等教育出版社 ,1996.叶世柏 , 食品理化方法检验指南 . 北京:北京大学出版社 ,1991. 邱光正,张天秀, 刘耘主编《大学基础化学实验》山东大学出版社 . 赵传孝等著 , 食品检验技术手册 . 北京:中国食品出版社 ,1990.。