食品中铁含量的测定
- 格式:doc
- 大小:38.50 KB
- 文档页数:2


食品中铁的测定1 原理试样经湿消化后,导入原子吸收分光光度计中,经火焰原子化后,铁吸收248.3nm的共振线,其吸收量与他们的含量成正比,与标准系列比较定量。
2 试剂2.1 盐酸2.2 硝酸2.3 高氯酸2.4 混合酸消化液:硝酸+高氯酸=4+12.5 0.5mol/L硝酸溶液:量取32mL硝酸,加去离子水并稀释至1000mL。
2.6 铁标准溶液:准确称取金属铁(纯度大于99.99%)1.0000g,或含1.0000g纯金属相对应的氧化物。
分别加硝酸溶解并移入1000mL容量瓶中,加0.5mol/L硝酸溶液并稀释至刻度。
贮存于聚乙烯瓶内,4℃保存。
2.7 标准应用液:吸取10.0mL铁标准溶液,稀释定容至100mL容量瓶中,即所得标准使用液浓度为100μg/mL。
配置后,贮存于聚乙烯瓶内,4℃保存。
3 仪器所用玻璃仪器均硫酸-重铬酸钾洗液浸泡数小时,再用洗衣粉充分洗刷,后再用水反复冲洗,最后用去离子水冲洗晒干或烘干,方可使用。
3.1 实验室常用设备3.2 原子吸收分光光度计4 分析步骤4.1 试样处理4.1.1 试样制备:微量元素分析的试样制备过程中应特别注意防止各种污染。
所用设备如打碎机等必须是不锈钢制品。
所用容器必须使用玻璃或聚乙烯制品。
鲜试样(如蔬菜、水果、鲜肉、鲜鱼等)用自来水冲洗干净后,要用去离子水充分洗净。
干粉类试样(如面粉、奶粉等)取样后立即装容器密封保存,防止空气中的灰尘和水分污染。
4.1.2 试样消化:精确称取均匀试样干样0.5g-1.5g,湿样2.0-4.0g,饮料等液体样品5.0-10.0g 于250mL高型烧杯中,加混合酸消化液20mL-30mL,上盖表面皿。
置于电热板或电沙浴上加热消化。
如未消化好而酸液过少时,再补加几毫升混合酸消化液,继续加热消化,直至无色透明为止。
再加几毫升水,加热以除去多余的硝酸。
待烧杯中的液体接近2ml-3mL时,取下冷却。
用去离子水洗并转移至10mL刻度试管中,加水定容至刻度。

食品中铁的提取与检测方法研究引言食物中的营养成分对于维护人体的健康至关重要。
其中,铁是一种重要的矿物质,它参与体内血红蛋白的合成,对血液循环和氧气供应至关重要。
因此,对于食品中铁的提取和检测方法的研究具有重要的实际意义。
本文将就食品中铁的提取和检测方法进行深入探讨。
提取方法的研究1.1 溶液提取法溶液提取法是目前常用的提取食品中铁的方法之一。
将待测食品样品与一定比例的试剂混合,通过搅拌、酸碱调节等操作,使铁离子溶解在溶液中。
随后,使用适当的仪器设备对溶液中的铁离子进行检测。
1.2 超声波提取法超声波提取法是通过超声波的作用,加速食品中铁的离出。
超声波具有强大的机械作用,可以有效破坏食品细胞结构,促进铁的释放。
该方法操作简单、提取效果好,因此在食品中铁的提取中被广泛应用。
1.3 高压提取法高压提取法是通过高压的作用将铁离子从食品样品中迅速释放出来。
高压作用下,食品细胞壁受到破坏,铁更容易从细胞间隙中释放出来。
这种方法可以快速提取食品中的铁,并得到较高的回收率。
检测方法的研究2.1 原子吸收光谱法原子吸收光谱法是一种常见的检测食品中铁含量的方法。
该方法利用铁原子对特定波长的光的吸收性能进行分析,从而得到样品中铁的浓度。
这种方法具有灵敏度高、准确度好的特点,但操作较为复杂,需要较高的仪器设备。
2.2 电化学法电化学法是一种简便、快速检测食品中铁含量的方法。
该方法基于电化学技术,通过测量电信号的变化来间接检测铁的含量。
电化学法具有灵敏度高、操作简单的特点,广泛应用于食品质量安全检测领域。
2.3 光谱法光谱法是一种基于物质吸收、散射、发射等光学特性进行食品中铁含量分析的方法。
通过测量样品对光的吸收、散射、发射的强度变化,可以得到铁的浓度。
光谱法具有方法简便、结果准确等优点,因此被广泛应用于食品中铁含量的检测。
结论食品中铁的提取和检测方法的研究具有重要的理论和实际价值。
通过不断的探索和创新,我们可以寻找到更加高效、准确的提取和检测方法,为食品质量的监测提供更可靠的技术支持。

实验十一 硫氰酸钾比色法测定食品中铁一、实验内容使用可见分光光度计测定样品中铁的含量。
二、实验目的与要求1、学习掌握分光光度计测定的原理及操作技术。
2、掌握绘制工作曲线法进行定量测定。
三、实验原理硫氰酸钾比色法:在酸性条件下,三价铁离子与硫氰酸钾作用,生成血红色的硫氰酸铁络合物,溶液颜色深浅与铁离子浓度成正比,故可以比色测定。
反应式如下:Fe 2(SO 4)3 + 6 KCNS 2 Fe(CNS)3 + 3 K 2SO 4四、试剂(1)2% KMnO 4溶液(2)20% KCNS 溶液(3)2% K 2S 2O 7溶液(4)浓H 2SO 4(5)铁标准使用液:准确称取0.4979g 硫酸亚铁(FeSO 4 · 7H 2O )溶于100 mL水中,加入5 mL 浓硫酸微热,溶解即滴加2 %高锰酸钾溶液,至最后一滴红色不褪色为止,用水定容至1000 mL ,摇匀,得标准贮备液,此液每毫升含Fe 3+100µg。
取铁标准贮备液10 mL 于100 mL 容量瓶中,加水至刻度,混匀,得标准使用液,此液每mL 含Fe 3+10µg。
五、仪器可见分光光度计六、实验步骤1、样品处理:称取均匀样品12.5g,干法灰化后,加入2mL (1:1)盐酸,在水浴上蒸干,再加入5mL蒸馏水,加热煮沸后移入100mL容量瓶中,以水定容,混匀。
2、标准曲线绘制:准确吸取上述铁标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL,分别置于25mL容量瓶或比色管中,各加5mL水,0.5ml浓硫酸,0.2mL 2%过硫酸钾,2mL 20%硫氰酸钾,混匀后稀释至刻度,用1cm比色皿,在485nm处,以试剂空白作参比液测定吸光度。
以铁含量(µg)为横坐标,以吸光度为纵坐标绘制标准曲线。
3、样品测定:准确吸取样液5~10mL,置于25mL容量瓶或比色管中,以下按标准曲线绘制步骤进行,测得吸光度,从标准曲线上查出相对应的铁的含量。

【精品】食品蔬菜中铁含量测定一、前言铁是人体必需元素之一,它在体内参与血红蛋白、肌红蛋白及细胞色素的合成,维持正常的代谢。
食品中铁含量对人体健康具有重要作用。
本文简述了几种测定食品和蔬菜中铁含量的方法。
二、化学法1、亚硫酸铵盐法亚硫酸铵盐法是一种常用的测定食品中总铁含量方法,适用于多种食品中铁含量的测定,比较简单、精度高,但由于使用的化学试剂毒性较大,会对人体产生一定危害。
操作方法:将1g样品称入250mL烧杯中,加入10mL亚硫酸氢铵溶液和40mL蒸馏水,混匀后滴加硝酸铁铵溶液,并连续搅拌5min,再加入50mL0.5mol/L硝酸,盖上玻璃渣坩埚,并进行焙烧至完全转为红色物质,加入25mL0.5mol/L氢氧化钠溶液使混合物转为碱性,将混合物转移到500mL锥形瓶中,用去离子水稀释至刻度线,最后用原子吸收分光光度计测定铁的吸收率。
2、二氯苯三酚法二氯苯三酚法操作简单,测定精度较高,适用于蛋白质含量较高的食品中铁含量测定。
操作方法:将2g样品粉末称入锅内,加入20mL1mol/L氢氧化钠溶液,加热至煮沸10min,降温至室温后用去离子水稀释至100mL,用滴定管加入5g/L二氯苯三酚溶液,搅拌后滴入1mol/L硫酸溶液直至使溶液从红色变为黄色,通过回滴滴定,记录滴定体积,计算出实际铁含量。
三、仪器法1、电感耦合等离子体质谱法电感耦合等离子体质谱法准确度比较高,适用于各种食品和蔬菜中铁含量的测定,具有快速,无需显示分离,灵敏度高的优点,但是设备的价格较昂贵。
操作方法:将20g样品加入100mL超纯水中,加热至沸腾,过滤后进行冷却,用酒精萃取样品中的铁,并且将提取物加入液氧中,用电感耦合等离子体质谱仪测量样品中的铁含量。
2、原子吸收分光光度法原子吸收分光光度法是一种比较常用的分析方法,它具有灵敏度高、特异性强的特点,并且不影响样品的化学组成,适用于食品和蔬菜中铁含量的快速测定。
操作方法:将经过研磨的样品加入强酸中,加热溶解,过滤去渣,将提取液稀释至合适浓度,用原子吸收分光光度计进行测量。

食物中铁、铜、锰、镁、锌的测定方法原子吸收分光光度法1.原理每种元素的原子能够吸收其特定波长的光能,而吸收的能量值与该光路中该元素的原子数目成正比。
用特定波长的光照射这些原子,测量该波长的光被吸收的程度,用标准溶液制成校正曲线。
根据被吸收的光量求出被测元素的含量。
2.适用范围依据中华人民共和国国家标准,铁:GB12396-90,铜:GB/T5009.13-96,锰:GB12396-90,镁:GB12396-90,锌:GB/T5009.14-96。
适用于所有食品及保健品中元素含量的测定,其元素含量在1mg/kg浓度以上。
3.仪器原子吸收光谱分光光度计4.试剂(1)硝酸(GB)高氯酸(GB)(2)混合酸消化液:硝酸+高氯酸按4:1混合(3) 0.5mol/L硝酸溶液:取33mL硝酸,加去离子水稀释至1000mL,定溶即成。
(4) 0.121%盐酸(5)去离子水:(KΩ)80万以上。
(6)国家标准物质研究中心提供的标准贮备液:铁标准溶液、铜标准溶液、锰标准溶液、锌标准溶液、镁标准溶液,以上标准液浓度均为1000μg/mL(7)标准质控物:国家标准物质研究中心提供的猪肝粉,室温干燥保存。
(8)标准储备液的配制:吸取上述标准溶液各10mL(镁5mL),分别移入100 mL容量瓶中,然后用稀释用溶液定容至100 mL(铁、铜、锰、镁用0.5mol/L硝酸溶液稀释定容,锌用1%盐酸稀释定容)。
以上各溶液须放聚乙烯瓶内,4℃冰箱保存。
5.操作步骤5.1样品制备:每种样品采集的总重量不得少于1.5Kg,样品须打碎混匀后再称重。
鲜样(如:蔬菜、水果、鲜鱼等)应先用水冲洗干净后,再用去离子水充分洗净,凉干后打碎称重。
所有样品应放在塑料瓶或玻璃瓶中4℃或室温保存。
5.2样品消化:准确称取样品干样(0.3-0.7g左右),湿样(1.0g左右),饮料等其他液体样品 (1.0-2.0g左右),然后将其放入50mL消化管中, 加混酸15mL左右,过夜。

奶粉中铁的测定和白梨中V C的测定食品中铁的测定-----邻菲罗啉比色法1.实验目的:熟练掌握样品前处理方法,掌握灰化法作为矿物质测定的前处理方法和应用。
掌握邻菲罗啉比色法测铁的原理、操作及注意事项。
2实验原理:灰化:奶粉经高温灼烧至恒重,残留物称重称为灰分铁的测定:样品经灰化(或消化),用抗坏血酸将三价铁还原为二价铁,二价铁与邻菲罗啉反应生成红色物质,在520nm下测其光吸收强度A,根据A值在标准曲线上查对应二价铁浓度得C样,再计算样品中铁的含量。
3试剂:显色剂(3g/L):邻菲罗啉铁标准溶液:硫酸亚铁铵 C=10ug/mL抗坏血酸:10 ug/mL雀巢奶粉4 仪器瓷坩埚、灰化炉、干燥器、精密天平、水浴、可见光分光光度计、25ml比色管5实验内容及操作过程:5.1样品前处理灰化:(1)取大小适宜的瓷坩埚置于高温炉中,在600°C下灼烧0.5h,冷却至200°C以下后,取出,放入干燥器中冷却至室温,精密称量,并重复灼烧至恒重m埚。
(2)加入3g左右固体样品,精密称量m总(3) 固体样品,先以电炉子加热充分炭化至无烟,重复灼烧至前后两次称重之差不超过0.5mg为恒重,然后至于灰化炉中,在500~600°C灼烧至无炭粒,即灰化完全。
冷却至200°C以下后取出放入干燥器中冷却至室温,称重 m总’。
5.2 铁含量的测定(1)标准曲线的绘制:分别吸取0.00、2.00、4.00、6.00、8.00、10.00mL 标准溶液,放入比色管中,加入1mL抗坏血酸和2mL显色剂,并定容至25mL,混匀,然后60°C水浴下加热15分钟后,冷却。
将各比色管中的有色溶液依次注入比色皿中,以“0”管溶液为参比溶液,在520nm下,测其它各管有色溶液的吸光度值A1A2A3A4A5 。
(2)样品测定:称取样品3g,经灰化,并定容至100mL,制成灰化液,吸取n个10.00mL灰化液于比色管中,以下各个步骤同于标准曲线绘制的操作,测样液的A样值。

食品中铁含量的测定
食品中铁含量的测定是食品质量检测的重要环节,对确定食品的质量水平和安全性具有重要的意义,可以避免由于铁缺乏而引起的营养不良症状。
铁含量的测定方法有分光光度法、比色法和电位滴定法等,其中分光光度法是目前较为常用的测定方法。
其检定原理是以亮度衰减由铁在恒定浓度的影响下发生改变(尤其是φ 530nm ),用该波段的荧光强度(亮度)作为对变量,获得铁的浓度,从而测定食物中的铁含量。
分光光度法测定铁含量的具体步骤如下:首先,将样品经HCl提取液稀释、加氢氧化钠和形成稀释的抗氧化剂混合放置1小时,使样品中的铁离子转化为氢氧化铁;其次,加入固定厌氧剂、形成解离液,加热放置3小时,使溶液中的氢氧化铁转化为离子化合物形成互联耗尽;第三,添加非混合指示剂和固定厌氧剂,制备测定液,然后安装分光光度计;最后,按照操作步骤去测定比较点,检定铁含量。
通过以上步骤,测定食品中的铁含量,不仅能够了解食品的质量水平和安全性,还有助于及时发现食品的潜在缺陷,保障其安全性及新鲜度。
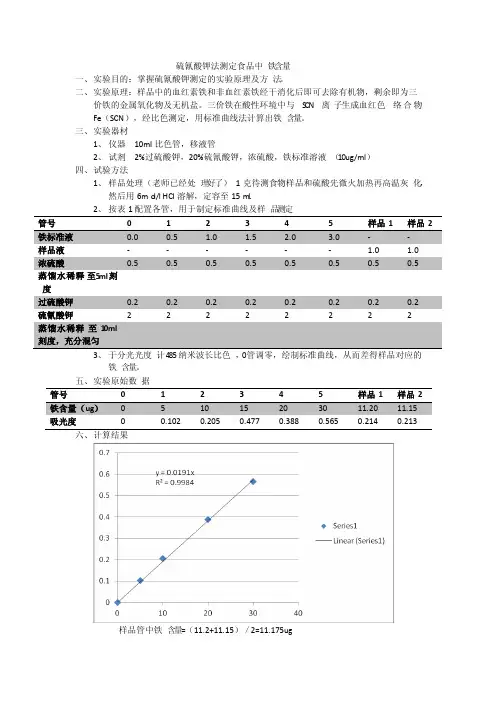
硫氰酸钾法测定食品中铁含量一、实验目的:掌握硫氰酸钾测定的实验原理及方法。
二、实验原理:样品中的血红素铁和非血红素铁经干消化后即可去除有机物,剩余即为三价铁的金属氧化物及无机盐。
三价铁在酸性环境中与S CN离子生成血红色络合物Fe(SCN),经比色测定,用标准曲线法计算出铁含量。
三、实验器材1、仪器10ml比色管,移液管2、试剂2%过硫酸钾,20%硫氰酸钾,浓硫酸,铁标准溶液(10ug/ml)四、试验方法1、样品处理(老师已经处理好了)1克待测食物样品和硫酸先微火加热再高温灰化,然后用6mo l/l HCl溶解,定容至15m l.2、按表1配置各管,用于制定标准曲线及样品测定管号0 1 2 3 4 5 样品1 样品2浓硫酸0.5 0.5 0.5 0.5 0.5 0.5 0.5 0.5蒸馏水稀释至5ml刻度过硫酸钾0.2 0.2 0.2 0.2 0.2 0.2 0.2 0.2硫氰酸钾 2 2 2 2 2 2 2 2蒸馏水稀释至10ml刻度,充分混匀3、于分光光度计485纳米波长比色,0管调零,绘制标准曲线,从而差得样品对应的铁含量。
五、实验原始数据管号0 1 2 3 4 5 样品1 样品2吸光度0 0.102 0.205 0.477 0.388 0.565 0.214 0.213六、计算结果样品管中铁含量=(11.2+11.15)/2=11.175ug样品处理液定容数V1=25ml从V1中取液量V2=1ml样品重量W=1g×1000)则样品铁含量(m g/100g)=(Q×V1×100)/(W×V2=(11.175×25×100)/(1×1×1000)=27.94(mg/100g)七、结果分析与讨论1、实验样品为强化铁玉米粉,测定的铁含量会高于玉米粉本身的铁含量。

实验十一硫氰酸钾比色法测定食品中铁一、实验内容使用可见分光光度计测定样品中铁的含量。
二、实验目的与要求1、学习掌握分光光度计测定的原理及操作技术。
2、掌握绘制工作曲线法进行定量测定。
三、实验原理硫氰酸钾比色法:在酸性条件下,三价铁离子与硫氰酸钾作用,生成血红色的硫氰酸铁络合物,溶液颜色深浅与铁离子浓度成正比,故可以比色测定。
反应式如下:Fe2(SO4)3 + 6 KCNS 2 Fe(CNS)3 + 3 K2SO4四、试剂(1)2% KMnO4溶液(2)20% KCNS溶液(3)2% K2S2O7溶液(4)浓H2SO4(5)铁标准使用液:准确称取0.4979g硫酸亚铁(FeSO4 ·7H2O)溶于100 mL 水中,加入5 mL浓硫酸微热,溶解即滴加2 %高锰酸钾溶液,至最后一滴红色不褪色为止,用水定容至1000 mL,摇匀,得标准贮备液,此液每毫升含Fe3+100µg。
取铁标准贮备液10 mL于100 mL容量瓶中,加水至刻度,混匀,得标准使用液,此液每mL含Fe3+10µg。
五、仪器可见分光光度计六、实验步骤1、样品处理:称取均匀样品12.5g,干法灰化后,加入2mL (1:1)盐酸,在水浴上蒸干,再加入5mL蒸馏水,加热煮沸后移入100mL容量瓶中,以水定容,混匀。
2、标准曲线绘制:准确吸取上述铁标准溶液0.0、1.0、2.0、3.0、4.0、5.0mL,分别置于25mL容量瓶或比色管中,各加5mL水,0.5ml浓硫酸,0.2mL 2%过硫酸钾,2mL 20%硫氰酸钾,混匀后稀释至刻度,用1cm比色皿,在485nm处,以试剂空白作参比液测定吸光度。
以铁含量(µg)为横坐标,以吸光度为纵坐标绘制标准曲线。
3、样品测定:准确吸取样液5~10mL,置于25mL容量瓶或比色管中,以下按标准曲线绘制步骤进行,测得吸光度,从标准曲线上查出相对应的铁的含量。
七、结果处理xFe (µg/100g) = ——————× 100m × (V1/V2)式中: x —从标准曲线上查得测定用样液相当的铁含量,µgV1 —测定用样液体积,mLV2 —样液总体积,mLm —样品质量,g八、说明1、加入的过硫酸钾是作为氧化剂,以防止三价铁转变成二价铁。

6食品中铁的测定实验六食品中铁的测定一、实验目的1. 了解食品中铁含量测定的意义与原理;2. 掌握分光光度计的使用方法及原理;3. 掌握铁标准曲线的制备方法。
二、基本原理邻二氮杂菲是测定微量铁较好的试剂。
在pH为2~9的溶液中,邻二氮杂菲与Fe2+生成稳定的橙红色配合物,比色后即可定量。
显色反应如下:三、实验器材1. 仪器:721分光光度计,1cm比色皿,50mL容量瓶10只,5mL 吸液管一支,10mL吸液管一支,200mL烧杯2 只,洗瓶一只。
2. 试剂:(1)盐酸羟胺溶液(100 g/L):称取100 g盐酸羟胺,用水溶解并稀释至1000mL;(2)盐酸:1:1和1:9溶液;(3)乙酸钠溶液(450g/L):称取45g乙酸钠,加水溶解并稀释至100mL;(4)0.2[%]邻二氮杂菲:称取0.20g邻氮二杂菲于烧杯中,加60mL水,加热溶解(不超过80℃),移入100mL容量瓶中,用水稀释至刻度,摇匀;(5)铁标准贮备液(1mL溶液含有0.1 mg铁):准确称取0.8634g 分析纯NH4Fe(S04)2??12H2O于200mL烧杯中,加入20mL 6mol/L HCl 和少量水,溶解后转移至1L容量瓶中,稀释至刻度,摇匀;(6)铁标准使用液(1mL溶液含 2μg铁):吸取铁标准贮备液20.00mL于100mL容量瓶中,用水稀释至刻度,此溶液每毫升含0.02 mg铁,吸取铁标准贮备液10.00mL于100mL容量瓶中,用水稀释至刻度,此溶液每毫升含2μg铁。
四、操作步骤1. 样品的处理:(1)干法:吸取25.00mL 试样(V)于蒸发皿中,在水浴上蒸干,置于电炉上小心炭化,然后移入 550±25℃高温电炉中灼烧,灰化至残渣呈白色,取出,加入10mL1+1盐酸溶解,在水浴上蒸至约2mL,再加入5mL水加热煮沸后,移入50mL容量瓶中,用水洗涤蒸发皿,洗液并入容量瓶,加水稀释至刻度(V2),摇匀。
一、实验目的1. 掌握食品中铁含量的测定方法。
2. 了解分光光度法在食品中铁含量测定中的应用。
3. 熟悉实验操作步骤,提高实验技能。
二、实验原理食品中铁含量的测定主要采用分光光度法。
该方法基于铁离子与特定试剂反应生成有色络合物,通过测定该络合物在特定波长下的吸光度,计算食品中铁的含量。
三、实验仪器与试剂1. 仪器:分光光度计、电子天平、烧杯、移液管、试管、滴定管、容量瓶等。
2. 试剂:铁标准溶液、盐酸、硫酸、氨水、邻菲罗啉试剂、氯仿等。
四、实验步骤1. 样品处理(1)准确称取一定量的样品,放入烧杯中。
(2)加入适量的盐酸和硫酸,微火加热至样品完全溶解。
(3)将溶液转移至容量瓶中,用水定容至刻度线。
2. 标准曲线绘制(1)取一系列铁标准溶液,分别加入适量的邻菲罗啉试剂,混匀。
(2)在分光光度计上,以氯仿为参比,于特定波长下测定吸光度。
(3)以铁浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
3. 样品测定(1)取一定量的处理后的样品溶液,加入适量的邻菲罗啉试剂,混匀。
(2)在分光光度计上,以氯仿为参比,于特定波长下测定吸光度。
(3)根据标准曲线,计算样品中铁的含量。
五、实验结果与分析1. 标准曲线绘制根据实验数据,绘制标准曲线,得出线性回归方程为:y = 0.0028x + 0.0036,相关系数R² = 0.9988。
2. 样品测定根据标准曲线,计算样品中铁的含量,结果如下:样品1:铁含量为0.50 mg/g样品2:铁含量为0.65 mg/g样品3:铁含量为0.45 mg/g样品4:铁含量为0.70 mg/g3. 结果分析通过本次实验,我们成功测定了四种食品中的铁含量。
实验结果表明,分光光度法是一种快速、准确、简便的食品中铁含量测定方法。
在实验过程中,应注意以下几点:(1)样品处理过程中,应避免样品受热过度,以免影响测定结果。
(2)实验操作应规范,避免误差的产生。
(3)实验数据应准确记录,以便后续分析。
>才智/286 食品中铁含量测定方法的研究进展曹利慧衡水学院河北衡水053000摘要:铁元素是人体不可或缺的微量元素,如果缺少铁会引起贫血, 而过多则会导致急性中毒对人体造成很大的危害。
食品是人们摄取铁元素的最主要途径, 准确测定食品中铁含量对食品营养和质量有重要的意义。
本文综述了分光光度法、原子吸收光谱法、电感耦合等离子体发射光谱法、催化动力学光度法等测定食品中铁含量的方法。
关键词:铁;测定方法;食品铁是人体含量最多的必需微量元素,约占人体总重量的0. 006% 。
人类新陈代谢的每一个过程都离不开铁,它是人体血液交换、氧气输送、某些酶和许多氧化还原体系不可缺少的元素,缺铁可造成贫血并容易疲劳。
食品是人们摄取铁元素的最主要途径,准确测定控制食品中铁含量有助于人们进一步了解食品营养价值和食品质量控制的意义。
本文对食品中的铁含量测定方法进行了综述,主要有分光光度法、原子吸收光谱法、电感耦合等离子体发射光谱法、催化动力学光度法等。
1分光光度法分光光度法所需仪器价格低廉、操作简便、灵敏度高是目前测量应用最广泛的方法。
目前测定铁的显色剂很多,主要为二元配合物体系和三元配合物体系。
邻二氮菲是使用最为普遍的二元配合物体系,盐酸羟胺、抗坏血酸为此种测量方法中常用的还原剂。
何建英等利用此法测定赤豆、豌豆、绿豆、蚕豆、黑豆、黄豆、青豆、豇豆等豆类中的铁含量,将样品在电炉上炭灰化,再放入马弗炉中灼烧恒重、冷却加入盐酸,在pH2~9的溶液中与邻菲啰啉作用进行测定,此方法的检出限量为0.02µg/mL,线形范围为0.01-10-5g/L,相对标准偏差在5.2%以内,平均回收率在96%-106%之间。
陆木丽等[1]测定了桂西高寒山区新鲜瓜子菜、白花菜、香菜、咸菜、紫苏中铁的含量,野菜用浓硝酸和浓硫酸消解后,用NaOH溶液调pH在4-6之间进行测量。
磺基水杨酸是另一种常用的二元配合物测铁显色剂,焦琳娟, 伍丽丽采用此法测定了海带中的铁,在pH=2-3的溶液中,Fe3+与磺基水杨酸生成紫红色络合物。
食品中铁含量的测定食品安全检验技术(理化部分)食品中铁的测定有火焰原子吸收光谱法,二硫腙比色法(邻菲啰啉,磺基水杨酸,硫氰酸盐比色法等)两种国家标准方法.下面对原子吸收分光光度法,分光光度法(邻二氮菲法)进行详细阐述.(一)原子吸收分光光度法1,原理经湿法消化样品测定液后,导入原子吸收分光光度计,经火焰原子化后,吸收波长248.3nm的共振线,其吸收量与铁的含量成正比,与标准系列比较定量.2,主要试剂:(1)高氯酸-硝酸消化液:1+4(体积比)(2)0.5mol/LHNO3溶液(3)铁标准储备液:每毫升相当于1mg铁.(4)铁标准使用液:取10.0mL(3)液于100mL容量瓶中,加入0.5mol/L硝酸溶液,定容.3,主要仪器原子吸收分光光度计(铁空心阴极灯)4,操作方法:样品处理品系列标准溶液的配制仪器参考条件的选择标准曲线的绘制样品测定仪器参考条件的选择:波长248.3nm;光源为紫外;火焰:空气-乙炔;其它条件按仪器说明调至最佳状态. 5,结果计算:式中 X----样品的铁含量,mg/100g(或μg/100mL);ρ----测定用样品液中铁的浓度, μg/mL;ρ0----试剂空白液中铁的浓度,μg/mL;m----样品的质量或体积,g或mL;V----样品处理液总体积,mL; f----稀释倍数.6,说明(1)所用玻璃仪器均经硫酸-重铬酸钾洗液浸泡数小时,再以洗衣粉充分洗刷,其后用水反复冲洗,再用去离子水冲洗烘干.(2)本方法最低检出浓度为0.2μg/mL.(二),分光光度法(邻二氮菲法)1,原理:在pH为2~9的溶液中,二价铁离子与邻二氮菲生成稳定的橙红色配合物,在510nm有最大吸收,其吸光度与铁的含量成正比,故可比色测定.2,试剂①盐酸羟胺溶液:10%②邻二氮菲水溶液(新鲜配制):0.12%③醋酸钠溶液:10%④盐酸:1mol/L⑤铁标准溶液:3,测定方法:①样品处理:干法灰化②标准曲线绘制:吸取10g/mL铁标准溶液0.0mL,1.0mL,3.0mL,4.0mL,5.0mL,分别置于50mL容量瓶中,加入1mol/L盐酸溶液1mL,10%盐酸羟胺1mL,0.12%邻二氮菲1mL.然后加入10%醋酸钠5mL,用水稀释至刻度,摇匀,以不加铁的试剂空白溶液作参比液,在510nm波长处,用1比色皿测吸光度,绘制标准曲线.③样品测定:准确吸取样液5~10mL于50mL容量瓶中,以下按标准曲线绘制操作,测定吸光度,在标准曲线上查出相对应的含铁量(μg).(4)结果计算式中 m----样品质量,g ;V1----测定用样液体积,mLV2----样液总体积,mLX----从标准曲线上查得测定用样液相当的铁含量, μg.。
硫氰酸钾法测定食品中铁含量实验报告
1.了解硫氰酸钾法测定食品中铁含量的原理和方法;
2.学习使用硫氰酸钾法测定食品中铁含量的操作步骤;
3.掌握实验数据处理和结果分析的方法。
实验仪器和试剂:
1.橄榄油:样品;
2.硫氰酸钾:0.1mol/L的溶液;
3.硫酸:浓度为5mol/L;
4.铬酸钾:浓度为0.1mol/L;
5.硫酸亚铁:浓度为0.1mol/L;
6.枸橼酸盐缓冲液:缓冲液pH为2.6;
7.去离子水:即蒸馏水。
实验步骤:
1.将待测样品加入干净的玻璃试管中。
然后加入1.5ml的硫酸亚铁溶液和1.5ml 的硫酸溶液。
2.将样品溶液和一个标准样品一起加入到不同的玻璃试管中。
然后分别加入2.0ml的硫氰酸钾溶液和1.0ml的铬酸钾溶液。
将这些试管用去离子水补至液体的体积为10.0ml。
3.将这些试管振荡并放置15分钟,然后读取吸光度。
使用枸橼酸盐缓冲液pH 为2.6进行空白校准。
实验数据处理:
1.计算标准曲线的斜率和截距。
2.使用标准曲线计算样品中铁的浓度。
3.将样品的浓度转换为食品中的铁含量。
实验结果分析:
本实验测得的食品中铁含量为××××mg/100g,与理论值比较较为接近,说明实验方法的准确度比较高。
实验结果也可以用于参考改善食品的营养成分,使其更加健康。
测定食品中的铁一、案例黑木耳是滋味鲜美、养分丰盛的食用菌,含有丰盛的蛋白质、铁、钙、维生素、粗纤维,被养分学家誉为“素中之荤”和“素中之王”。
特殊是黑木耳的含铁量很高,比蔬菜中含铁量高的芹菜高20倍,比动物性食品中含铁量高的猪肝还高约7倍,为各种食品含铁之冠,是一种十分好的自然补血食品,每100g黑木耳中含铁98mg。
二、选用的国家标准 GB/T5009.90—2003食品中铁、镁、锰的测定——原子汲取光谱法。
三、测定办法 1.样品消化精确称取匀称样品干样0.5~1.5g于250mL高型烧杯中,加混合酸消化液20~30mL,上盖表面皿,置于电热板或电沙浴上加热消化,未消化彻底而酸液过少时,需补加混合酸消化液,继续加热消化,直至无色透亮为止,再加几毫升水,加热以除去多余的硝酸。
待烧杯中的液体临近2~3mL时,取下冷却。
将消化液用去离子水洗并转移至l0mL刻度试管中,加水定容。
2.试剂空白液的制备取与消化样品相同量的混合酸消化液,按上述操作作试剂空白试验溶液。
3.铁标准系列用法液的制备分离精确吸取0.50mL、1.0mL、2.0mL、3.0mL、4.0mL铁标准用法液,分离置于100mL容量瓶中.用0.5mol/L硝酸稀释至刻度,混匀,此标准系列用法液每毫升含铁量分离为0.5μg、1.0μg、2.0μg、3.0μg、4.0μg。
4.仪器条件波长248.3nm,灯电流、狭缝、空气乙炔流量及灯头高度均按仪器解释调至最佳状态。
5.测定①标准曲线的绘制:将不同浓度的铁标准系列用法液分离导入火焰原子化器举行测定,记录其对应的吸光度值,以标准溶液铁浓度为横坐标,对应的吸光度值为纵坐标,绘制标准曲线。
②将处理好的试剂空白液、样品溶液用法液分离导入火焰原子化器举行测定,记录其对应的吸光度值,与标准曲线比较定量。
6.试剂①混合酸消化液:硝酸+高氯酸=4+1。
②0.5mol/L硝酸溶液:量取32mL硝酸,加去离子水并稀释至1000mL。
食品中铁含量的测定
食品安全检验技术(理化部分)
食品中铁的测定有火焰原子吸收光谱法,二硫腙比色法(邻菲啰啉,磺基水杨酸,硫氰酸盐比色法等)两种国家标准方法.下面对原子吸收分光光度法,分光光度法(邻二氮菲法)进行详细阐述.
(一)原子吸收分光光度法
1,原理
经湿法消化样品测定液后,导入原子吸收分光光度计,经火焰原子化后,吸收波长248.3nm的共振线,其吸收量与铁的含量成正比,与标准系列比较定量.
2,主要试剂:
(1)高氯酸-硝酸消化液:1+4(体积比)
(2)0.5mol/LHNO3溶液
(3)铁标准储备液:每毫升相当于1mg铁.
(4)铁标准使用液:取10.0mL(3)液于100mL容量瓶中,加入0.5mol/L硝酸溶液,定容.
3,主要仪器原子吸收分光光度计(铁空心阴极灯)
4,操作方法:
样品处理品系列标准溶液的配制仪器参考条件的选择标准曲线的绘制样品测定
仪器参考条件的选择:波长248.3nm;光源为紫外;火焰:空气-乙炔;其它条件按仪器说明调至最佳状态. 5,结果计算:
式中 X----样品的铁含量,mg/100g(或μg/100mL);
ρ----测定用样品液中铁的浓度, μg/mL;
ρ0----试剂空白液中铁的浓度,μg/mL;
m----样品的质量或体积,g或mL;
V----样品处理液总体积,mL; f----稀释倍数.
6,说明
(1)所用玻璃仪器均经硫酸-重铬酸钾洗液浸泡数小时,再以洗衣粉充分洗刷,其后用水反复冲洗,再用去离子水冲洗烘干.
(2)本方法最低检出浓度为0.2μg/mL.
(二),分光光度法(邻二氮菲法)
1,原理:
在pH为2~9的溶液中,二价铁离子与邻二氮菲生成稳定的橙红色配合物,在510nm有最大吸收,其吸光度与铁的含量成正比,故可比色测定.
2,试剂
①盐酸羟胺溶液:10%
②邻二氮菲水溶液(新鲜配制):0.12%
③醋酸钠溶液:10%
④盐酸:1mol/L
⑤铁标准溶液:
3,测定方法:
①样品处理:干法灰化
②标准曲线绘制:吸取10g/mL铁标准溶液0.0mL,1.0mL,3.0mL,4.0mL,5.0mL,分别置于50mL容量瓶中,
加入1mol/L盐酸溶液1mL,10%盐酸羟胺1mL,0.12%邻二氮菲1mL.然后加入10%醋酸钠5mL,用水稀释至刻度,摇匀,以不加铁的试剂空白溶液作参比液,在510nm波长处,用1比色皿测吸光度,绘制标准曲线.
③样品测定:准确吸取样液5~10mL于50mL容量瓶中,以下按标准曲线绘制操作,测定吸光度,在标准曲线上查出相对应的含铁量(μg).
(4)结果计算
式中 m----样品质量,g ;
V1----测定用样液体积,mL
V2----样液总体积,mL
X----从标准曲线上查得测定用样液相当的铁含量, μg.。