第八章 酸碱平衡与酸碱滴定
- 格式:ppt
- 大小:2.15 MB
- 文档页数:48


酸碱滴定曲线与酸碱平衡曲线的关系探讨酸碱滴定曲线与酸碱平衡曲线在化学中都是非常重要的曲线。
它们之间存在关系,但也有一些区别。
酸碱滴定曲线是通过酸碱滴定实验得到的。
滴定实验是一种确定溶液中酸碱物质浓度的方法。
在滴定实验中,通常将一定浓度的酸(称为滴定试剂)滴加到含有一定浓度的碱(称为滴定物质)的溶液中,或将酸滴加到含有碱的溶液中,然后记录每次滴加酸的过程中溶液的pH值变化。
通过这些数据,我们可以得到酸滴加量与溶液pH值之间的关系,从而画出酸碱滴定曲线。
酸碱滴定曲线通常呈现出明显的特点,包括曲线起点、终点和中间区域的变化。
在曲线起点,滴定试剂的滴加量较小,溶液中酸性物质的浓度较高,所以溶液的pH值较低。
在曲线终点,滴定试剂的滴加量较大,溶液中碱性物质的浓度较高,所以溶液的pH值较高。
在曲线中间区域,滴定试剂的滴加量较适中,溶液中酸碱物质的浓度处于中间范围,所以溶液的pH值变化不大。
酸碱平衡曲线是通过测定溶液中酸性物质和碱性物质的浓度,然后计算得到的。
在酸碱平衡曲线中,我们可以根据酸碱反应的平衡常数以及物质的摩尔比,计算出溶液的pH值。
酸碱平衡曲线通常可以用来研究酸碱反应在不同条件下的平衡状况,例如温度、浓度等。
通过研究酸碱平衡曲线,我们可以了解到酸碱反应的热力学和动力学特性,为进一步研究溶液的酸碱行为提供参考。
酸碱滴定曲线和酸碱平衡曲线之间的关系在某些情况下可以相互印证。
当滴定试剂和滴定物质的化学方程式已知时,酸碱滴定曲线与酸碱平衡曲线可以通过相同的数据得到。
如果通过滴定实验知道了滴定试剂与滴定物质的化学方程式和物质的摩尔比,我们可以根据酸碱反应的平衡常数计算出溶液的pH值,然后画出酸碱平衡曲线。
反之亦然。
酸碱滴定曲线与酸碱平衡曲线都是研究溶液中酸碱行为的重要工具。
它们在一定程度上相互关联,但在实验方法和数据处理上有所不同。
通过研究酸碱滴定曲线和酸碱平衡曲线,我们可以更加全面地了解溶液中酸碱物质的性质,为化学实验和理论研究提供依据。

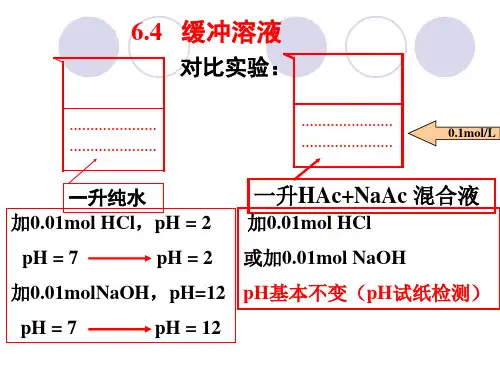
《酸碱平衡》习题答案1. 计算pH=5.00时,0.10mol·L -1的HAc 溶液中各型体的分布系数及平衡浓度。
解:()36.01076.11010][][500.500.5=×+=+=−−−++θδa r r K H H HAc ()()()1036.036.010.0−⋅=×=⋅=L mol HAc c HAc c r δ()()64.036.0111=−=−=−HAc Ac δδ()()()11064.064.010.0−−−⋅=×=⋅=L mol Ac c Ac c r δ2. 计算0.10mol·L -1的HCOONH 4溶液的pH 。
解:由于HCOO -和NH 4+分别为弱碱和弱酸,此溶液为两性溶液体系,其中:()()()5143441077.110/1077.1−−+−×==×=NH K K NHK HCOOH K b w a aθθθ所以,根据两性物质溶液体系pH 计算公式可得:()()500.6 1077.1101077.1lg lg 51444=×××−=−=−−−+NH K HCOOH K pH a aθθ* 两性物质溶液体系pH 计算公式中涉及到的两个平衡常数均是酸的解离常数。
* 根据有效数字修约规则,本题计算结果需要保留有效数字三位,也就是6.500。
3. 欲配置pH=5.00的缓冲溶液,现有0.1mol·L -1的HAc 溶液100mL ,应加0.1mol·L -1的NaOH 溶液多少毫升?解:设需要加0.1mol·L -1的NaOH 溶液x mL , 则根据缓冲溶液体系pH 计算公式可得:()()()()()()()()()00.5 101.0101001.0101.0lg1076.1lg lg lg ][][lg3335=××−××××+×−=−+=+=+=−−−−−−x x NaOH V NaOH c HAc V HAc c NaOH V NaOH c pK HA n A n pK HA A pK pH r r r a a rr a θθθ解方程得到:()()mL mL x 2106.064×≈=4. 取50mL0.10mol·L -1的某一元弱酸溶液,与20mL0.10mol·L -1的NaOH 溶液混合,稀释到100mL ,测得此溶液的pH=5.25,求此一元弱酸的θa K 。




酸碱滴定曲线与酸碱平衡曲线的关系探讨酸碱滴定曲线和酸碱平衡曲线是化学中不可或缺的两种曲线类型,它们都是描述酸碱反应的动态过程,但是它们从不同的角度出发,反映的问题不同,因此有着各自的特点和意义,本文将从酸碱滴定曲线和酸碱平衡曲线的概念、实验过程、形态特征和相关理论等几个方面探讨它们之间的关系。
一、概念酸碱滴定曲线指的是在酸碱滴定过程中,酸或碱的滴加量与溶液的酸碱度之间的关系所展现出的曲线,一般是以滴加量为横坐标,PH值为纵坐标。
它揭示了酸碱滴定过程中溶液酸碱度随着滴加量的变化规律,特别是在滴加到等当点附近时,PH值发生急剧变化的现象。
酸碱平衡曲线是指在一定温度和压强下,描述酸碱解离平衡过程中,酸、碱及其离子在各种浓度下浓度以及其对应的PH之间关系的曲线。
一般是以PH值为横坐标,酸或碱的离子浓度或者浓度比值为纵坐标。
它反映了在一定条件下,溶液中酸、碱及其离子浓度以及PH值之间的关系,由于酸碱平衡的存在,曲线中有明显的极值点。
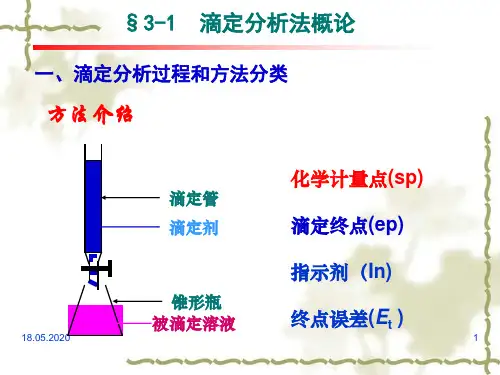
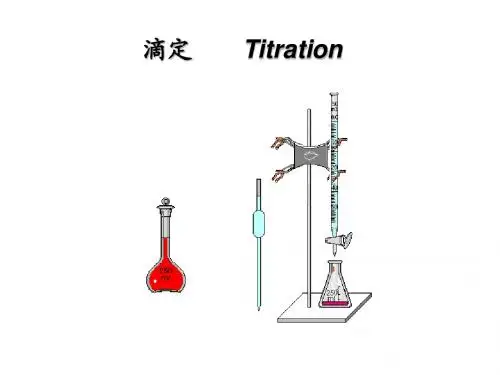
二、实验过程酸碱滴定实验是通过滴定管滴加酸或碱标准溶液到未知浓度酸或碱溶液中,并时时用PH计测定溶液的PH值,最终得到酸碱滴定曲线。
酸碱滴定常常用来测定酸、碱溶液的浓度,以及确定一些物质的酸碱性质。
酸碱平衡实验可通过在一定的条件下,即酸或碱水平、温度和浓度等条件恒定下,将不同浓度的酸或碱标溶液加入某种指示剂或直接使用PH计记录溶液的PH值,从而得到酸碱平衡曲线。
酸碱平衡实验可以反映出酸、碱及其离子或水合离子在各种浓度下所处的平衡位置,是通过测量PH值,借助酸碱计算公式得到酸、碱及其离子浓度比值,再由此得出平衡曲线。
滴定的原理是根据滴定化学反应的摩尔比的关系,已知反应物浓度以及需要达到的反应摩尔比,再测量另一物质的滴加量,从而推导出所需的另一物质的摩尔浓度。
三、形态特征酸碱滴定曲线通常表现出的特征是:曲线起点随PH值的变化而变化,呈现平稳的趋势;随着滴加剂量的增大,曲线逐渐变化,在等当点前,曲线缓慢上升或下降,到达等当点后PH值将呈现急剧变化的趋势,但变化程度较小;等当点后曲线就会开始变平缓,而且曲线对称性强。
思考题1. 根据酸碱质子理论,什么是酸?什么是碱?酸碱反应的实质是什么?【答】酸碱质子理论:凡能放出质子(氢离子)的分子或离子都是酸,凡能与质子(氢离子)结合的分子或离子都是碱。
酸碱反应的实质是质子转移反应。
2. 根据酸碱电子理论,什么是酸?什么是碱?酸碱反应的实质是什么?【答】酸碱的电子理论:凡是能给出电子对的分子、离子或原子团都叫做碱,也叫做路易斯碱;凡是能接受电子对的分子、离子或原子团都叫做酸,也叫做路易斯酸。
酸碱反应的实质是配位键的形成并生成酸碱配合物。
3. 说明下列名词的意义:(1) 酸碱共轭对;(2) 两性物质;(3) 溶剂的质子自递反应;(4) 拉平效应和区分效应;(5) 酸的强度和酸度;(6) 稀释定律;(7) 分析浓度和平衡浓度;(8) 分布系数;(9) 质子平衡条件;(10) 同离子效应和盐效应;(11) 化学计量点和滴定终点;(12) 酸碱滴定突跃范围。
【答】(1) 质子酸失去一个质子变为质子碱,质子碱得到一个质子转为酸。
因一个质子的得失而相互转变的每一对酸碱就称为共轭酸碱对(2) 有些酸碱物质,在不同的酸碱共轭酸碱对中,有时是质子酸,有时是质子碱,把这类物质称为酸碱的两性物质。
如:HPO42-、H2PO4-、HS-、H2O等。
(3) 仅仅在溶剂分子之间发生的质子传递作用称为溶剂的质子自递反应,反应的平衡常数称为溶剂的质子自递常数。
(4) 拉平效应:在某溶剂中,不能区分酸性强弱的现象。
区分效应:在某溶剂中,能区分酸性强弱的现象。
(5) 酸的强度:表示给出质子的能力。
酸度:表示溶液中[H+]浓度或[OH-]浓度的大小。
通常以pH 或pOH表示。
(6) 弱电解质的解离度是随着浓度的减小而增大,这一规律就称为稀释定律。
(7) 在酸(或碱)的解离反应式中,当共轭酸碱对处于平衡状态时,溶液中存在着多种酸碱组分,这些组分的浓度称为平衡浓度,以[ ]表示;各组分平衡浓度之和称为分析浓度(或总浓度),通常以c表示。