物理化学相平衡资料
- 格式:ppt
- 大小:3.40 MB
- 文档页数:8

物理化学相平衡知识点相平衡一、主要概念组分数,自由度,相图,相点,露点,泡点,共熔点,(连)结线,三相线,步冷(冷却)曲线,低共熔混合物(固相完全不互溶)二、重要定律与公式本章主要要求掌握相律的使用条件和应用,单组分和双组分系统的各类典型相图特征、绘制方法和应用,利用杠杆规则进行有关计算。
1、相律: F = C - P + n, 其中:C=S-R-R’(1) 强度因素T,p可变时n=2(2) 对单组分系统:C=1, F=3-P(3) 对双组分系统:C=2,F=4-P;应用于平面相图时恒温或恒压,F=3-P。
2、相图(1)相图:相态与T,p,x的关系图,通常将有关的相变点联结而成。
(2)实验方法:实验主要是测定系统的相变点。
常用如下四种方法得到。
12对于气液平衡系统,常用方法蒸气压法和沸点法;液固(凝聚)系统,通常用热分析法和溶解度法。
3、单组分系统的典型相图对于单组分系统C =1,F =C -P +2=3-P 。
当相数P =1时,自由度数F =2最大,即为双变量系统,通常绘制蒸气压-温度(p-T )相图,见下图。
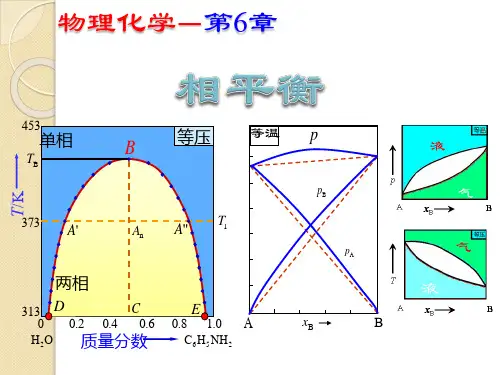
pTlBC AOsgC 'pTlBCA Os gFGD单斜硫pT液体硫BCAO正交硫硫蒸气(a) 正常相图 (b) 水的相图(c) 硫的相图图6-1 常见的单组分系统相图4、二组分系统的相图类型:恒压的t -x (y )和恒温的p -x (y )相图。
相态:气液相图和液-固(凝聚系统)相图。
(1)气液相图根据液态的互溶性分为完全互溶(细分为形3成理想混合物、最大正偏差和最大负偏差)、部分互溶(细分为有一低共溶点和有一转变温度的系统)和完全不溶(溶液完全分层)的相图。
可以作恒温下的p -x (压力-组成)图或恒压下的t -x (温度-组成)图,见图5-2和图5-3。
t = 常数液相线气相线g + llgB Apx B (y B )t = 常数g + l液相线气相线g + llgB Apx B (y B )g + lg + lt = 常数液相线气相线lgBApx B (y B )(a) 理想混合物 (b) 最大负偏差的混合物 (c) 最大正偏差的混合物 图6-2 二组分系统恒温下的典型气液p -x 相图p = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )p = 常数g + l液相线或泡点线气相线或露点线g + llg BAtx B (y B )g + lp = 常数液相线或泡点线气相线或露点线g + llgBAtx B (y B )(a) 理想或偏差不大的混合物 (b) 具有最高恒沸点(大负偏差) (c) 具有最低恒沸点(大正偏差)B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B最低会溶点B在A液层中的溶解度线A在B液层中的溶解度线最高会溶点l 1 + l 2p = 常数lBAtx B DCGFOgg + l g + ll 1 + l 2p = 常数lBAtx B (y B )(d) 有最高会溶点的部分互溶系统 (e)有最高和最低会溶点的部分互溶系统 (f) 沸点与会溶点分离4x B (y B )三相线COD ( l 1 +g + l 2)l 1DC GFOgg + lg + l l 1 + l 2p = 常数l 2B Atx B (y B )三相线COD ( g + l 1 + l 2)g + l 1l 1DC GFOgg + l 2l 1 + l 2p = 常数l 2BAtg + B(l )三相线COD [ A(l ) +g + B(l ) ]DCGFOgg + A(l )A(l ) + B( l )p = 常数BAtx B (y B )(g) 液相部分互溶的典型系统 (h)液相有转沸点的部分互溶系统 (i) 液相完全不互溶的系统图6-3 二组分系统恒压下的典型气液相图(2)液-固系统相图: 通常忽略压力的影响而只考虑t -x 图。







物化相平衡知识点总结一、相变的基本概念1. 相和相变相是物质的几何结构和微观结构的基本要素,包括固态、液态和气态。
当物质处于不同的相之间,会发生相变。
相变是指物质由一种相转化为另一种相的过程,包括凝固、融化、升华、凝聚等。
2. 相变的热力学描述相变是伴随着热量的吸收或释放的过程。
在相变过程中,物质的内能不发生改变,热量的吸收或释放表现为相变潜热。
相变的热力学描述可以用热力学参数如热力学势函数、熵等来描述。
3. 相变的动力学过程相变是一个动力学过程,通过固液相变作为例子,可以用凝固和融化作为相变的动态过程的例子来描述。
凝固是液体转变为固体的过程,而融化则是固体转变为液体的过程。
这些过程受到温度、压力和物质的性质等因素的影响。
二、相变的平衡条件与方向1. 平衡条件相变达到平衡时,涉及的热力学参数如化学势、温度、压力等达到平衡状态。
在等温等压条件下,固液平衡和液气平衡时的热力学条件可以用相图来描述。
2. 方向性相变的方向性取决于温度、压力等条件,以及物质的性质。
通过熔点和沸点来描述相变的方向性,其中熔点是固液相变的温度,而沸点则是液气相变的温度。
三、气液平衡及其相关知识1. 气液平衡的热力学描述气液平衡是指气体和液体达到平衡状态的过程。
这种平衡状态受温度和压力等条件的影响,可以用物理化学参数如亨利定律、拉瓦定律等来描述。
2. 气液平衡条件气液平衡的条件包括温度、压力以及物质的性质,控制这些条件可以改变气液平衡达到的状态。
3. 蒸馏和凝结蒸馏是利用液体和气体的不同沸点来实现分离的过程,而凝结则是将气体转变为液体的过程。
这些过程都是气液平衡的重要应用。
四、物化相平衡的应用1. 材料应用物化相平衡在材料科学领域有着重要应用,例如金属材料的固溶体和析出相平衡、陶瓷材料的烧结过程等,这些过程都是利用相变达到平衡状态的过程。
2. 化学反应在化学反应中,物质的相变也是一个重要的过程,例如气体的吸收和析出等。
控制相变的过程可以影响化学反应的进行。