溶液的酸碱性与pH值
- 格式:docx
- 大小:37.51 KB
- 文档页数:3

溶液的酸碱性及pH值溶液的酸碱性及pH值是化学中重要的概念,它们与我们日常生活中的许多方面息息相关。
本文将详细介绍溶液的酸碱性及pH值的定义、测量方法、影响因素以及实际应用等内容,以便更好地了解这一重要概念。
一、酸碱性的定义和基本概念在化学中,酸和碱是指具有特定化学性质的物质,它们的性质和行为具有明显的差异。
酸通常呈酸性,而碱通常呈碱性。
溶液的酸碱性主要取决于其中所含酸和碱的性质及相对浓度。
溶液的酸碱性可以通过pH值来表示。
pH值是一个无量纲指标,用于表示溶液的酸碱程度。
pH值的范围是0至14,其中7表示中性,小于7的值表示酸性,大于7的值表示碱性。
pH值的计算公式为:pH =-log[H+],其中[H+]为溶液中氢离子的浓度,单位为摩尔/升。
二、测量pH值的方法测量溶液的pH值是化学实验中十分常见的操作。
目前常用的测量pH值的方法有两种:酸碱指示剂法和pH计法。
1. 酸碱指示剂法:酸碱指示剂是一种能够根据溶液pH值变化而改变颜色的物质。
常见的酸碱指示剂有酚酞、溴酚蓝和甲基橙等。
通过观察溶液颜色的变化,可以大致推测出溶液的酸碱性。
2. pH计法:pH计是一种能够直接测量溶液pH值的电子仪器。
pH 计原理利用了电极与溶液中氢离子之间的相互作用关系。
通过将电极放入溶液中,pH计可以快速、准确地显示溶液的pH值。
三、影响溶液酸碱性的因素溶液的酸碱性受到多种因素的影响,下面将介绍最常见和重要的几个因素。
1. 酸碱物质的性质:具有酸性质的物质,在水中解离时会释放出氢离子(H+),从而使溶液呈酸性。
相反,具有碱性质的物质在水中释放氢氧根离子(OH-),从而使溶液呈碱性。
酸和碱之间的相对浓度也会影响溶液的酸碱性。
2. 温度:温度对溶液的酸碱性有一定的影响。
一般来说,在高温下溶液的酸性会增强,而在低温下溶液的碱性会增强。
3. 溶液的离子浓度:溶液中的离子浓度越高,酸碱性的表现也会相应增强。
离子浓度的改变可以通过溶解度、电解和化学反应等过程实现。

溶液的酸碱性与pH值溶液的酸碱性是指溶液中酸性物质和碱性物质的相对浓度。
酸碱性的强弱可以通过pH值来表示。
pH值是一个表示溶液酸碱性强弱的指标,其数值范围从0到14。
pH值小于7的溶液称为酸性溶液,pH值大于7的溶液称为碱性溶液,pH值等于7的溶液称为中性溶液。
溶液的酸碱性与其中溶解的酸性物质和碱性物质的特性和浓度有关。
在溶液中,酸质子(H+)和碱质子(OH-)是起主要作用的离子。
酸性溶液中质子的浓度高于水,而碱性溶液中质子的浓度低于水。
而中性溶液中酸性物质和碱性物质的浓度相等,质子的浓度与水相等。
酸性溶液的pH值通常小于7,其原因是酸性物质可以释放出质子(H+)离子,增加溶液中质子的浓度。
酸性物质中常见的有硫酸、盐酸、硝酸等。
这些物质会与水分子发生反应,将水分子中的一个氢原子取代,形成H+离子。
碱性溶液的pH值通常大于7,其原因是碱性物质可以释放出氢氧根离子(OH-)或接受质子。
碱性物质中常见的有氢氧化钠、氢氧化钾、氢氧化铵等。
这些物质在水中形成氢氧根离子和金属离子,氢氧根离子会与溶剂中的质子结合,减少溶液中质子的浓度。
酸性和碱性溶液之间可以相互中和。
当酸性溶液和碱性溶液混合时,质子和氢氧根离子会相互结合,生成水分子。
在这个反应过程中,溶液的酸碱性随着质子和氢氧根离子的浓度变化而改变。
pH值的改变取决于酸性和碱性物质的浓度和反应的平衡。
pH值的测量通常使用酸碱指示剂、pH计或电极进行。
酸碱指示剂是一种化学物质,可以通过改变其颜色来指示溶液的酸碱性。
pH计和电极则通过测量溶液中电离质子的浓度来确定pH值。
总之,溶液的酸碱性与其中溶解的酸性物质和碱性物质的浓度有关。
pH值是一种表示溶液酸碱性强弱的指标,其范围从0到14。
酸性溶液的pH值通常小于7,碱性溶液的pH值通常大于7,中性溶液的pH值为7。
通过使用酸碱指示剂、pH计或电极,可以准确测量溶液的pH值,以判断其酸碱性。

溶液的酸碱性与pH值简介:溶液的酸碱性是指溶液中所含酸性物质和碱性物质的相对含量及其对水溶液的影响程度。
而pH值则是用来表示溶液酸碱性强弱的指标。
本文将探讨溶液的酸碱性是如何与pH值相关联的。
1. 酸性溶液酸性溶液含有过量的酸性物质,它们以游离的H+离子存在于溶液中。
酸性物质会释放出H+离子,然后与水分子中的OH-离子结合形成水分子。
在酸性溶液中,pH值低于7。
酸性物质可以是无机酸,如硫酸、盐酸,或有机酸,如柠檬酸、醋酸。
2. 碱性溶液碱性溶液则相反,它们含有过量的碱性物质,以游离的OH-离子存在于溶液中。
碱性物质会释放出OH-离子,然后与水分子中的H+离子结合形成水分子。
在碱性溶液中,pH值高于7。
碱性物质主要指无机碱,如氢氧化钠、氢氧化钙,或有机碱,如胺类物质。
3. 中性溶液中性溶液中,酸性物质和碱性物质的相对含量相等,游离的H+离子和OH-离子的浓度相互抵消,导致pH值等于7。
其中,最常见的中性溶液是纯水。
纯水在25摄氏度下,它自己的离子生成的浓度是10的负7次方,所以它的pH值是7。
4. pH值的计算pH值是用来表示溶液酸碱性强弱的无量纲指标。
它的计算公式为pH = -log[H+],其中[H+]为溶液中H+离子的浓度。
若已知溶液中H+离子的浓度,则可以通过计算-log[H+]来得到溶液的pH值。
例如溶液中H+离子浓度为0.001mol/L,则-pH = -log(0.001) = 3,所以该溶液的pH值为3。
5. pH值的重要性pH值对生物体和环境起着重要的影响。
人体内部的许多生化反应都对酸碱度非常敏感,特定的生理功能只在适宜的pH值下才能正常进行。
许多生物体的内部环境都是弱碱性的,维持在适宜的pH范围内有助于细胞的正常运作。
此外,环境中的水体、土壤等的pH值也对其中的微生物生态和植物生长产生重要影响。
总结:溶液的酸碱性与pH值是密切相关的。
酸性溶液含有过量的H+离子,pH值低于7;碱性溶液含有过量的OH-离子,pH值高于7;中性溶液中H+离子和OH-离子的浓度相等,pH值为7。
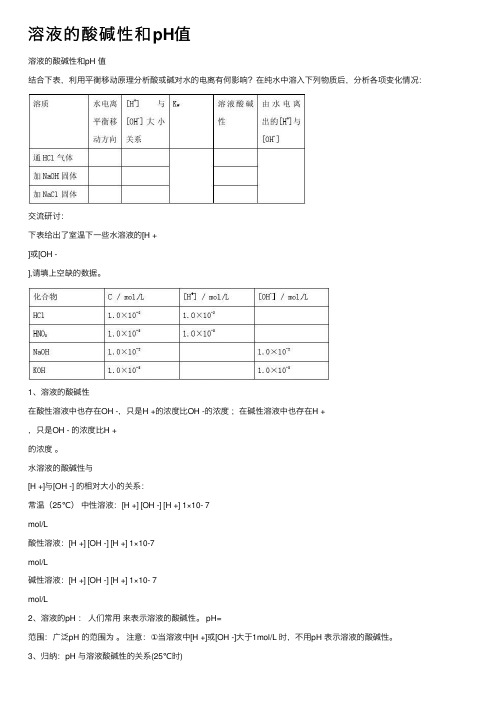
溶液的酸碱性和pH值溶液的酸碱性和pH 值结合下表,利⽤平衡移动原理分析酸或碱对⽔的电离有何影响?在纯⽔中溶⼊下列物质后,分析各项变化情况:交流研讨:下表给出了室温下⼀些⽔溶液的[H +]或[OH -],请填上空缺的数据。
1、溶液的酸碱性在酸性溶液中也存在OH -,只是H +的浓度⽐OH -的浓度;在碱性溶液中也存在H +,只是OH - 的浓度⽐H +的浓度。
⽔溶液的酸碱性与[H +]与[OH -] 的相对⼤⼩的关系:常温(25℃)中性溶液:[H +] [OH -] [H +] 1×10- 7mol/L酸性溶液:[H +] [OH -] [H +] 1×10-7mol/L碱性溶液:[H +] [OH -] [H +] 1×10- 7mol/L2、溶液的pH :⼈们常⽤来表⽰溶液的酸碱性。
pH=范围:⼴泛pH 的范围为。
注意:①当溶液中[H +]或[OH -]⼤于1mol/L 时,不⽤pH 表⽰溶液的酸碱性。
3、归纳:pH 与溶液酸碱性的关系(25℃时)4、溶液pH 的测定⽅法(1)酸碱指⽰剂法说明:常⽤的酸碱指⽰剂有⽯蕊、甲基橙、酚酞试液。
常⽤酸碱指⽰剂的pH变⾊范围(2)pH试纸法使⽤⽅法:(3)pH计法(了解)5、有关pH的简单计算例1、分别求0.05mol/LH2SO4溶液和0.05mol/L Ba(OH)2溶液的PH值。
例2、求PH=2的H2SO4溶液中H2SO4的浓度;求PH=10的NaOH溶液中NaOH的浓度。
[巩固练习]1、pH=2的强酸溶液,加⽔稀释,若溶液体积扩⼤10倍,则C(H+)或C(OH-)的变化()A、C(H+)和C(OH-)都减少B、C(H+)增⼤C、C(OH-)增⼤D、C(H+)减⼩2、向纯⽔中加⼊少量的KHSO4固体(温度不变),则溶液的()A、pH值升⾼B、C(H+)和C(OH-)的乘积增⼤C、酸性增强D、OH-离⼦浓度减⼩3、100℃时,Kw=1×10-12mol-2?L-2,对纯⽔的叙述正确的是()A、pH=6显弱酸性B、C(H+)=10-6mol/L,溶液为中性C、Kw是常温时的10-2倍D、温度不变冲稀10倍pH=74、在pH=1的硫酸溶液中,由⽔电离出来的H+浓度为()A 、0 B、0.1 mol.L-1 C、10-7 mol.L-1 D、10-13 mol.L-15、将pH=5的盐酸溶液稀释1000倍后,溶液的pH为()A、等于8B、等于7C、接近7⼜⼩于7D、⼤于7⽽⼩于86、将纯⽔加热⾄较⾼的温度,下列叙述正确的是()A、⽔的离⼦积变⼤、pH变⼤、呈酸性B、⽔的离⼦积不变、pH不变、呈中性C、⽔的离⼦积变⼩、pH变⼤、呈碱性D、⽔的离⼦积变⼤、pH变⼩、呈中性7、给蒸馏⽔中滴⼊少量盐酸后,下列说法中错误的是()A、[H+ ][OH- ]乘积不变B、pH增⼤了C、[OH- ]降低了D、⽔电离出的[H+ ]增加了8、常温下,下列溶液中酸性最弱的是()A、pH=4B、[H+ ]=1×10-3mol·L-1C、[OH- ]=1×10-11mol·L-1D、[H+] ·[OH- ]= 1×10-14 mol-2?L-29、下列试纸使⽤时, 不宜先⽤⽔润湿的是()。


溶液的酸碱性与pH值溶液的酸碱性与pH值是化学领域中重要的概念。
酸碱性是指溶液中酸性物质或碱性物质的含量及其对水解离程度的影响,而pH值则是衡量溶液酸碱性的指标。
本文将就溶液的酸碱性形成机理、pH值的定义以及不同pH值对生活和环境的影响等方面进行论述。
一、酸碱性的形成机理在溶液中,酸和碱的形成主要是由物质的化学性质决定的。
酸性物质往往能够释放出氢离子(H+),而碱性物质则会释放出氢氧根离子(OH-)。
当酸性物质和碱性物质混合时,氢离子和氢氧根离子会发生中和反应,生成水。
这就是酸碱反应的基本机制。
二、pH值的定义pH值是酸碱溶液酸碱性强弱程度的度量指标,其定义为溶液中氢离子的浓度的负对数。
pH值的范围通常从0到14,其中7表示中性。
小于7的pH值表示酸性溶液,大于7的pH值表示碱性溶液。
三、pH值的影响不同pH值的溶液对生活和环境有着重要的影响。
具体影响如下:1. 生活中的应用:- 食品酸碱性的控制:食品工业中,pH值的控制对维持食品的质量和安全至关重要。
酸碱调节剂被广泛使用,以使食物呈现出理想的pH值,从而达到保鲜、抑菌和改善味道的效果。
- 药物的渗透性:药物在人体中的吸收和释放受到pH值的影响。
在胃酸性环境中,一些药物可以更好地被吸收,而在碱性环境中,其他药物则更容易被释放。
2. 生物体内的影响:- 酶的活性:酶对pH值非常敏感,不同酶对于最适宜的pH值有不同的要求。
如果pH值不适合,酶的活性就会下降,影响生物体内的新陈代谢过程。
- 细胞功能:细胞内外的pH值差异对维持正常的细胞功能至关重要。
细胞膜上的离子通道和跨膜转运蛋白对于细胞内外pH值的平衡起着重要的作用。
3. 环境影响:- 水体生态系统:水体中的pH值对于水生生物的生存和繁衍至关重要。
当水体的pH值偏离理想范围时,会导致鱼类和其他水生生物的死亡,破坏整个水生生态系统的平衡。
- 土壤酸碱性:不同的植物对土壤的pH值要求不同。
土壤的酸碱性能直接影响植物的生长和发育,如果土壤过于酸性或碱性,会导致植物不能正常吸收养分。
溶液的酸碱性与pH值的计算溶液的酸碱性与pH值的计算是化学研究中常见的问题。
pH值是一种表示溶液酸碱性强弱的指标,通过pH值的计算可以了解溶液的酸碱性质。
本文将介绍pH值的计算方法以及与酸碱性相关的概念。
1. pH值的定义与计算方法pH值是溶液酸性或碱性强弱的量度,其定义为负对数关系,即pH = -log[H+],其中[H+]表示溶液中的氢离子浓度。
pH值的取值范围为0-14,pH<7表示酸性溶液,pH>7表示碱性溶液,pH=7表示中性溶液。
pH值可以通过数学运算和化学指示剂的颜色变化来计算或测定。
1.1. pH值的数学计算方法pH值的数学计算方法首先需要通过溶液中的氢离子浓度来计算。
以溶液的H+浓度为0.001mol/L为例,计算其pH值的步骤如下:Step 1: 求负对数pH = -log[H+] = -log(0.001) = 3因此,溶液的pH值为3。
1.2. pH值的化学指示剂法化学指示剂法通过溶液的颜色变化来判断其酸碱性质。
常用的指示剂有酚酞、溴酚蓝和甲基红等。
不同指示剂在不同酸碱条件下都有各自独特的颜色表现。
以酚酞为例,其在酸性溶液中呈现红色,而在碱性溶液中呈现黄色。
通过观察溶液的颜色变化,可以初步判断其酸碱性质。
2. 溶液酸碱性的影响因素溶液的酸碱性不仅与pH值有关,还受到其他因素的影响。
以下是一些影响溶液酸碱性的因素:2.1. 强酸与强碱的酸碱性强酸和强碱的酸碱性较强,其pH值分别接近于0和14。
例如,盐酸是一种强酸,其pH值约为0;氢氧化钠是一种强碱,其pH值约为14。
2.2. 酸碱离子的浓度溶液中酸碱离子的浓度越高,其酸碱性越强。
溶液中酸离子浓度高于碱离子浓度时,溶液呈酸性;反之,溶液呈碱性。
2.3. 反应速率溶液中酸碱反应的速率也会影响溶液的酸碱性质。
一些反应速率较快的酸碱反应会导致溶液的酸碱性变化较快。
3. pH值的应用pH值在生活和工业中有广泛的应用。
以下是一些常见的应用领域:3.1. 饮用水检测pH值常用于饮用水的检测,以判断其是否酸性或碱性。
水溶液的酸碱性与pH值水溶液的酸碱性是指溶液中酸碱物质的浓度和性质所致。
酸碱性的浓度和性质可以通过pH值来表示。
本文将探讨水溶液的酸碱性和pH值之间的关系,以及pH值在日常生活中的应用。
一、酸碱性的定义和测定酸碱性是指溶液中氢离子(H+)和氢氧根离子(OH-)的浓度,溶液中存在较多H+离子则为酸性,存在较多OH-离子则为碱性。
酸碱性可以通过pH值来进行测定。
pH值是指溶液中H+离子浓度的负对数值,公式为:pH = -log[H+]。
pH值的范围从0到14,7为中性。
当pH值小于7时,溶液呈酸性;当pH值大于7时,溶液呈碱性。
pH值的具体数值越小,溶液越酸性;数值越大,溶液越碱性。
二、酸碱指示剂的应用酸碱指示剂是一种可以通过颜色变化来判断溶液酸碱性的化学物质。
常用的酸碱指示剂有酚酞、甲基橙、溴蓝等。
这些指示剂在不同pH值下会显示不同的颜色。
例如,酚酞指示剂在酸性溶液中呈现红色,在碱性溶液中呈现黄色。
我们可以利用这种颜色变化来判断溶液的酸碱性。
三、水溶液的酸碱性对环境和生物的影响水溶液的酸碱性对环境和生物都有一定的影响。
在工业生产中,一些废水或废气会产生酸性物质,如果排放到自然环境中会对土壤、水源和生态系统造成严重的污染。
另外,在生物体内也存在一些对酸碱度敏感的生物酶和催化剂。
一些酶只能在特定的pH条件下发挥作用,偏离其适宜的pH范围会导致酶的活性下降甚至失活。
因此,维持生物体内恒定的酸碱平衡对于生物体的正常功能至关重要。
四、调节水溶液的酸碱性为了维持水溶液的酸碱平衡,我们可以通过一些方法来调节溶液的酸碱性。
一种常用的方法是添加酸碱缓冲剂。
酸碱缓冲剂是一种能够抵抗溶液pH值变化的物质。
它们能够吸收或释放H+离子,阻止pH值的剧烈变化。
常见的酸碱缓冲剂有碳酸氢盐和磷酸盐等。
另外,我们也可以通过稀释、溶液的配制和反应条件的调整来改变溶液的酸碱性。
五、pH值在日常生活中的应用pH值在日常生活中有许多应用。
初中化学知识点归纳溶液的酸碱性与pH值在初中化学学习中,溶液的酸碱性与pH值是一个重要的内容。
了解溶液的酸碱性以及pH值的概念和计算方法,对于理解和掌握酸碱反应、中和反应以及一些常见物质的性质具有重要意义。
一、溶液的酸碱性的定义酸碱性是指溶液中氢离子(H+)和氢氧根离子(OH-)的浓度与平衡溶液浓度的比值。
根据溶液中的氢离子和氢氧根离子浓度,可以将溶液分为酸性溶液、中性溶液和碱性溶液。
1. 酸性溶液:溶液中氢离子浓度大于氢氧根离子浓度的溶液称为酸性溶液。
例如,盐酸溶液中H+离子浓度高于OH-离子浓度,因此为酸性溶液。
2. 中性溶液:溶液中氢离子和氢氧根离子浓度相等的溶液称为中性溶液。
例如,纯水溶液中H+和OH-离子的浓度都非常低,相等于平衡常数的值,因此为中性溶液。
3. 碱性溶液:溶液中氢离子浓度小于氢氧根离子浓度的溶液称为碱性溶液。
例如,氨水溶液中NH4+离子浓度较大,因此为碱性溶液。
二、pH值的概念和计算方法pH值是用于表示溶液的酸碱性强弱的指标,是对溶液中H+离子浓度的负对数。
通过pH值,可以直观地了解溶液的酸碱性。
pH值的计算方法如下:pH = -log[H+]其中[H+]表示溶液中的氢离子浓度。
根据pH值的大小,可以将溶液分为以下几类:1. pH<7的溶液为酸性溶液,pH越小表示酸性越强。
2. pH=7的溶液为中性溶液,表示溶液中酸性和碱性均相等。
3. pH>7的溶液为碱性溶液,pH越大表示碱性越强。
三、影响溶液酸碱性的因素1. 溶液中酸性物质和碱性物质的浓度:当溶液中酸性物质浓度较高,或碱性物质浓度较高时,溶液的酸碱性也相应增强。
2. 物质的化学性质:不同物质的化学性质决定了其在水溶液中的行为。
例如,酸性物质可以释放出H+离子,而碱性物质则可以释放出OH-离子。
3. 溶解度:溶液中各种物质的溶解度也会对酸碱性产生影响。
溶解度较高的物质往往会增强溶液的酸碱性。
四、常见物质的酸碱性与pH值1. 酸性物质:如盐酸、硫酸、醋酸等,其水溶液的pH值一般小于7。
溶液的酸碱性与pH值
溶液的酸碱性是指溶液中酸碱物质所占比例的多少,而pH值是衡量溶液酸碱性的指标。
在化学实验、生物学研究和日常生活中,了解溶液的酸碱性以及pH值的变化对我们有着重要意义。
1. pH值的定义和计算
pH值是一种用于表示溶液酸碱程度的无量纲指标,其定义为负对数下10的氢离子(H+)浓度的活度。
pH值的计算公式为:pH = -
log[H+]。
在纯水中,H+离子的浓度极小,约为10-7摩尔每升,因此pH值为7。
当溶液的pH小于7时,表示溶液为酸性溶液;当pH大于7时,表示溶液为碱性溶液。
2. 酸性溶液与碱性溶液
酸性溶液指的是含有较多H+离子的溶液。
酸性溶液中的氢离子会与水分子中的氧离子(OH-)结合,生成水分子(H2O)。
典型的酸性溶液有盐酸溶液和硫酸溶液。
碱性溶液则是指含有较多OH-离子的溶液。
碱性溶液中的氢离子会与氢氧根离子结合,生成水分子。
典型的碱性溶液有氢氧化钠溶液和氢氧化钙溶液。
3. pH值的影响因素
溶液的酸碱性和pH值受多种因素的影响。
(1) 酸碱物质的浓度:溶液中酸碱物质的浓度越高,其酸碱性也越强,因此pH值会相应下降或上升。
(2) 酸碱物质的强度:强酸和强碱的溶液具有较高或较低的pH值,而弱酸和弱碱的溶液则具有较接近中性的pH值。
(3) 温度:溶液的温度升高或降低都会对其pH值产生影响。
温度升高会导致少数酸性物质解离产生更多的H+离子,从而降低pH值;而温度降低则会减少H+离子的生成,使pH值升高。
4. 测定溶液的pH值
测定溶液的pH值是一个常见的实验操作。
常用的测定方法包括:
(1) 酸碱指示剂:酸碱指示剂可以根据其与溶液的颜色变化来判断溶液的酸碱性。
例如,酸性溶液中溴酚蓝指示剂呈黄色,而碱性溶液中呈蓝色。
(2) pH试纸:pH试纸是另一种常用的溶液酸碱性测定方法,它可以根据试纸颜色的变化来判断溶液的pH值范围。
(3) pH计:pH计是一种准确测定溶液pH值的仪器。
它使用玻璃电极来测量溶液中的氢离子浓度,并将其转换为pH值。
5. 溶液酸碱性的应用
溶液的酸碱性与pH值在许多领域有着广泛的应用。
(1) 化学实验:在化学实验中,了解溶液的酸碱性和pH值可以帮助
我们判断反应的进行和产物的生成。
例如,当盐酸与氢氧化钠反应时,生成氯化钠和水,而且反应的产物中不再具有酸性或碱性。
(2) 生物学研究:细胞内外溶液的酸碱性对细胞的正常功能和生理
过程至关重要。
pH值的变化可能影响酶的活性、细胞膜的通透性以及
蛋白质的结构和功能。
因此,研究细胞和生物体系中溶液的酸碱性与
pH值对我们理解生命过程具有重要意义。
(3) 饮食与健康:食物和饮品的酸碱性与pH值对于健康饮食也是重
要的考虑因素。
平衡酸碱性的摄入可以维持身体的正常代谢功能,预
防或改善一些健康问题。
综上所述,我们对溶液的酸碱性与pH值的了解,有助于我们理解
化学反应、生物过程以及饮食与健康的关系。
通过合适的测定方法,
我们可以准确地确定溶液的pH值,并在实际应用中获得更多的信息与
启示。