元素周期律3.1
- 格式:doc
- 大小:2.64 MB
- 文档页数:6

化学元素周期律化学元素周期律,又称为元素周期表,是化学的重要理论之一。
它是1869年由威尔士化学家古斯塔夫·霍普曼伯格提出的,是经过大量实验实践所总结出的一门关于化学元素性质的理论。
元素周期律认为,元素的原子的性质随着原子序数的增加而周期性变化。
这一理论表明,要想正确分析元素的性质,需要研究各元素在不同周期中的性质,以及它们之间的关系。
元素周期律把按照原子序数分类的化学元素排列在一个表中,称为周期律表。
元素周期表把所有元素按照相似性质划分为18条周期,从1到18,以及7组,从A到G。
根据周期表所示,元素性质从第一周期的氢(H)开始,一步步进入到第18周期的氩(Ar),随着周期的变化而发生变化,周期变化的规律被称为元素周期律。
周期律表规定了元素连续变化的规律,即一个周期内,元素按照原子序数逐渐增加,原子质量也逐渐增加,元素的性质从左边轱辘式变化到右边,例如,从第一周期的H、Li、Na、K、Rb到第二周期的Ca、Sr、Ba等。
从而形成各种元素的性质发生周期性变化的规律。
元素周期律表明,元素的原子性质是“周期性”的,即元素的性质随着原子序数的增加而发生相似的变化。
举例来说,第一周期的H、Li、Na、K、Rb,都是无色易溶质液,第三周期的Al、Si、P、S、Cl,都是无色固体,可以把它们都一起分为一组。
每一组之间,虽然元素的性质有所不同,但整体上也可以看到周期性变化。
从元素周期律可以看出,元素的性质与原子序数之间存在着一定的联系,可以通过这种联系来分析物质的组成和性质,进而推测出一种物质的化学反应等。
元素周期律也是元素周期表的基础,它提供了一个全新的、系统的概念以及有助于我们了解物质的重要理论基础。

课时25元素周期表元素周期律知识点一元素周期表【考必备•清单】1.原子序数根据元素在周期表中的顺序给元素所编的序号原子序数=核电荷数=质子数=核外电子数.2.元素周期表的编排原那么3.元素周期表的结构〔1〕结构图示〔2〕周期与族①周期〔7个横行,7个周期〕②族〔18个纵行,16个族〕主族列1 2 13 14 15 16 17 族 □A □A □ A □A □A □A □A 副族列3 4 5 6 7 11 12 族□ B□ B□ B□ B□ B□ B□ B口族第8、9、10,共3个纵行0族第18纵行[名师点拨]①口人族元素不等同于碱金属元素,H 元素不属于碱金属元素;②元素周期表第18列是0族,不是nA 族,第8、9、10三列是□族,不是^B 族.4 .元素周期表中的特殊位置 (1)分区1厂1『 非金属元典 AJ • 11.G P !__蝮一, 金属五点 瓦:•裳। Po ! At , 金.属性逐渐增强 ①分界线:沿着元素周期表中铝、锗、锑、钋与硼、硅、砷、碲、砹的交界处画一条虚 线,即为金属元素区和非金属元素区的分界线.②各区位置:分界线左下方为金属元素区,分界线右上方为韭金属元素区. ③分界线附近元素的性质:既表现金属元素的性质,又表现非金属元素的性质. (2)过渡元素:元素周期表中从卫族到卫族10个纵行共六十多种元素,这些元素都是 金属元素.(3)镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素. (4)钢系:元素周期表第七周期中,89号元素钢到103号元素镑共15种元素. (5)超铀元素:在钢系元素中,92号元素铀(U)以后的各种元素.【夯根底・小题】1 .判断正误(正确的打y",错误的打“x金周性尊渐增强桶有气体元素非金底性逐渐增演非金属性逐淅增强(i)元素周期表是按元素的相对原子质量由小到大排列而形成的()(2)三、四周期同主族元素的原子序数相差8()(3)同周期nA族和nA族的原子序数相差1、11或25()(4)元素周期表中镧系元素和钢系元素都占据同一格,它们是同位素()(5)元素周期表中位于金属与非金属分界线附近的元素属于过渡元素()(6)原子的最外层有2个电子的元素一定是nA族元素()(7)元素所在的主族序数与最外层电子数相等的元素都是金属元素()答案:(1)x (2)x (3)7 (4)x (5)x (6)x (7)x2.如图A、B、C、D、E是长式元素周期表中的5种元素(不包括镧系和钢系).以下说法不正确的选项是()A.A、E原子序数之差可能为2.、B.D、E原子序数之差可能是8、18或32〞「C.B、C原子序数之差一定是2D.B、D原子序数之差不可能是7解析:选A由题给5种元素的位置关系可以看出,A不是第一周期元素,由于A假设为氢元素,那么其位于最左边一族,就不会有8 ;A假设为氮元素,那么其位于最右边一族,那么不会有C.既然A不是氢元素或氮元素,那么A、E原子序数之差不可能为2, A错误;由表中位置关系可知,D、E原子序数之差可能是8、18或32, B正确;B、C之间仅隔有E 一种元素,故原子序数之差一定为2,C正确;B、D原子序数之差应大于8,D正确.3.国际理论与应用化学联合会已正式确定了第114号和第116号元素的名称缩写为Fl、Lv.以下有关这两种元素的说法错误的选项是()A.两种元素位于同一周期B. 116号元素位于第nA族C.两种元素都是活泼的非金属元素D. 114号元素的原子半径比116号元素的大解析:选C第114号元素和第116号元素分别处于第七周期nA族和nA族,均为金属元素,A、B正确;C错误;依据同周期原子半径递变规律判断114号元素的原子半径比116号元素的半径大,D正确.[方法技巧]利用稀有气体元素确定主族元素在周期表中的位置原子序数-最邻近的稀有气体元素的原子序数二八Z.〔1〕假设A Z < 0 ,那么与稀有气体元素同周期,族序数为8-|A Z| ;〔2〕假设A Z>0 ,那么在稀有气体元素下一周期,族序数为A Z.例如①35号元素〔最邻近的是36Kr〕,那么35 - 36 =- 1 ,故周期数为4 ,族序数为8 - | - 1| 二7 ,即第四周期第M族,为浸元素.②87号元素〔相邻近的是86Rn〕,那么87 - 86 = 1 ,故周期数为7,族序数为1 ,即第七周期第nA族,为钫元素.知识点二元素周期律【考必备•清单】1.元素周期律[名师点拨]①判断元素非金属性或金属性的强弱,依据是元素原子在化学反响中得失电子的难易而不是得失电子的多少.②根据元素氧化物对应水化物的酸碱性的强弱判断元素非金属性或金属性的强弱时必须是其最高价氧化物对应的水化物.4.元素周期表、元素周期律的应用(1)根据元素周期表中的位置寻找未知元素.(2)预测元素的性质(由递变规律推测)①比拟不同周期、不同主族元素的性质例如:金属性Mg>Al、Ca>Mg,那么碱性Mg(OH)22Al(OH)3、Ca(OH)2>Mg(OH)2, Ca(OH)22Al(OH)3(填“>< 〞或"=").②推测未知元素的某些性质例如:Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶;再如:卤族元素的性质递变规律,可推知元素砹(At)应为有色固体,与氢难化合,HAt丕稳定,水溶液呈酸性,AgAt不溶于水等.(3)启发人们在一定区域内寻找新物质①半导体元素在金属与非金属分界线附近,如Si、Ge、Ga等.②农药中常用元素在周期表右上方,如F、Cl、S、P、As等.③催化剂和耐高温、耐腐蚀合金材料主要在过渡元素中找,如Fe、Ni、Rh、Pt、Pd等.【夯根底・小题】1.判断正误(正确的打y",错误的打"义〞).(1)1的原子半径大于Br, HI比HBr的热稳定性强()(2)同主族元素含氧酸的酸性随核电荷数的增加而减弱()(3)第二周期元素从左到右,最高正价从+ 1递增到+7()(4)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小()(5)第二周期元素从左到右,元素的金属性逐渐减弱,非金属性逐渐增强()(6)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强()(7)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强()答案:(1)义(2)义(3)义(4)义(5)7 (6)义(7)义2.以下实验不能到达实验目的的是()解析:选B A项,Cl2、Br2分别与H2反响,根据反响发生的条件即可判断出氯、溪的非金属性强弱B项向Mg Cl2、AlCl3溶液中分别通入氨MgCl2与NH3-H2O反响生成Mg(OH)2 ,AlCl3与NH3-H2O反响生成Al(OH)3,但不能比拟二者的金属性强弱;C项,测定相同物质的量浓度的Na2CO3、Na2sO4溶液的pH,根据pH可判断出Na2cO3与Na2sO4水解程度的大小,即判断出H2CO3与H2sO4酸性强弱,从而判断出碳、硫的非金属性强弱;D项,利用Fe、Cu与稀盐酸反响现象的不同即可判断出Fe、Cu的金属性强弱.3.短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,那么以下表达中正确的选项是()A.原子序数:D>C>B>AB.原子半径:B>A>C>DC.离子半径:C3->D->A2+>B+D.氧化性:A2+>B+,复原性:C3-<D-解析:选B由于四种离子具有相同的电子层结构,离子所对应的元素应位于相邻两个CD周期,根据阴阳离子所带的电荷数,得出元素在周期表中的位置关系:口; D.原子序BA数大小应为A > B > D > C,A项错误;根据原子半径的递变规律,可以判断B项正确;离子半径应为C3 一>D- >B+ >A2+,C项错误;复原性应为C3 一>D-,D项错误.[方法技巧]“三看〞法快速判断简单微粒半径的大小一看电子层数:最外层电子数相同时,电子层数越多,半径越大.二看核电荷数:当电子层结构相同时,核电荷数越大,半径越小.三看核外电子数:当电子层数和核电荷数均相同时,核外电子数越多,半径越大.随堂检测反响1. 〔2021•海南高考〕今年是门捷列夫发现元素周期律150周年,联合国将2021年定为“国际化学元素周期表年〞.以下有关化学元素周期表的说法正确的选项是〔〕A.元素周期表共有16列B. DA族元素的非金属性自上而下依次减弱C.主族元素均呈现与其族数相同的最高化合价D.第二周期主族元素的原子半径自左向右依次增大解析:选B A项,元素周期表共有18纵行,也就是共有18列,错误;B项,对于同一主族的元素,从上到下原子半径逐渐增大,原子获得电子的水平逐渐减弱,所以A族元素的非金属性自上而下依次减弱,正确;C项,主族元素一般呈现与其族数相同的最高化合价,O、F非金属性强,O 没有与族序数相等的最高正化合价,F没有正价,错误;D项, 第二周期主族元素的原子半径自左向右依次减小,错误.2.〔2021•北京高考〕2021年是元素周期表发表150周年.期间科学家为完善周期表做出了不懈努力.中国科学院院士张青莲教授曾主持测定了铟〔491n〕等9种元素相对原子质量的新值,被采用为国际新标准.锢与铷〔37Rb〕同周期.以下说法不正确的选项是〔〕A. In是第五周期第口人族元素B.您In的中子数与电子数的差值为17C.原子半径:In>AlD.碱性:In〔OH〕3>RbOH解析:选D A正确,Rb为碱金属,位于第五周期,In与Al同主族,可推断In是第五周期第口人族元素;B正确,1451n的中子数为115 - 49 = 66 ,电子数为49,因此您In的中子数与电子数的差值为17 ;C正确,锢和铝同属于口人族元素,前者位于第五周期,后者位于第三周期,因此原子半径:In>Al ;D错误,锢和铷同属于第五周期元素,前者位于口人族,后者位于口人族,根据同周期主族元素最高价氧化物的水化物的碱性递变规律得:碱性In(OH)3<RbOH.3.〔2021•天津高考〕根据元素周期表和元素周期律,判断以下表达不正确的选项是〔〕A.气态氢化物的稳定性:H2O>NH3>SiH4B .氢元素与其他元素可形成共价化合物或离子化合物C.如下图实验可证实元素的非金属性:Cl>C>Si含稀盐酸CaCO3 MM KG Na娟乂力憎和僻液溶液D.用中文“为〞〔立.〕命名的第118号元素在周期表中位于第七周期0族解析:选C非金属性:O>N>C>Si ,故气态氢化物的稳定性:H2O>NH3>SiH4, A项正确;H与C、N、O、F等非金属元素形成共价化合物,与Na、Mg等金属元素形成离子化合物,B项正确;题图所示实验可证实酸性:HCl>H2cO3>H2SiO3,但元素非金属性的强弱与元素的最高价氧化物对应的水化物的酸性强弱有关,HCl不是氯元素的最高价氧化物对应的水化物,故不能根据其酸性强弱判断Cl的非金属性强弱,C项错误;118号元素在元素周期表中位于第七周期0族,D项正确.4.〔2021•海南高考〕X、Y、L、M为核电荷数依次增大的前20号主族元素.X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数.答复以下问题:〔1〕X与L组成的最简单化合物的电子式为.〔2〕X与M组成的物质为〔填“共价〞或“离子〞〕化合物,该物质可作为野外工作的应急燃料,其与水反响的化学方程式为.〔3〕Y在周期表中的位置是 ,其含氧酸的化学式为〔4〕L与M形成的化合物中L的化合价是.解析:X2为最轻的气体,即X为H , Y、L、M三种元素的质子数为5的倍数,质子数等于原子序数,质子数可能为5、10、15、20中的三个,因四种元素为主族元素,古攵质子数 为10舍去,即三种元素分别为B 、P 、Ca .(1)形成简单化合物是PH 3,其电子式为H : P : H fH; (2)形成的化合物是CaH 2,属于离子化合物,与水发生的反响是CaH 2+2H 2O===Ca(OH)2+2H 2T ; (3)Y 为B ,属于第二周期^A 族元素,其含氧酸为H 3BO 3; (4)形 成的化合物是Ca 3P 2,其中P 显一3价.(2)离子 CaH 2+2H2O===Ca(OH)2+2H/ (3)第二周期nA 族H 3BO 3 (4)一3一、选择题(此题共8小题,每题只有一个选项符合题意)1.以下关于元素的说法正确的选项是()A .随着人工合成的同位素种类不断增加,许多元素的相对原子质量会随之变化B .核素的质量数与其相对原子质量完全相同C 短周期主族元素的族序数一定等于原子的最外层电子数D .周期表中非金属元素均位于过渡元素右侧解析:选C A 项,元素的相对原子质量是指元素的平均相对原子质量,它是根据天然同位素原子所占的原子个数百分比和其相对原子质量计算出的平均值与人工合成的同位素 种类不断增加没有关系,错误;B 项,一种核素的质量数=质子数+中子数,是整数,该核素的相对原子质量是指一个原子(即核素)的质量与12C 质量的七的比值,不可能是整数,不 JL 乙完全相同,错误;C 项,短周期主族元素的族序数一定等于原子的最外层电子数,正确;D 项,周期表中非金属元素大多位于过渡元素右侧,而氢却位于左侧,故D 错误.2. (2021•北京师大附中期中)以下事实中,不能用元素周期律解释的是()A .原子半径:K>Ca>MgB .碱性:NaOH>Mg(OH)2>Al(OH)310答案:(1)P : EIIIC .热稳定性:HF>HCl>H 2SD .酸性:H 2sO 3>H 2cO 3>H 2SiO 3解析:选D 同一周期主族元素从左到右原子半径依次减小,同一主族元素从上到下原 子半径依次增大,A 项不符合题意;元素的金属性越强,其最高价氧化物对应的水化物碱性 越强,B 项不符合题意;元素的非金属性越强,其气态氢化物越稳定,C 项不符合题意;元 素的非金属性越强,其最高价氧化物对应的水化物酸性越强,D 项符合题意.3.在元素周期表中,伯元素如下图,以下有关说法正确的埴〕A .伯是非金属元素,在常温下呈固态B.溺Pt 和瑙Pt 的核外电子数相同,互为同位素C . “195.1〞是铂的质量数D .由78可以推出Pt 为第五周期元素解析:选B 粕为金属元素,A 项错误;引8Pt 和1788Pt 的质子数相同,中子数不同,是两 种不同的核素,二者互为同位素,B 项正确;“195.1〞是粕元素的相对原子质量,C 项错误; 由78推出Pt 为第六周期元素,D 项错误.4 .以下有关元素的性质及其递变规律正确的选项是〔〕A . DA 族元素从上到下,其氢化物的稳定性逐渐增强B .第二周期元素从左到右,最高正价从+1递增到+7C .同周期元素〔0族元素除外〕从左到右,原子半径逐渐减小D .同周期金属元素的化合价越高,其原子失电子水平越强解析:选C 同主族元素从上到下,非金属性逐渐减弱,氢化物的稳定性逐渐减弱,A 错误;第二周期元素中,O 没有最高正化合价,F 没有正化合价,B 错误;同周期元氨0族 元素除外〕从左到右,随着核电荷数逐渐增多,原子半径逐渐减小,C 正确;在第三周期的元 素中,Al 为+ 3价,Na 为+ 1价,但失电子水平Na>Al , D 错误.5 .以下事实不能用元素周期律解释的是〔〕A. F 2在暗处遇H 2即爆炸,I 2在暗处遇H 2几乎不反响B. “NO 2球〞在冷水中颜色变浅,在热水中颜色加深1178Pt 钳 LB 口」才媪C.氯原子与钠原子形成离子键,与硅原子形成共价键D. H2O在4 000 口以上开始明显分解,H2S用酒精灯加热即可完全分解解析:选B同主族元素从上到下非金属性减弱,单质与H2反响越来越难,能用元素周期律解释F2在暗处遇H2即爆炸,2在暗处遇H2几乎不反响A不符合题意2NO2N2O4AH <0,热水中平衡逆向移动,颜色加深,冷水中平衡正向移动,颜色变浅,不能用元素周期律解释,B符合题意;同周期元素从左到右非金属性逐渐增强,非金属性:Cl>Si,所以氯原子与钠原子形成离子键,与硅原子形成共价键,能用元素周期律解释,C不符合题意;同主族元素从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱能用元素周期律解释H2O在 4 000 口以上开始明显分解,H2S用酒精灯加热即可完全分解,D不符合题意.6. 〔2021•福建三明一中测试〕以下事实不能说明元素的金属性或非金属性相对强弱的是〔〕解析:选C根据与水反响的剧烈程度可判断元素金属性强弱,A项不符合题意;根据最高价氧化物对应的水化物碱性强弱可判断元素金属性强弱,B项不符合题意;应该根据最高价氧化物对应的水化物酸性强弱来判断元素非金属性强弱C项符合题意;气态氢化物越稳定, 元素非金属性越强,D项不符合题意.7.A.e的氢化物比d的简单氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,e元素单质的化学性质最活泼D. c、e、f的最高价氧化物对应的水化物的酸性依次增强解析:选D e是硫元素,d是氧元素,H2s稳定性弱于H2O , A错误;同周期元素的原子半径从左到右逐渐减小,B错误;a~f六种元素分别为Na、Mg、C、O、S、Cl ,其中金属单质中Na 的化学性质最活泼,非金属单质中Cl2、O2化学性质均比S活泼,C错误.8.〔2021•浙江嘉兴一中期末〕几种短周期元素的原子半径及主要化合价如下表所示:以下表达正确的选项是〔〕A. X、Y元素的最高价氧化物对应的水化物的碱性:X<YB.简单离子的半径:Z<W<X<YC.一定条件下,W的单质可以将Z的单质从其氢化物中置换出来D.X与Z形成的化合物为共价化合物解析:选C同一周期元素,原子半径随着原子序数的增大而减小;同一主族元素,原子半径随着原子序数的增大而增大;主族元素中的最高正化合价与其主族序数相同,最低负价二主族序数- 8,根据表中数据知,X为Mg元素,Y为Al元素,Z为N元素,W为O 元素,V为P元素.金属性:Mg>Al ,最高价氧化物对应的水化物的碱性:X>Y , A错误;对于简单离子而言,电子层数越多,离子半径越大,电子层结构相同时,核电荷数越大,离子半径越小,所以简单离子半径:Y<X<W<Z , B错误;一定条件下,氧气可以和氨气反响生成水和氮气,C正确;Mg与N形成的化合物Mg3N2为离子化合物,D错误.二、选择题〔此题共4小题,每题有一个或两个选项符合题意〕139.元素周期表和元素周期律可以指导人们进行规律性的推测和判断.以下说法不合理的是〔〕A.由水溶液的酸性:HCl>HF,不能推断出元素的非金属性:Cl>FB.人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料C短周期元素正化合价数值和其族序数相同D.短周期元素形成的微粒X2-和Y2+核外电子排布相同,那么离子半径:X2->Y2+解析:选C A项,非金属性的强弱,应根据最高价氧化物对应水化物的酸性比拟,不能根据氢化物的酸性进行比拟,HF的酸性比HCl弱,但非金属性F强于Cl,正确;B项, 优良的催化剂及耐高温和耐腐蚀的合金材料〔如镍、粕等〕,大多属于过渡元素,正确;C项, 短周期元素正化合价数值和其族序数不一定相同,如C有+ 2、+ 4价,错误;D项,微粒X2一与丫2+核外电子排布相同,核电荷数越大,离子半径越小,核电荷数:Y>X ,故离子半径:X2->Y2+,正确.10.短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如下图,其中W原子的质子数是其M层电子数的三倍,以下说法不正确的选项是〔〕A. X与Y只能形成4种化合物B.工业上常通过电解Z的熔融氯化物的方法来制取Z的单质三工一1Z |知[C.简单离子的半径由大到小为Q>X>Y>ZD. X、W、Q最高价氧化物对应水化物的酸性Q>X >W解析:选AB这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期,Z、W、Q位于第三周期,W原子的质子数是其M层电子数的三倍,设其M 层电子为x,那么W 原子质子数=2 + 8+ x , 2 + 8+ x = 3 x,所以x = 5,那么W为P元素,那么X 是N元素、Y是O 元素、Z是Al元素、Q是Cl元素.A项,X、Y分别是N、O元素,二者能形成多种氮氧化物,如N2O、NO、NO2、N2O4、N2O5,所以X与Y可形成的化合物在5种以上,错误;B项,Z是Al元素,熔融状态下氯化铝不导电,所以工业上采用电解熔融氧化铝的方法冶炼Al ,错误;C项,电子层数越多其离子半径越大,电子层结构相同的离14子,离子半径随着原子序数增大而减小,所以离子半径:Q > X > Y > Z ,正确;D 项,元素 的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Q>X>W ,那么最高价氧 化物对应水化物的酸性Q>X>W ,正确.11. 〔2021•广东五校协作体一联〕如图是局部短周期元素原子半径与原子序数的关系图, 以下说法中正确的选项是〔〕A. M 的最高价氧化物对应水化物能分别与Z 、R 的最高价氧化物对应的水化物反响B. Y 的单质不能从含R 简单离子的水溶液中置换出R 单质C. X 、N 两种元素组成的化合物熔点很低D .简单离子的半径:Z<X<M解析:选AB 题图为第二周期和第三周期元素的原子半径的变化情况,根据原子序数 关系可知X 为O 元素,Y 为F 元素,Z 为Na 元素,M 为Al 元素,N 为Si 元素,R 为Cl 元素.M 的最高价氧化物对应水化物Al 〔OH 〕3能分别与Z 、R 的最高价氧化物对应水化物 NaOH 、HC1O 4反响,A 项正确;F 2直接与水反响,不能从含Cl -的水溶液中置换出Cl 2 , B 项正确;X 、N 两种元素组成的化合物是SiO 2,熔点很高,C 项错误;O 2 -、Na +、Ah +电子 层结构相同,核电荷数越大离子半径越小,故离子半径:O 2->Na + >Al 3+, D 项错误.12. 〔2021•广东广州天河二模〕短周期元素x 、y 、d 、f 的最高正价或最低负价、原子半 径的相对大小随原子序数的变化如图1所示;短周期元素z 、e 、g 、h 的最高价氧化物对应 水化物的溶液〔浓度均为0.01 mol/L 〕的pH 与原子序数的关系如图2所示:以下有关说法正确的选项是()A .离子半径大小顺序:e>f>g>hB .由x 、z 、d 三种元素形成的化合物中一定不含离子键-2同+4同‘ H 国 15 原子序数原子序数图2C. y、d、g的简单气态氢化物中沸点最高的是g的氢化物D.装满zd2气体的小试管倒扣水槽中充分反响,试管液面上升约2/3解析:选D由题意可知,x是H元素,y是C元素,z是N元素,d是O元素,f是Al元素,e是Na元素,g是S元素,h是Cl元素.离子半径:g>h>e>f,故A错误;H、N、O形成的硝酸铵中含有离子键,故B错误;y、d、g的简单气态氢化物中,沸点最高的是d(O)的氢化物,故C错误;zd2气体为NO2,根据反响的化学方程式3NO2+ H2O===2HNO3 + NO可知,反响后试管中液面上升约3,故D正确.16。

高中化学常识:元素周期律元素周期律,指元素的性质随着元素的原子序数(即原子核外电子数或核电荷数)的递增呈周期性变化的规律。
周期律的发现是化学系统化过程中的一个重要里程碑。
元素周期律如下:元素的性质随着原子序数的递增而呈周期性的递变规律。
1.原子半径(1)同一周期(稀有气体除外),从左到右,随着原子序数的(2)递增,元素原子的半径递减;(3)同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
总说为:左下方>右上方(注):阴阳离子的半径大小辨别规律(4)由于阴离子是电子最外层得到了电子而阳离子是失去了电子所以,总的说来,同种元素的:(5)阳离子半径<原子半径<阴离子半径(6)同周期内,阳离子半径逐渐减小,阴离子半径逐渐增加;(7)同主族内离子半径逐渐增大。
(8)对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
(不适合用于稀有气体)(9)同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F(O无最高正价,F无正价,除外)元素除外;(10)最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。
(11)元素最高价的绝对值与最低价的绝对值的和为8,代数和为0,2,4,6的偶数之一(仅限除O,F的非金属)2.元素的金属性、氧化性、还原性、稳定性同一周期中,从左到右,随着原子序数的递增,元素的金属性递减,非金属性递增;(1)单质氧化性越强,还原性越弱,对应简单阴离子的还原性越弱,简单阳离子的氧化性越强;(2)单质与氢气越容易反应,反应越剧烈,其氢化物越稳定;(3)最高价氧化物对应水化物(含氧酸)酸性越强。
同一族中,从上到下,随着原子序数的递增,元素的金属性递增,非金属性递减;(4)单质还原性越强,氧化性越弱,对应简单阴离子的还原性越强,简单阳离子的氧化性越弱;(5)单质与水或酸越容易反应,反应越剧烈,单质与氢气越不容易反应;(6)最高价氧化物对应水化物(氢氧化物)碱性越强。

元素周期律、元素周期表(一)[重点内容讲解]一、元素周期律:元素的性质随着原子序数的递增而呈周期性的变化(即随着原子核电荷数的递增,核外电子排布呈现周期性的变化)表现在1.随着原子序数的递增,元素原子的最外层电子数重复着由1到8(K层除外)的周期性变化。
2.随着原子序数的递增,元素(除稀有气体外)的原子半径重复着由大到小的周期性变化。
3.随着原子序数的递增,元素的主要化合价(除H、He外)重复着正价由+1到+7,负价由-4到-1的规律性变化。
元素周期律的实质是由于原子序数的递增,核外电子排布呈周期性变化的结果。
由此导致元素化学性质,如金属性、非金属性、气态氢化物稳定性、高价氧化物对应水化物的酸碱性等呈现周期性的变化规律,这就是元素周期律,但应注意这种变化不是简单的重复。
二、元素周期表:元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律。
1.元素周期表的结构:七横行——周期,包括三个短周期,三个长周期和一个不完全周期;十八个纵列——族,包括七主族,七副族,一个Ⅷ族和一个零族。
注意:(1)主族和副族的区分:主族是由长周期元素和短周期元素共同构成的族,但由长周期和短周期构成的族也不一定是主族元素,如0族元素。
只由长周期元素构成的族为副族。
(2)镧系和锕系及超铀元素所包含的元素。
2.与原子结构的关系:同周期:电子层数相同,周期数即电子层数,最外层电子从1个递增到8个(除第1周期外)同主族:电子层数不同,最外层电子数相同,族序数即最外层电子数。
注意:(1)最外层只有1个电子的元素,不一定是IA族元素,可能是副族元素,如Cu,也不一定是金属元素,如H。
最外层电子数有2个电子的元素不一定是主族元素,如He、Fe等。
最外层电子是3~7个电子的元素一定是主族元素。
(2)每一周期元素种类:2,8,8,18,18,32,(7周期预计32);(3)同一周期主族序数之差即原子序数之差或最外层电子数之差。
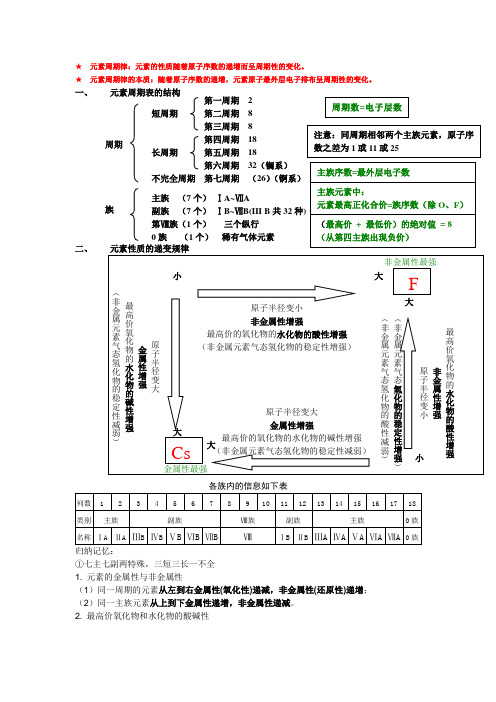
★ 元素周期律:元素的性质随着原子序数的递增而呈周期性的变化。
★ 元素周期律的本质:随着原子序数的递增,元素原子最外层电子排布呈周期性的变化。
一、 元素周期表的结构周期 族 二、 元素性质的递变规律①七主七副两特殊,三短三长一不全1. 元素的金属性与非金属性(1)同一周期的元素从左到右金属性(氧化性)递减,非金属性(还原性)递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
2. 最高价氧化物和水化物的酸碱性短周期 长周期 不完全周期 第七周期 (26)(锕系) 第一周期 2 第二周期 8 第三周期 8 第四周期 18 第五周期 18 第六周期 32(镧系) 主族 (7个) ⅠA~ⅦA 副族 (7个) ⅠB~ⅦB(III B 共32种)第Ⅷ族(1个) 三个纵行 0族 (1个) 稀有气体元素元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强,气态氢化物越稳定。
3. 非金属气态氢化物元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
4. 原子、离子半径的比较1.原子的半径大于相应阳离子的半径,小于相应阴离子的半径。
2.同种元素不同价态的离子,价态越高,离子半径越小。
3.电子层结构相同的阴、阳离子,核电荷数越多,离子半径越小。
对照稀有气体原子结构,可归纳为“阴前阳下,径小序大”。
5、比较金属性、非金属性强弱的依据1.金属性强弱的依据①单质跟水或酸置换出氢的难易程度(或反应的剧烈程度)。
反应越易,其金属性就越强。
②最高价氧化物对应水化物的碱性强弱。
碱性越强,其金属性也就越强,反之则弱。
③金属间的置换反应。
金属甲能从金属乙的盐溶液中置换出乙,说明甲的金属性比乙强。
④单质还原性越强,金属性越强。
⑤金属阳离子氧化性的强弱。
阳离子的氧化性越强,对应金属的金属性就越弱。

元素周期表中的周期性规律元素周期表是由化学元素按照原子序数排列而成的一种表格形式,它展示了化学元素的特性和周期性规律。
通过研究元素周期表,我们可以发现一些重要的规律,这些规律对于理解元素的性质和化学反应具有重要的指导意义。
1. 原子序数与电子结构元素周期表中的每个元素都有一个原子序数,它代表了该元素原子核中的质子数量,也是元素的唯一标识。
在元素周期表中,从左到右依次增加原子序数,相应地,原子核中的质子数量也逐渐增加。
原子核外的电子数量通常与原子序数相等,这个数目决定了元素的化学性质。
2. 周期性规律:周期表的水平排列元素周期表中的元素按照原子序数从左向右水平排列,相邻两个元素的原子序数差为1。
这种排列方式揭示了许多周期性规律。
2.1 原子半径:原子半径通常随着原子序数的增加而增加。
这是因为原子中质子数量的增加导致了更多的电子层的形成,使得原子整体变得更大。
2.2 电离能:元素周期表中的元素对电子的结合程度不同,需要不同的能量才能将电子从原子中移除。
通常,原子序数较小的元素具有较低的电离能,随着原子序数的增加,电离能逐渐增大。
2.3 电子亲和能:元素的电子亲和能指的是一个原子从外层电子轨道吸引到其原子核时所释放出的能量。
元素周期表中的元素电子亲和能通常随着原子序数的增加而增加。
2.4 金属性和非金属性:元素周期表中的元素可以分为金属性元素和非金属性元素。
金属性元素大致集中在周期表的左下方,而非金属性元素则主要分布在周期表的右上方。
3. 周期性规律:周期表的垂直排列元素周期表还可以根据元素的性质和电子结构进行垂直排列,这种排列方式揭示了新的周期性规律。
3.1 主族元素和过渡元素:元素周期表可以分为主族元素和过渡元素两大类。
主族元素通常包括周期表中的1A到7A族元素,它们的电子结构规则和化学行为较为一致。
过渡元素通常位于周期表的中央部位,它们具有不规则的电子结构和多样的化学性质。
3.2 化合价:在元素周期表中,主族元素通常以不同的化合价参与化学反应。
化学元素周期表规律(一)元素周期律和元素周期表1.元素周期律及其应用(1)发生周期性变化的性质原子半径、化合价、金属性和非金属性、气态氢化物的稳定性、最高价氧化物对应水化物的酸性或碱性。
(2)元素周期律的实质元素性质随着原子序数递增呈现出周期性变化,是元素的原子核外电子排布周期性变化的必然结果。
也就是说,原子结构上的周期性变化必然引起元素性质上的周期性变化,充分体现了结构决定性质的规律。
2.比较金属性、非金属性强弱的依据(1)金属性强弱的依据1/单质跟水或酸置换出氢的难易程度(或反应的剧烈程度)。
反应越易,说明其金属性就越强。
2/最高价氧化物对应水化物的碱性强弱。
碱性越强,说明其金属性也就越强,反之则弱。
3/金属间的置换反应。
依据氧化还原反应的规律,金属甲能从金属乙的盐溶液中置换出乙,说明甲的金属性比乙强。
4/金属阳离子氧化性的强弱。
阳离子的氧化性越强,对应金属的金属性就越弱。
(2)非金属性强弱的依据1/单质跟氢气化合的难易程度、条件及生成氢化物的稳定性。
越易与反应,生成的氢化物也就越稳定,氢化物的还原性也就越弱,说明其非金属性也就越强。
2/最高价氧化物对应水化物酸性的强弱。
酸性越强,说明其非金属性越强。
3/非金属单质问的置换反应。
非金属甲把非金属乙对应的阴离子从其盐溶液中置换出来,说明甲的非金属性比乙强。
如 Br2 + 2KI == 2KBr + I24/非金属元素的原子对应阴离子的还原性。
还原性越强,元素的非金属性就越弱。
3.常见元素化合价的一些规律(1)金属元素无负价。
金属单质只有还原性。
(2)氟、氧一般无正价。
(3)若元素有最高正价和最低负价,元素的最高正价数等于最外层电子数;元素的最低负价与最高正价的关系为:最高正价+|最低负价|=8。
(4)除某些元素外(如N元素),原子序数为奇数的元素,其化合价也常呈奇数价,原子序数为偶数的元素,其化合价也常呈偶数价,即价奇序奇,价偶序偶。
若元素原子的最外层电子数为奇数,则元素的正常化合价为一系列连续的奇数,若有偶数则为非正常化合价,其氧化物是不成盐氧化物,如NO;若原子最外层电子数为偶数,则正常化合价为一系列连续的偶数。
初中化学《元素周期律》优秀教案第一章:元素周期律的发现1.1 科学家的探索-介绍道尔顿、门捷列夫等科学家对元素周期律的贡献1.2 元素周期律的定义-解释元素周期律的概念:元素周期律是元素性质随着原子序数的递增而呈周期性变化的规律1.3 元素周期律的表述-介绍元素周期律的表述方式:周期表第二章:元素周期律的规律2.1 周期性变化-解释元素周期律的周期性变化:原子半径、化合价、金属性和非金属性等2.2 周期表的结构-介绍周期表的结构:周期、族、周期表的排列规律2.3 周期表的应用-讲解周期表在化学学习和实际应用中的重要性第三章:周期表中的主族元素3.1 碱金属族-介绍碱金属族的元素特点、性质及应用3.2 碱土金属族-介绍碱土金属族的元素特点、性质及应用3.3 卤族元素-介绍卤族元素的元素特点、性质及应用第四章:周期表中的过渡元素4.1 过渡元素的分类-讲解过渡元素的分类:d区和ds区4.2 过渡元素的性质-介绍过渡元素的性质:金属性、非金属性、氧化还原性等4.3 过渡元素的应用-讲解过渡元素在催化剂、合金等领域的应用第五章:周期表中的镧系和锕系元素5.1 镧系和锕系元素的发现-介绍镧系和锕系元素的发现背景及意义5.2 镧系和锕系元素的性质-介绍镧系和锕系元素的元素特点、性质及应用5.3 镧系和锕系元素的研究意义-讲解镧系和锕系元素在核反应、超导体等领域的研究价值第六章:原子结构和元素周期律6.1 原子核外电子的排布-解释原子核外电子的排布规律及其与元素周期律的关系6.2 元素周期律的量子化学解释-介绍量子化学对元素周期律的解释和意义6.3 原子半径的周期性变化-讲解原子半径的周期性变化及其在周期表中的应用第七章:元素周期律与化学反应7.1 元素化合价的周期性变化-解释化合价的周期性变化及其对化学反应的影响7.2 金属性和非金属性的周期性变化-介绍金属性和非金属性的周期性变化及其在化学反应中的应用7.3 元素周期律在化学反应预测中的应用-讲解如何利用元素周期律预测化学反应的可能性及产物第八章:元素周期律在材料科学中的应用8.1 金属材料的设计与制备-介绍如何利用元素周期律设计和制备金属材料8.2 半导体材料的应用-讲解半导体材料在电子、光电子领域的应用及其与元素周期律的关系8.3 超级合金及其他先进材料-介绍超级合金及其他先进材料的设计原理及其与元素周期律的关系第九章:元素周期律在环境化学中的应用9.1 环境污染与元素周期律-解释环境污染与元素周期律的关系及其在污染治理中的应用9.2 元素生物地球化学循环-介绍元素生物地球化学循环的规律及其与元素周期律的关系9.3 环境监测与元素周期律-讲解如何利用元素周期律进行环境监测和污染物分析第十章:元素周期律在药物化学中的应用10.1 药物设计与元素周期律-介绍药物设计与元素周期律的关系及其在药物研发中的应用10.2 药物分子结构的优化-解释如何利用元素周期律优化药物分子结构以提高药效10.3 元素周期律在药物筛选中的应用-讲解元素周期律在药物筛选和构效关系研究中的作用第十一章:元素周期律在材料科学中的应用(续)11.1 纳米材料与元素周期律-介绍纳米材料的设计与元素周期律的关系11.2 复合材料的应用-讲解复合材料在各个领域的应用及其与元素周期律的关系11.3 功能材料的研究与发展-介绍功能材料的研究与发展趋势及其与元素周期律的联系第十二章:元素周期律在生物化学中的应用12.1 生物体内元素的分布与周期律-解释生物体内元素分布与元素周期律的关系12.2 酶与元素周期律-介绍酶的活性中心元素与元素周期律的关系12.3 生物地球化学与元素周期律-讲解生物地球化学研究中元素周期律的应用第十三章:元素周期律在宇宙化学中的应用13.1 宇宙中的元素分布-介绍宇宙中元素分布的特点及其与元素周期律的关系13.2 恒星演化与元素周期律-解释恒星演化过程中元素周期律的应用13.3 行星地球化学与元素周期律-讲解行星地球化学研究中元素周期律的应用第十四章:元素周期律在现代化学分析中的应用14.1 原子吸收光谱分析-介绍原子吸收光谱分析原理及其与元素周期律的关系14.2 质谱分析与应用-讲解质谱分析原理及其在元素周期律研究中的应用14.3 X射线荧光光谱分析-介绍X射线荧光光谱分析原理及其与元素周期律的关系第十五章:元素周期律的综合应用与研究前景15.1 元素周期律在多领域中的应用-总结元素周期律在多个领域的应用及其重要性15.2 元素周期律的研究新进展-介绍元素周期律研究的新技术、新方法及发展趋势15.3 元素周期律的挑战与机遇-探讨元素周期律在现代科学中的挑战及未来发展的机遇重点和难点解析本文主要介绍了初中化学《元素周期律》的相关知识,包括元素周期律的发现、规律、应用以及其在不同领域的重要性。
高一必修1化学第五章重要知识点:元素周期律元素周期律指元素的性质随元素的原子序数(即核电荷数或核外电子数)的增加而呈现周期性变化的规律。
以下是查字典化学网为大家整理的高一必修1化学第五章重要知识点,希望可以解决您所遇到的相关问题,加油,查字典化学网一直陪伴您。
热点一物质结构元素周期律【必备知识规律总结】一、原子结构1.几个量的关系(X)质量数(A)=质子数(Z)+中子数(N)质子数=核电荷数=原子序数=原子的核外电子数离子电荷数=质子数-核外电子数2.同位素(1)要点:同质子数相同,异中子数不同,微粒原子。
(2)特点:同位素的化学性质几乎完全相同;自然界中稳定同位素的原子个数百分数不变。
3.核外电子排布规律(1).核外电子是由里向外,分层排布的。
(2).各电子层最多容纳的电子数为2n2个;最外层电子数不得超过8个,次外层电子数不得超过18个,倒数第三层电子数不得超过32个。
(3).以上几点互相联系。
4.微粒半径大小比较规律(1).同周期元素(稀有气体除外)的原子半径随原子核电荷数的递增逐渐减小。
(2).同主族元素的原子半径和离子半径随着原子核电荷数的递增逐渐增大。
(3).电子层结构相同的离子,核电荷数越大,则离子半径越小。
(4).同种元素的微粒半径:阳离子原子阴离子。
(5).稀有气体元素的原子半径大于同周期元素原子半径.二、元素周期律和周期表1.几个量的关系周期数=电子层数主族序数=最外层电子数=最高正价数|最高正价|+|负价|=82.周期表中部分规律总结(1).最外层电子数大于或等于3而又小于8的元素一定是主族元素;最外层电子数为1或2的元素可能是主族、副族或0族(He)元素;最外层电子数为8的元素是稀有气体元素(He除外)。
(2).在周期表中,第ⅡA与ⅢA族元素的原子序数差分别有以下三种情况:①第1~3周期(短周期)元素原子序数相差1;②第4、5周期相差11;③第6、7周期相差25。
(3).同主族相邻元素的原子序数差别有以下二种情况:①第ⅠA、ⅡA族,上一周期元素的原子序数+该周期元素的数目=下一同期元素的原子序数;②第ⅢA~ⅦA族,上一周期元素的原子序数+下一周期元素的数目=下一周期元素的原子序数。
一、原子序数1、原子序数的编排原则按核电荷数由小到大的顺序给元素编号,这种编号,叫做原子序数。
2、原子序数与原子中各组成粒子数的关系原子序数=核电荷数=质子数=核外电子数二、元素周期律我们知道:一切客观事物本来是互相联系的和具有内部规律的,所以,各元素间也应存在着相互联系及内部规律。
1.核外电子排布的周期性从3-18号元素,随着原子序数递增,最外层电子数从1个递增至8个,达到稀有气体元素原子的稳定结构,然后又重复出现原子最外层电子数从1个递增至8个的变化。
18号以后的元素,尽管情况比较复杂,但每隔一定数目的元素,也会出现原子最外层电子数从1个递增到8个的变化规律。
可见,随原子序数递增,元素原子的最外层电子排布呈周期性的变化。
2.原子半径的周期性变化从3-9号元素,随原子序数递增,原子半径由大渐小,经过稀有气体元素Ne后,从11-18号元素又重复出现上述变化。
如果把所有的元素按原子序数递增的顺序排列起来,我们会发现随着原子序数的递增,元素的原子半径发生周期性的变化。
注意:①原子半径主要是由核外电子层数和原子核对核外电子的作用等因素决定的。
②稀有气体元素原子半径的测定方法与其它原子半径的测定方法不同,所以稀有气体的原子半径与其他原子的原子半径没有可比性。
一般不比较稀有气体与其它原子半径的大小。
③粒子半径大小比较的一般规律:电子层数越多,半径越大,电子层数越少,半径越小;当电子层结构相同时,核电荷数大的半径小,核电荷数小的半径大;对于同种元素的各种粒子半径,核外电子数越多,半径越大;核外电子数越少,半径越小。
例如,粒子半径:H>H>H;Fe<Fe。
3.元素主要化合价的周期性变化从3-9号元素看,元素化合价的最高正价与最外层电子数相同(O、F 不显正价);其最高正价随着原子序数的递增由+1价递增至+7价;从中部的元素开始有负价,负价是从-4递变到-1。
从11-17号元素,也有上述相同的变化,即:元素化合价的最高正价与最外层电子数相同;其最高正价随着原子序数的递增重复出现由+1价递增至+7价的变化;从中部的元素开始有负价,负价是从-4递变到-1。
◆知识清单一、原子结构及微粒间的关系1.原子的构成2.构成原子或离子微粒间的数量关系(1)质子数=核电荷数=核外电子数=原子序数。
(2)阳离子的核外电子数=质子数__________。
(3)阴离子的核外电子数=质子数___________。
(4)质量数(A)=质子数(Z)+____________________。
【例题1】(1)4822Ti的质子数为________、中子数为________、电子数为________、质量数为________;(2)D316O+的质子数为________、中子数为________、电子数为________。
注意:①任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子中;②有质子的微粒不一定有中子,如1H,有质子的微粒不一定有电子,如H+;③质子数相同的微粒不一定属于同一种元素,如F与OH-。
二、原子核外电子排布12.(1)核外电子一般总是尽先排布在________________的电子层里。
(2)每个电子层最多容纳的电子数为______________。
(3)最外层最多容纳电子数不超过______个(K层为最外层时不超过______个)。
次外层容纳的电子数≤18个,倒数第三层容纳的电子数≤32个。
【例题2】画出下列原子的原子结构示意图,Na:____________、Cl:______________、C:____________。
三、元素周期表1.编排原则周期:按________________递增顺序从左到右排列,把____________相同的元素排成一横行。
族:把不同横行中__________________相等的元素,按__________递增的顺序从上而下排成一纵行。
2.元素周期表的结构【例题3】下列说法中正确的是______。
A.长式元素周期表中现有7个横行,7个周期,18个纵行,18个族B.同周期的第ⅡA族和第ⅢA族元素的原子序数一定相差1C.除短周期外,其他周期均有18种元素D.最外层电子数相同的元素不一定在同一主族E.元素所在的周期数一定等于其原子的电子层数F.每个周期都是从碱金属开始到稀有气体结束四、元素、核素、同位素、同素异形体1.同素异形体:同种元素形成的不同单质,比如白磷与红磷,石墨、金刚石和C 60,O 2与O 3等。
2.元素、核素、同位素 3.适用范围【例题4】下列说法正确的是( )。
①在氮原子中,质子数为7而中子数不一定为7②18 8O 与19 8O 是不同的核素,因此分别由这两种原子构成的分子化学性质不同③O 2和O 3互为同素异形体 ④4822Ti 和5022Ti 的质量数不同,属于两种元素⑤实际存在的11H 、21H 、31H 、H +和H 2,它们是氢的五种核素⑥11H 2、21H 2、31H 2互为同位素 ⑦稀土元素144 62Sm 与150 62Sm 是同一种核素A .①⑥B .②④C .⑤⑦D .①③五、原子结构与元素周期表关系的规律1.元素周期表中的序差关系(1)同一周期ⅡA 与ⅢA 族元素的原子序数可能相差1(第二、三周期)或11(第四、五周期)或25(第六、七周期)(2)相邻周期,同一主族元素的原子序数可能相差2、8、18、32,符合左上右下规律2.由原子序数确定元素位置例如:84号元素、88号元素在周期表中的位置。
首先确定0族元素的原子序数,方法:每一周期所容纳的元素种类为2、8、8、18、18、32、32,用这些数可计算出与84号比较接近的0族元素的原子序数,第六周期0族元素是86号元素,所以84号元素是第六周期第ⅥA 族,同理88号元素是第七周期第ⅡA 族。
【例题5】下列说法正确的是( )。
A .原子序数为7的元素的最高化合价为+4价B .114号元素位于第七周期第ⅣA 族C .位于同一主族的甲乙两种元素,甲的原子序数为x ,则乙的原子序数可能为x +4D .位于同一周期的甲乙两种元素,甲位于ⅠA 族,原子序数为x ,乙位于ⅢA 族,则乙原子序数可能为x +19六、有关原子核外电子排布的推断1.规律(1)最外层电子数跟次外层电子数相等的原子有Be 、Ar 。
(2)最外层电子数是次外层电子数2倍的原子是C ;3倍的是O ;4倍的是Ne ;1/2的是Li 、Si 。
(3)电子层数跟最外层电子数相等的原子有H 、Be 、Al 。
(4)最外层电子数是电子层数2倍的原子有He 、C 、S ;3倍的是O 。
2.特性(核电荷数为1~18的元素)(1)气态密度最小,原子核中只有质子没有中子,原子序数、电子层数、最外层电子数三者均相等的是H 。
(2)单质硬度最大,熔沸点最高,形成化合物种类最多,正负化合价代数和为零且气态氢化物中含氢百分率最高的元素是C 。
(3)原子半径最大的是Na ,最小的是H 。
(4)地壳中含量最多的元素为氧,其次是硅;地壳中含量最多的金属元素是铝。
(5)一些元素的应用:Li 、H 常用于高能电池,Si 是制造光电池、半导体的常用材料;Al 是应用最广泛的短周期金属元素;14C 常用于文物的年代鉴定。
【例题6】(2012浙江理综,9)X 、Y 、Z 是原子序数依次递增的短周期元素,3种元素的原子核外电子数之和与Ca 2+的核外电子数相等,X 、Z 分别得到一个电子后均形成稀有气体原子的稳定电子层结构。
下列说法正确的是( )。
A .原子半径:Z >Y >XB .Z 与X 形成化合物的沸点高于Z 的同族元素与X 形成化合物的沸点C .CaY 2与水发生氧化还原反应时,CaY 2只作氧化剂D .CaX 2、CaY 2和CaZ 2等3种化合物中,阳离子与阴离子个数比均为1∶2七、同主族(ⅠA、ⅦA)元素性质的相似性和递变性13同主族元素原子核外电子层数逐渐增加―→―→―→【例题7】下列说法中正确的是________。
①同一主族的元素具有相似的性质是因为原子的最外层电子数相同②同一主族元素的性质具有递变性是因为从上到下原子的电子层数逐渐增多③碱金属元素的最高化合价均为+1价 ④卤族元素的最低化合价均为-1价⑤卤族元素的最高化合价均为+7价 ⑥碱金属均具有强还原性,与水反应均生成氢气 ⑦同一主族的元素从上往下,单质的熔点逐渐降低八、元素周期律1.定义:元素的性质随着______________的递增而呈________变化的规律。
2.实质:元素原子__________的周期性变化。
3S________O 、P________Cl ;(3)金属性:Na________K 、Mg________Al ;(4)碱性:NaOH________KOH 、Mg (OH )2________Al (OH )3;(5)酸性:H2SO 4________HClO 4;(6)稳定性:HF________HBr 、NH 3________CH 4。
九、元素周期表及元素周期律的应用1.元素周期表中元素的分区__________的元素,既能表现出一定的非金属性,又能表现出一定的金属性。
2.元素周期表和元素周期律应用的重要意义(1)科学预测 为新元素的发现及预测它们的原子结构和性质提供线索。
(2)寻找新材料①半导体材料:在________________________附近的元素中寻找。
②在________________中寻找优良的催化剂和耐高温、耐腐蚀的合金材料。
③在周期表中的____________________附近探索研制农药的材料。
(3)预测元素的性质(根据同周期、同主族性质的递变规律)。
【例题9】下列说法中正确的是__________。
A .Na 是短周期元素中金属性最强的元素B .F 是短周期元素中非金属性最强的元素C .位于元素周期表最右上角的元素是非金属性最强的元素D .位于金属与非金属分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性E .Al 位于金属与非金属分界线附近,可作为半导体材料F .催化剂一般在过渡元素中寻找 ★十、元素金属性和非金属性的强弱比较1.元素金属性强弱的比较①根据金属单质与水(或酸)反应的难易程度:越易反应,则对应金属元素的金属性越强。
②根据金属单质与盐溶液的置换反应:A 置换出B ,则A 对应的金属元素比B 对应的金属元素金属性强。
③根据金属活动性顺序 金属的位置越靠前,其金属性越强④根据最高价氧化物对应水化物的碱性强弱:碱性越强,则对应金属元素的金属性越强。
⑤根据元素在周期表中的位置2.元素非金属性强弱的比较①根据非金属单质与H 2化合的难易程度:越易化合则其对应元素的非金属性越强。
②根据形成的氢化物的稳定性:氢化物越稳定,则其对应元素的非金属性越强。
③根据非金属之间的相互置换:A 能置换出B ,则A 对应的非金属元素的非金属性强于B 对应元素的非金属性。
④根据最高价氧化物对应水化物的酸性强弱:酸性越强,则元素的非金属性越强。
⑤根据元素在周期表中的位置【例题10】下列说法中正确的是( )。
A .从HF 、HCl 、HBr 、HI 酸性递增的事实,推出F 、Cl 、Br 、I 的非金属性递增的规律B .第三周期非金属元素含氧酸的酸性从左到右依次增强C .HF 、HCl 、HBr 、HI 的热稳定性和还原性从左到右依次减弱D .测定等浓度的NaCl 、AlCl 3两溶液的pH 可以比较钠、铝的金属性强弱E .H 2SO 3的酸性大于H 2CO 3,所以S 的非金属性大于碳的非金属性F .硅酸钠溶液中滴入酚酞溶液,溶液变红,再滴加稀盐酸,溶液红色变浅直至消失,可证明非金属性:Cl >SiG .氢化物稳定性:HF >HCl >H 2S >SiH 4>PH 3【例题11】下列说法中正确的是( )。
A .ⅠA 族元素的金属性比ⅡA 族元素的金属性强B .ⅥA 族元素的氢化物中,稳定性最好的是无毒的液体C .在周期表中X 元素排在Y 元素的右面,所以X 元素的非金属性大于YD .X 元素单质可以把Y 元素从其溶液中置换出来,所以X 的金属性大于Y 强(1(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学反应,该元素是________(填元素符号)。
(3)①下列可作为比较X 和Y 金属性强弱的依据是________(填序号)。
a .自然界中的含量b .相同浓度条件氯化物水溶液的pHc .单质与水反应的难易程度d .单质与酸反应时失去的电子数②从原子结构的角度解释X 的金属性强于Y 的原因:_________________________。
十一、微粒半径大小的比较(三看)1.一看电子层数 电子层数越多,半径越大。
例如:r (Li )<r (Na )<r (K )<r (Rb )<r (Cs );r (F -)<r (Cl -)<r (Br -)<r (I -)。