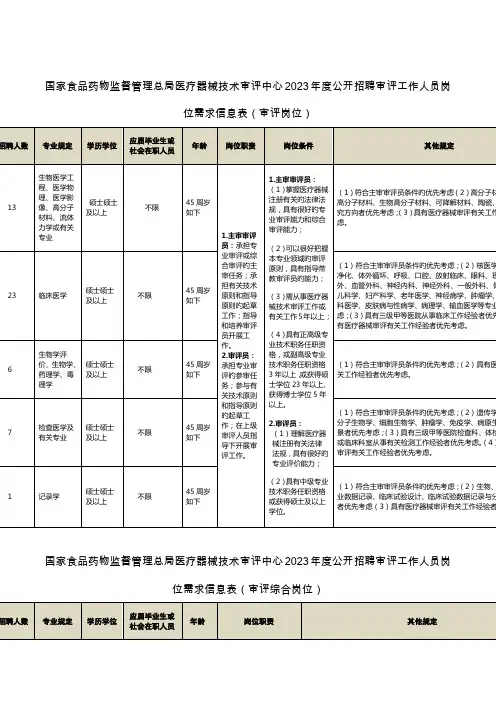
医疗器械技术审评中心审评工作人员公示
- 格式:xlsx
- 大小:14.77 KB
- 文档页数:6

医疗器械技术审评质量管理规范第一章总则第一条为进一步提高医疗器械技术审评工作质量,保证医疗器械技术审评工作依法、科学、高效、公正,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发〔2022〕44 号)、《医疗器械监督管理条例》 (国务院令第 650 号) 、《医疗器械注册管理办法》 (国家食品药品监督管理总局令第 4 号) 、《体外诊断试剂注册管理办法》 (国家食品药品监督管理总局令第 5 号) ,参照GB/T 19001 《质量管理体系要求》的普通原则制定本规范。
第二条国家食品药品监督管理总局医疗器械技术审评中心(以下简称中心)应按照本规范要求,结合审评工作实际情况,制定相应的质量方针、质量目标,建立健全与审评工作相适应的质量管理体系,并保证其有效运行。
第三条中心应结合自身工作实际,不断对内部体制机制进行评价,逐步创新医疗器械技术审评模式,调整优化审评流程,提升审评队伍能力,合理配置审评资源,完善各项管理制度,不断提高审评工作质量。
第四条将风险管理贯通于医疗器械技术审评工作的全过程,对工作过程中的风险点进行分析识别和评价,有针对性地制定风险控制措施。
第五条中心全体工作人员应当增强质量管理意识,认真履行职责,充分发挥主观能动性,确保医疗器械技术审评质量管理体系的有效运行。
第二章审评部门和职责第六条建立与医疗器械技术审评工作相适应的管理部门,明确各级领导和各部门的职责和权限,责权清晰。
第七条中心主要负责人是医疗器械技术审评质量的主要责任人,应当履行以下职责:(一)组织制定中心的质量方针和质量目标 ,确保质量管理体系运行的有效性;(二)确保质量管理体系有效运行所需的经费、人力资源、基础设施和工作环境等;(三) 组织实施管理评审,定期对医疗器械技术审评质量管理体系运行情况进行评估,并推动持续改进;(四)在对医疗器械技术审评工作的质量管理中强调过程方法和风险意识。
(五) 严格按照像关法律、法规和规章的要求组织实施医疗器械技术审评工作,确保质量管理体系与业务工作的有效融合,并实现预期结果。

关于《医疗器械优先审批程序》医疗器械技术审评中心关于《医疗器械优先审批程序》医疗器械技术审评中心1. 引言医疗器械在现代医疗领域起着非常重要的作用,然而,医疗器械的市场准入一直是一个严格的审批过程。
为了更好地推动医疗器械的研发和上市流程,医疗器械技术审评中心制定了《医疗器械优先审批程序》。
2. 优先审批程序的背景在过去的医疗器械审批过程中,长时间的审批周期和繁琐的审批程序导致了市场推广的困难,也影响了医疗器械技术创新的速度和效率。
为了解决这个问题,医疗器械技术审评中心引入了优先审批程序。
3. 优先审批程序的目标《医疗器械优先审批程序》的目标是缩短医疗器械的审批时间,降低市场准入门槛,促进医疗器械技术的创新和发展。
通过优先审批程序,有助于加快医疗器械的研发和上市流程,提高医疗器械的市场竞争力。
4. 优先审批程序的适用范围优先审批程序适用于符合以下条件的医疗器械:属于新的技术类别或不存在同类产品;具有重大创新性和独特性;对公众健康有重要意义。
5. 优先审批程序的申请流程5.1 申请材料准备申请人需要准备完整的医疗器械注册申请材料,包括但不限于以下内容:产品技术文件;临床试验数据;生产质量管理体系证明;医疗器械安全性评价报告;医疗器械有效性评价报告。
5.2 申请提交申请人将准备好的申请材料通过电子方式提交给医疗器械技术审评中心。
申请人需要确保申请材料的准确性和完整性。
5.3 申请审核医疗器械技术审评中心将对申请材料进行审核,包括对技术文件、临床试验数据、生产质量管理体系证明、医疗器械安全性评价报告和有效性评价报告的综合评估。
5.4 审批结果公示医疗器械技术审评中心将根据审核结果决定是否通过申请,并将审批结果公示,包括但不限于:审批通过的医疗器械产品名称;审批通过的医疗器械产品类别;审批通过的医疗器械产品特征。
6. 优先审批程序的优势6.1 加快审批速度通过优先审批程序,可以缩短医疗器械的审批时间,从而使医疗器械更快地进入市场,满足患者的需求。

医疗器械技术审评中心审评岗位职责与工作规程(试行) 1.审评岗位职责:
(1)负责接收和审核医疗器械技术审评申请文件,包括申请书、技术
文件等;
(2)根据国家相关法规和规范,对申请文件进行全面评估和分析;
(3)参与组织或参与技术审查会议,对技术问题进行讨论和解决;
(4)撰写技术评估报告,对医疗器械产品的安全性、有效性、质量和
性能进行评价;
(5)参与制定和修订相关的技术标准和规范;
(6)参与与医疗器械技术审评相关的培训和学术交流活动;
(7)参与处理医疗器械技术审评的纠纷和复查工作。
2.工作规程:
(1)审评人员应具备相关医学、生物医学工程、临床医学等专业背景
及技术评估能力;
(2)审评人员应遵守职业道德规范,保守申请者的商业秘密,确保评
审工作的公正、客观和保密;
(3)审评人员应按照相关的流程和标准,进行技术文件的评估与审查;
(4)审评人员应加强学习和自我提升,不断更新医疗器械技术审评的
知识和技能;
(5)审评人员应积极参与团队合作,共同完成审评任务,并遵守工作分配和时间要求;
(6)审评人员应及时准确地撰写技术评估报告,并按照要求审核和提交审批。
审评中心将根据实际工作需要不断完善和调整审评岗位的职责和工作规程,确保医疗器械技术审评工作的科学性和公正性。
同时,审评岗位也要求审评人员具备扎实的专业知识和技术评估能力,以保障医疗器械产品的用户安全和医疗保障的质量。

1416期-2:【关注】医疗器械技术审评专家候选人名单公布,有你认识的吗?近日,国家食品药品监督管理总局医疗器械技术器审中心(CMDE)发布了《关于公示医疗器械技术审评专家咨询委员会第一批委员候选人名单的通知》(以下简称“通知”)。
《通知》指出,根据总局颁布的《医疗器械技术审评专家咨询委员会管理办法》(以下简称“办法”)第三条“国家食品药品监督管理总局医疗器械技术审评中心承担专家咨询委员会的组建、委员遴选与增补等工作”要求,CMDE按办法规定的遴选条件及程序,依据科学发展、技术进步以及审评工作的需要,开展了专家委员候选人遴选工作,拟设立17个专家咨询委员会,共征集专家委员候选人819人,包括25名院士。
其中,共有2个专家咨询委员会候选人名单人数过百,分别为外科用医疗器械专家咨询委员会(共111人)以及体外诊断试剂专家咨询委员会委员(共105人)。
具体名单如下:有源设备工程专家咨询委员会委员候选人名单(共52人,包含2名院士)医用材料工程专家咨询委员会委员候选人名单(共88人,包含6名院士)医疗器械生物学评价专家咨询委员会委员候选人名单(共27人,包含1名院士)体外诊断试剂专家咨询委员会委员候选人名单(共105人,包含3名院士)内科用医疗器械专家咨询委员会候选人名单(共99人,包含5名院士)外科用医疗器械专家咨询委员会候选人名单(共111人,包含4名院士)骨科用医疗器械专家咨询委员会候选人名单(共78人,包含1名院士)妇产科用医疗器械专家咨询委员会候选人名单(共25人)儿科用医疗器械专家咨询委员会候选人名单(共10人)眼科用医疗器械专家咨询委员会候选人名单(共42人,包含1名院士)耳鼻喉科用医疗器械专家咨询委员会候选人名单(共14人,包含1名院士)口腔科用医疗器械专家咨询委员会候选人名单(共33人)整形美容用医疗器械专家咨询委员会候选人名单(共21人)肿瘤科用医疗器械专家咨询委员会候选人名单(共33人,包含1名院士)麻醉科用医疗器械专家咨询委员会候选人名单(共15人)医学影像用医疗器械专家咨询委员会候选人名单(共22人)辅助用医疗器械专家咨询委员会候选人名单(共44人)2017年3月28日,CFDA正式发布了《医疗器械技术审评专家咨询委员会管理办法》(以下简称办法)。

关于发布医疗器械注册审评补正资料要求管理规范的通告(2020年第1号)2020-01-16 14:00为贯彻落实医疗器械审评审批制度改革相关要求,提高医疗器械技术审评工作的质量和效率,进一步规范医疗器械注册技术审评过程中涉及的补正通知和补充资料过程,结合我国医疗器械技术审评工作现状制定了《医疗器械注册审评补正资料要求管理规范》,现予以发布。
国家药品监督管理局医疗器械技术审评中心2020年1月14日医疗器械注册审评补正资料要求管理规范一、前言根据《医疗器械注册管理办法》第三十五条和《体外诊断试剂注册管理办法》第四十五条要求,技术审评过程中需要申请人补正资料的,技术审评机构应当一次告知需要补正的全部内容,申请人应当在一年内按照补正通知的要求一次提供补充资料。
在实际工作中,审评人员针对注册申报项目发出补正通知和申请人/注册人按补正通知要求准备并提交补充资料是医疗器械技术审评过程的重要环节。
为提高医疗器械技术审评工作的质量和效率,结合我国医疗器械技术审评工作程序及相关要求,进一步规范发出补正通知过程(以下简称发补)和补充资料准备及提交(以下简称补回)过程,特制定本规范文件,为审评人员发出补正通知提供参考,同时申请人/注册人在充分理解相关要求的基础上按补正通知要求进行客观、完整答复。
对于首次注册、许可事项变更、临床试验审批等申请事项,原则上应给予申请人/注册人一次补充资料的机会。
本规范是对医疗器械技术审评人员和申请人/注册人的指导性文件,不包括注册审批所涉及的行政事项,亦不作为法规强制执行。
除本文要求外,还应遵循有关补正程序的其他规章或规范性文件要求。
随着法规规章、技术审评要求的不断完善,本文内容也将适时进行调整。
二、适用范围本规范适用于医疗器械(含体外诊断试剂)首次注册、许可事项变更、延续注册、临床试验审批等申请事项涉及发补和补回的过程。
本规范中的发补过程是指在医疗器械技术审评过程中,由于申请人/注册人所提交的注册申报资料不能满足法规规章或相关审评要求,无法证明申报项目的安全性、有效性,审评人员以“医疗器械补正资料通知”的形式告知申请人/注册人提交相关补充资料的过程。

医疗器械技术审评中心创新医疗器械特别审查申请审查操作规范第一章总则第一条根据《创新医疗器械特别审查程序》相关要求,为推进创新医疗器械的审查工作,保证创新医疗器械审查工作的科学、公正、公开、公平,特制定本规范。
第二条本规范所称的审查系指依据《创新医疗器械特别审查程序》相关要求,对创新医疗器械特别审查申请(以下简称“创新申请”)组织专家进行审查,并提出审查意见的过程。
第二章审查机构组成及职责第三条国家药品监督管理局医疗器械技术审评中心(以下简称“中心”)设立创新医疗器械审查办公室(以下简称“审查办”),审查办由中心副主任牵头负责,成员包括国家药品监督管理局医疗器械注册管理司注册处负责人,中心各审评部主要负责人,中国生物医学工程学会和中国生物材料学会(以下均简称“学会”)相关负责人等。
第四条审查办主要职责:一、对创新申请资料进行预审;二、组织专家对创新申请进行审查,并对专家意见进行确认;三、对拟同意进行特别审查的申请项目进行公示;四、将经审查办成员办公会(以下简称“办公会”)确认后的审查结果通过中心网站告知申请人。
审查办日常工作由中心综合业务处负责,各审评部提供必要技术支持。
第三章专家审查要求第五条创新医疗器械特别审查以专家审查为主,专家审查实行组长负责制。
专家组人数一般为5-7人,专家从事的研究领域应与申报产品相匹配。
第六条专家组对申请人提供的申请资料进行审查,审查结论分为同意或不同意。
专家组成员按专业领域提出个人审查意见,专家组组长综合成员意见后形成综合审查意见。
对于有异议的专家个人意见可予以保留。
第七条专家审查结论为同意的,专家组同时确认其创新点及临床应用价值,相关审评部对产品名称及管理类别进行初步判断。
第八条参与审查人员应严格遵守保密规定,不得泄露审查专家名单或产品技术资料等。
审查结论未正式公布前不得泄露。
第四章专家选取原则第九条专家组专业及人数需求由中心和学会联合确定,参会专家通过中心专家管理系统随机盲选形成。

医疗器械技术审评专家咨询函审通知专家:国家食品药品监督管理局医疗器械技术审评中心是国家食品药品监督管理局负责对申请注册的进口医疗器械产品、医疗器械新产品、国产第三类医疗器械产品进行技术审评的直属机构。
工作的基本依据为《医疗器械监督管理条例》和《医疗器械注册管理办法》等相关规章,详情请查阅网。
我中心决定对(受理号:)进行函审,诚邀您作为本次函审的专家,希望您通过审阅邮寄给您的相关资料,对我们提出的咨询问题发表书面意见,如该申报资料中存在其它问题,请一并提出。
为了做好本次函审工作,现就有关事宜通知如下:一、请您务必在接到本通知和相关资料(附后)后,于年月日(星期)前将回执传真至我中心,或者通过电话方式告知我中心已收悉。
二、在进行函审时,请您注意以下事项:1、请您根据附后的函审资料在“医疗器械技术审评专家咨询意见表”中填写专家意见,并在规定时间内(一般为收到资料后10个工作日内)将函审书面意见寄回我中心;2、请您签署《专家承诺书》等文件(附后),并将《专家承诺书》等文件随注册申报资料一并寄回我中心;3、本通知所附快递到付单供您邮寄资料时使用,费用由我中心支付;4、请您将专家签字表填写完整,以供我中心报销使用。
5、请您在回执中写明您的银行账号,我们将向您所提供的账号中支付专家审评费,届时请注意查收。
感谢您对我们工作的支持!国家食品药品监督管理局医疗器械技术审评中心年月日电话:联系人:传真:地址:邮编:100044 ———————————————————————————回执:受理号为的产品函审通知及所附资料已于年月日全部收悉。
本人将按照要求及时将函审意见及相关资料寄回。
专家审评费汇入账号:(注:该账号仅限于在中国工商银行、中国建设银行或中国银行开设的账号)专家签名:年月日。


江西省药品监督管理局关于公布江西省医疗器械审评咨询专家库专家名单的通知正文:---------------------------------------------------------------------------------------------------------------------------------------------------- 江西省药品监督管理局关于公布江西省医疗器械审评咨询专家库专家名单的通知赣药监械注〔2021〕19号各设区市、赣江新区、省直管试点县(市)市场监督管理局,各有关单位:为保证医疗器械技术审评工作依法、科学、高效、公正,推动我省医疗器械产业高质量发展,经遴选和审核,决定将邱嘉旋等192人作为江西省医疗器械审评咨询专家库专家。
本次医疗器械审评咨询专家库建设工作按照“存量更新”和“新增遴选”两个步骤,兼顾了省直部门和各设区市相关单位。
我局重大、复杂医疗器械技术审评事项,将根据审评需要,从专家库中挑选专家召开专家咨询会,同时开展日常咨询工作。
各设区市、赣江新区、省直管试点县(市)市场监督管理局等单位如有相关工作需要,也可向我局申请使用专家库资源。
专家库实行动态管理,省局医疗器械注册处牵头组织药品认证审评中心等部门做好专家库的日常管理工作。
联系人:康明联系电话:*************附件:江西省医疗器械审评咨询专家库专家名单江西省药品监督管理局2021年10月22日附件江西省医疗器械审评咨询专家库专家名单序号姓名专业领域工作单位1邱嘉旋口腔颌面外科南昌大学第一附属医院2鄢艳肾内科南昌大学第一附属医院3唐城普外科南昌大学第一附属医院4李映良普外科南昌大学第一附属医院5段剑神经外科南昌大学第一附属医院6詹剑华烧伤科南昌大学第一附属医院7王艳霞烧伤科南昌大学第一附属医院8裴重刚眼科南昌大学第一附属医院9江红群耳鼻喉南昌大学第一附属医院10张志远耳鼻喉南昌大学第一附属医院11何林生产科南昌大学第一附属医院12张发明信息科南昌大学第一附属医院13李春超声医学科南昌大学第一附属医院14王建宁护理部南昌大学第一附属医院15程晓华临床试验研究中心南昌大学第一附属医院16冯珍康复科南昌大学第一附属医院17文冰口腔科南昌大学第一附属医院18何来昌放射科南昌大学第一附属医院19祝新根神经外科南昌大学第二附属医院20张焱神经外科南昌大学第二附属医院21卢明巍神经外科南昌大学第二附属医院22罗军康复医学科南昌大学第二附属医院23刘月辉耳鼻喉南昌大学第二附属医院24宋莉口腔科南昌大学第二附属医院25仲庐云口腔科南昌大学第二附属医院26郑玲莉口腔科南昌大学第二附属医院27黄年根消化内窥镜室南昌大学第二附属医院28宋凌菁泌尿外科南昌大学第二附属医院29谭布珍妇产科南昌大学第二附属医院30吴洁华ICU病房南昌大学第二附属医院31殷小龙眼科南昌大学第二附属医院32罗振中麻醉科南昌大学第二附属医院33吴庆骨科南昌大学第二附属医院34张贝消化内科南昌大学第二附属医院35魏明检验科南昌大学第二附属医院36熊晓云护理部南昌大学第二附属医院37杨立文整形美容科南昌大学第二附属医院38敖检根社会医学与卫生事业管理南昌大学第二附属医院39蔡平基建科南昌大学第四附属医院40徐江霞检验科南昌大学第四附属医院41陈南萍针灸南昌大学第四附属医院42魏洪武口腔医学南昌大学第四附属医院43李志勇药学南昌大学第四附属医院44付小君消化内科南昌大学第四附属医院45杨宏武神经内科南昌大学第四附属医院46陈凯云药物分析南昌大学第四附属医院47霍亚南内分泌科江西省人民医院48肖祖克呼吸内科江西省人民医院49姜敏临床医学(呼吸内科)江西省人民医院50钟爱民肾内科江西省人民医院51刘鸿肾内科江西省人民医院52汪国武耳鼻喉江西省人民医院53李蓉检验科江西省人民医院54桂晓美检验科江西省人民医院55刘小兵麻醉科江西省人民医院56张伟普外科江西省人民医院57朱遵伟泌尿外科江西省人民医院58徐荣春放射科江西省人民医院59付艺斌放射科江西省人民医院60杨春丽ICU江西省人民医院61赖全图B超室江西省人民医院62王文丁生物学江西省人民医院63胡建新药学江西省人民医院64王联辉电子与通信工程江西省人民医院65陈丽萍大内科江西省儿童医院66段君凯小儿心内科江西省儿童医院67柯江维检验科江西省儿童医院68林珊眼科江西省儿童医院69肖煜麻醉科江西省儿童医院70刘晓姝护理部江西省儿童医院71李岚呼吸科江西省儿童医院72王伟口腔科江西省中医院73薛汉荣呼吸科江西省中医院74余航康复科江西省中医院75余奕军麻醉科江西省中医院76姜浩医保科江西省中医院77陈洁病理科江西省中医院78王万春外科江西省中医院79黄世俊信息科江西省中医院80杨军平临床医学江西省中医院81孙前谱临床医学江西省中医院82杨安金中药学江西省中医院83黄淑晖医学遗传中心江西省妇幼保健院84辛才林辅助生殖科江西省妇幼保健院85汪利群生殖健康科江西省妇幼保健院86龚逞豪妇科江西省妇幼保健院87曾莹肿瘤科江西省妇幼保健院88李凌肿瘤科江西省妇幼保健院89杨健牙体牙髓病科南昌大学附属口腔医院90曾利伟口腔修复科南昌大学附属口腔医院91李东方口腔修复科南昌大学附属口腔医院92廖岚口腔医学、口腔材料学南昌大学附属口腔医院93李志华口腔正畸南昌大学附属口腔医院94王予江口腔医学南昌大学附属口腔医院95欧晓艳口腔医学南昌大学附属口腔医院96赵豫口腔医学南昌大学附属口腔医院97张齐龙神经内科江西省胸科医院98陈乐蓉内科学江西省胸科医院99刘珍琼医学检验江西省胸科医院100熊景良临床医学江西省胸科医院101韩斌德临床医学江西省胸科医院102宋军福临床医疗江西省胸科医院103廖银根药剂科江西省皮肤病专科医院104朱永军医学美容科江西省皮肤病专科医院105万祥辉检验科江西省肿瘤医院106唐清美骨伤江西省中西医结合医院107陈超丽眼科江西省中西医结合医院108廖琦外科南昌市第一医院109罗和国麻醉科南昌市第一医院110朱波产科南昌市第一医院111赵恒医疗系南昌市第一医院112姜梅护理学南昌市洪都中医院113占海燕中药江西省精神病院114俞慧强统计学南昌大学115黄鹏流行病与卫生统计学;循证医学南昌大学116郑辉烈流行病与卫生统计学南昌大学117段隆振信息工程学院南昌大学118夏春华药学南昌大学119赖卫华食品学院南昌大学120郑莉萍生殖医学南昌大学121刘峰化学南昌大学122胡剑材料学华东交通大学123敖海勇材料学华东交通大学124周建民仪器华东交通大学125胡国良机械工程华东交通大学126陈齐平机械工程华东交通大学127XXX 机械工程华东交通大学128邬冠华材料科学与工程南昌航空大学129徐勇材料加工工程南昌航空大学130宋仁杰有机化学南昌航空大学131陈学岗测试与光电工程学院南昌航空大学132陈哲材料化学南昌工程学院133付雪峰计算机科学与技术南昌工程学院134聂望计算机软件工程江西中医药大学135郑琴中药学江西中医药大学136章新友物理江西中医药大学137管咏梅药学江西中医药大学138郑里翔中西医结合基础江西中医药大学139张锐药物分析江西中医药大学140汪灿华机械工程江西中医药大学141严志宏分析化学江西中医药大学142方海红药学江西科技师范大学143杨禹哲理化专业室江西省检验检测认证总院144陈良炜医学计量江西省检验检测认证总院145张俊勇电气测量技术及仪表江西省检验检测认证总院146孙江晖仪表及测试系统江西省检验检测认证总院147兰海有源设备类:热学、低温技术;电子仪器江西省检验检测认证总院148周敬电子信息工程江西省检验检测认证总院149黄丽琼压力容器、工程力学江西省检验检测认证总院150聂文昕测控技术与仪器江西省检验检测认证总院151甘蓓生物化学与分子生物学江西省产品质量监督检测院152颜瑛动物科学江西省产品质量监督检测院153王磊食品科学与工程江西省产品质量监督检测院154林黛琴分析化学江西省产品质量监督检测院155缪延晖中药制药江西省质量和标准研究院156汪秋雨冶金工程江西省质量和标准研究院157刘杰临床医学江西省卫生健康检查评价中心158邓晰博软件工程江西省人社宣传中心159周晓软件工程江西省工业和信息产品监督检验院160靳亮微生物研究所江西省科学院161余炅中医外科江西省中医药研究院162熊钧计算机及应用江西省就业中心163李欣药学宜春市人民医院164万林峰药学宜春市人民医院165谢晓峰普外科上饶市立医院166陈怡坤消化内科上饶市人民医院167黄夏雨中医学、临床医学景德镇市中医医院168郑华临床医学景德镇市第二人民医院169周任兵预防医学鹰潭市人民医院170喻伟麟药学鹰潭市人民医院171李坤麻醉新余市人民医院172朱良辉药用植物江西省医疗器械检测中心,173朱才庆生物化工江西省医疗器械检测中心,174罗荣药物化学江西省医疗器械检测中心,175郭晟药理江西省医疗器械检测中心,176李艳药学江西省医疗器械检测中心,177肖小华中药药理江西省医疗器械检测中心,178王丽静中药学江西省医疗器械检测中心,179王晖中药学江西省医疗器械检测中心,180袁海铭中药学江西省医疗器械检测中心,181胡红刚药物分析江西省医疗器械检测中心,182张凌志生物医学工程江西省医疗器械检测中心,183周鹃应用化学江西省药品检查员中心184吴凡临床医学江西省药品检查员中心185蔡锦尚计算机科学与技术江西省药品检查员中心186梁国嫔药学江西省药品检查员中心187李存金药学江西省药品检查员中心188聂君华临床医学江西省药品不良反应监测中心189焦卫红食品机械江西省药品不良反应监测中心190钟长鸣药理江西省药品不良反应监测中心191刘宁药物分析江西省药品检验检测研究院192朱碧君化学制药江西省药品检验检测研究院——结束——。
重庆市职称改革办公室关于公布廖海燕等60人工程技术药品和医疗器械专业高级职称评审结果的通知
文章属性
•【制定机关】重庆市职称改革办公室
•【公布日期】2022.01.29
•【字号】渝职改办〔2022〕57号
•【施行日期】2022.01.29
•【效力等级】地方规范性文件
•【时效性】现行有效
•【主题分类】职业能力建设,专业技术人员管理
正文
重庆市职称改革办公室关于公布廖海燕等60人工程技术药品和医疗器械专业高级职称评审结果的通知
渝职改办〔2022〕57号各区县(自治县)职改办,市级有关部门人事(干部)处、有关大型企事业单位人力资源部门:
经重庆市工程技术药品和医疗器械专业副高级职称评审委员会2021年12月17日评审通过,市职称改革办公室公示、核准,现将评审通过的高级工程师人员名单予以公布:
渝中区:袁轲;
九龙坡区:罗礼平;
南岸区:杨江月、王涛、邬吉野、马小艳、李志雄、柳加兵、
许娟;
北碚区:廖海燕、童永亮;
长寿区:杨忠鑫、聂光辉、夏秦川、皮广东;
荣昌区:代宏东;
两江新区:杜梅霞、侯玉梅;
市卫生健康委:黄昕;
市药监局:沈锐、周利茗;
市人才交流服务中心:陈雯、孟超、蔡蓉、张荣、王腾飞、李莎、刘相花、李文红、邵卫国、秦德怀;
重庆化医集团:岳光、何庆芳、王勇、文娟、张荷丽、黄梦茜、邬杰明、周洁、张磊、荀松涛、李雪、胡训刚、刘桂香、雍贤茹、胡莉、吴华、陈正;
太极集团:罗诗遂、彭爽、万成、蔡群辉、杨天月、王红利、田晶、胡印;
北大医药(委托评审):王丹、孙二晓、胡瀚、邵波。
以上人员职称取得时间,从评委会评审通过之日起计算。
重庆市职称改革办公室
2022年1月29日。
医疗器械技术审评中心外聘技术审评人员管理规定(试行)2008-01-11 08:00一、为规范和加强对医疗器械技术审评中心(以下简称中心)外聘技术审评人员(以下简称外聘人员)的管理,制定本规定。
二、外聘人员系指,由省级药品监督管理部门或有关单位推荐,或以借调和其他方式在中心从事医疗器械技术审评工作的专业技术人员。
三、中心各部门、各有关人员及外聘人员均应遵守本规定。
四、因工作需要需外聘技术审评人员时,有关审评处应提出具体人员需求,经分管主任同意后,结合本规定的相关条件要求负责外聘人员的具体联系工作。
五、中心各有关部门的职责1、办公室负责外聘人员到岗离岗手续的办理及日常相关人事管理和有关存档资料的管理;负责外聘人员考核工作的组织与管理;负责外聘人员业务工作的总体管理与协调。
2、各有关审评部门结合本部门工作特点,制定并组织实施外聘人员的专业审评培训计划及相关考核工作;负责本部门外聘人员日常及业务工作的管理。
六、外聘人员应具备的条件1、具有强烈的社会责任感和良好的职业道德。
2、具有较强的工作责任感和良好的团队精神。
3、具有相关的学历及工作经历。
4、具有较强的科研或实际工作能力,较好的计算机操作水平及语言文字能力。
5、身体健康。
6、原则上聘用期限不少于六个月。
七、外聘人员的职责和基本工作要求1、外聘人员应按照中心整体安排,参加中心组织的基础培训,并在审评部门指导下,参加审评员岗位的专业审评培训。
2、外聘人员参照中心审评员岗位要求履行职责。
3、外聘人员应严格遵守中心的各项规章制度及工作规范,接受相关部门的管理。
4、外聘人员应签署保密责任书(见附件1),严格遵守中心的各项保密规定,承担和履行保密责任和义务。
5、外聘人员持推荐表(见附件2)到中心报到上岗,原则上不得提前结束在中心的工作,因特殊原因需要提前结束时,需由推荐单位提出意见,向所在审评部门提出申请,该部门同意后报中心主任批准。
6、在中心工作期间,外聘人员若违反有关法律法规,或中心的规章制度,情节严重的,中心可将其退回,并通知其推荐单位。
医疗器械技术审评中心外聘专家管理办法第一章总则第一条为充分发挥医疗器械注册审评技术咨询专家的技术支撑作用,完善技术决策机制,更好地履行技术审评职能,明确咨询专家责任、权利、义务和管理要求,根据《国务院关于改革药品医疗器械审评审批制度的意见》(国发﹝2015﹞44号)和《中共中央办公厅国务院办公厅印发〈关于深化审评审批制度改革鼓励药品医疗器械创新的意见〉的通知》(厅字〔2017〕42号)规定,按照《国家药品监督管理局外聘专家管理暂行办法》(药监综人〔2 019〕47号)要求,借鉴国际经验,结合医疗器械注册审评工作实践,制定本办法。
第二条本办法所称外聘专家,是指按照规定程序选聘的,为医疗器械技术审评发挥技术支撑作用提供咨询服务,纳入医疗器械技术审评专家库(专家咨询委员会)管理的专家。
第三条国家药品监督管理局医疗器械技术审评中心(以下简称器审中心)设立医疗器械技术审评专家库(专家咨询委员会),负责外聘专家的遴选与增补、专家库(专家咨询委员会)日常运行、会议组织和服务等相关工作。
第四条外聘专家在履行职责时应当遵守科学、严谨、公平、公正的基本要求。
第五条根据技术审评工作需要,器审中心共设立17个专家咨询委员会(附件1),原则上以第三类医疗器械临床应用为导向划分。
第六条专家咨询委员会应当由涉及该专业领域的外聘专家组成,人数由器审中心依据实际情况确定。
第二章资格条件第七条外聘专家应当具备以下资格条件:(一)坚持原则,具有良好的职业道德,认真负责,廉洁公正,遵纪守法。
(二)在医疗器械所涉及相关学科,如医学、电子、材料、机电、声学、光学、药学、毒理、生物评价、生物统计等方面具有较深造诣、熟悉本专业国内外情况和发展趋势,具有高级专业技术职称或者同等专业水平。
(三)熟悉医疗器械法律法规和相关政策要求。
(四)能保证按要求承担和完成医疗器械注册审评技术咨询等相关工作,按时参加相关会议。
(五)身体健康,年龄在65岁以下;专业领域内的资深专家、两院院士等可不受年龄限制。