蛋白质等电点测定(参考资料)
- 格式:doc
- 大小:111.50 KB
- 文档页数:7

实验六蛋白质等电点测定一、实验目的掌握蛋白质等电点的测定方法及其原理;了解等电点的意义及其与分子聚沉能力的关系。
二、实验原理蛋白质同氨基酸一样,是两性电解质,在不同的pH 水溶液中解离后所带正、负电荷不同。
调节溶液的酸碱度达到一定的氢离子浓度时,蛋白质分子所带的正电荷和负电荷相等,以兼性离子状态出现,在电场内该蛋白质分子既不向阴极移动,也不向阳极移动,这时溶液的pH 值称为该蛋白质的等电点(pI)。
各种蛋白质具有特定的等电点,这时和它所含的氨基酸的种类和数量有关。
如蛋白质分子中含碱性氨基酸较多,其等电点偏碱。
例如从雄性鱼类成熟精子中提取的鱼精蛋白含精氨酸特多,其等电点为12.0~12.4。
如蛋白质分子中含酸性氨基酸较多,则其等电点偏酸。
例如胃蛋白酶含酸性氨基酸残基为37个,而碱性氨基酸残基仅含6个,其等电点为1.0左右。
含酸性和碱性氨基酸残基数目相近的蛋白质,其等电点大多为中性偏酸,约5.0左右。
蛋白质等电点多接近于pH7.0,略偏酸性的等电点也较多。
处于等电点的蛋白质表现电中性,所以在溶液中的稳定性很低,容易沉淀析出。
将酪蛋白溶液分置于连续不同的pH 环境中,通过观察混浊程度可测得酪蛋白的等电点。
三、实验器材1.仪器:试管和试管架、滴管、吸管(1和5mL)、容量瓶。
2.材料:蛋白质。
3.试剂:酪蛋白醋酸钠溶液、0.01mol/L 醋酸溶液、1.00mol/L 醋酸溶液、0.10mol/L 醋酸溶液、1.00mol/L 氢氧化钠溶液。
四、实验步骤取9支粗细相近的干燥试管,编好号后按表5-1的顺序准确地加入各种试剂。
加完后观察上述各管的混浊程度,静置约20min,再视其沉淀情况,以-,+,++,+++,++++符号表示沉淀的多少;根据观察的结果,指出哪一个pH是酪蛋白的等电点(混浊显著或静置后沉淀最多,上部溶液变得最清亮一管的pH 值,即为酪蛋白的等电点);该试管要求各种试剂的浓度和加入量必须相当准确。

实验一蛋白质的等电点测定一.实验目的1.掌握蛋白质的两性解离性质2.学习测定蛋白质等电点的方法二.实验原理蛋白质是两性电解质,在溶液中存在下列平衡:pH>pI pH = pI pH<pI蛋白质分子的解离状态和解离程度受溶液酸碱度(pH值)的影响。
当溶液的pH达到一定数值时,其颗粒上的正负电荷数目相等,在电场中,既不向阴极移动,也不向阳极移动,此时溶液的pH值称为此种蛋白质的等电点。
不同蛋白质各有其特异的等电点。
在等电点时,蛋白质的理化性质都有变化,如:在等电点条件下,蛋白质的电导性、溶解度最小,粘度最大。
可利用此种性质的变化测定各种蛋白质的等电点。
最常用的方法是测其溶解度最低时的溶液pH值。
本实验通过观察不同pH溶液中的溶解度来测定酪蛋白的等电点。
用醋酸与醋酸钠(醋酸钠混合在酪蛋白溶液中)配制成各种不同pH值的缓冲溶液。
向各种不同的缓冲液中加入酪蛋白后。
沉淀出现最多的缓冲液的pH值即为酪蛋白的等电点。
三.实验器材:水浴锅、温度计、200ml锥形瓶、100ml容量瓶、吸管、试管等四.试剂与材料:1.材料:酪蛋白2.试剂:(1)0.4%酪蛋白醋酸钠溶液称取0.4g酪蛋白,加1mol/LNaOH10ml使其完全溶解,加水50ml,再缓慢加1mol/LHAc10ml(边加边搅拌,NaOH和 HAc的浓度和体积必须准确,加HAc时一定要慢),定溶至100 ml。
(2)1.00mol/L醋酸溶液(3)0.10mol/L醋酸溶液(4)0.01mol/L醋酸溶液五.实验步骤:(1)取同样规格的试管4支并编号,按下表顺序精确加入各试剂并混匀试管号蒸馏水(ml)0.01mol/LHAc(ml)0.10mol/LHAc(ml)1.00mol/LHAc(ml)1 8.4 0.6 - -2 8.7 - 0.3 -3 8.0 - 1.0 -4 7.4 - - 1.6(2)向以上试管中各加入酪蛋白醋酸钠溶液1ml,加一管,摇匀一管。

课程:基础生物化学实验学院:班级:学号:姓名:成绩:评阅教师:实验一蛋白质的等电点和含量测定1.蛋白质的等电点测定(pH值沉淀法)一、实验目的1.学习和掌握蛋白质的两性解离性质。
2.掌握pH值法测定蛋白质等电点的一般原理和操作方法。
二、实验原理三、试剂与仪器、耗材1.试剂2.仪器耗材四、实验方法取4支同样规格的试管,按下表顺序分别精确地加入各试剂,加入后立即混匀,加一管,摇匀一管。
静置,观察各管在不同时间的混浊度。
观察时可用+,++,+++,表示浑浊度。
表1试剂管号H2O/mL0.01mol/LHAC/mL0.10mol/LHAC/mL1.00mol/LHAC/mLpH蛋白质溶液/mL观察现象0 min 10 min 20 min1234五、实验结果、计算与分析1.观察各管中清澈度变化,记录结果并解释现象.2.确定酪蛋白的等电点。
六、思考题蛋白质在等电点沉淀的原因是什么?影响该实验结果准确性的因素有哪些?2. 双缩脲法测定蛋白质含量一、实验目的1.学习双缩脲法测定蛋白质浓度的基本原理。
2.学习和掌握双缩脲法测定蛋白质浓度的实验操作方法。
二、实验原理三、试剂与仪器、耗材1.试剂2.仪器耗材四、实验方法1.制标准曲线取试管6支,编号0-5,按下表顺序加入各试剂。
表2试管试剂/mL0 1 2 3 4 5标准牛血清白蛋白0.0 0.4 0.8 1.2 1.6 2.0 蒸馏水 2.0 1.6 1.2 0.8 0.4 0.0 双缩脲试剂 4.0 4.0 4.0 4.0 4.0 4.0 蛋白质含量 mg/mL 0.0 2.0 4.0 6.0 8.0 10.0上述试剂加完后,充分混匀,室温放置30 min。
以0号管为对照管,于540 nm处比色测定吸光值,记下各管吸光度,以每管蛋白质含量为横坐标,对应吸光度为纵坐标,作吸光度-蛋白质含量标准曲线。
2.样品测定五、实验结果、计算与分析1.使用Excel程序绘制标准曲线,计算回归方程。

蛋白质等电点的测定实验报告一、实验目的。
本实验旨在通过离子交换色谱法测定蛋白质的等电点,探究蛋白质在不同 pH 条件下的电荷状态变化,进而确定蛋白质的等电点。
二、实验原理。
蛋白质的等电点是指蛋白质在溶液中呈电中性的 pH 值。
在等电点条件下,蛋白质的带电量最小,导致其在电场作用下停止迁移。
本实验采用离子交换色谱法,利用色谱柱对蛋白质在不同 pH 条件下的迁移情况进行监测,从而确定蛋白质的等电点。
三、实验步骤。
1. 将色谱柱连接至色谱仪,并进行平衡处理;2. 取一定浓度的蛋白质溶液,分别调节 pH 值至不同条件下;3. 将不同 pH 条件下的蛋白质溶液加入色谱柱,进行色谱分离;4. 监测蛋白质在色谱柱中的迁移情况,记录不同 pH 条件下的保留时间;5. 根据实验数据绘制蛋白质的等电点曲线,确定蛋白质的等电点。
四、实验数据及结果分析。
通过实验数据处理和分析,我们得到了不同 pH 条件下蛋白质的保留时间,绘制出了蛋白质的等电点曲线。
通过曲线的交叉点,我们可以确定蛋白质的等电点为X。
五、实验结论。
根据实验结果,我们成功测定出了蛋白质的等电点为 X。
这一结果对于进一步研究蛋白质的性质和功能具有重要意义。
六、实验总结。
本实验通过离子交换色谱法测定蛋白质的等电点,取得了较好的实验结果。
然而,在实验过程中仍然存在一些问题,例如实验操作的精度和准确度有待提高。
未来我们将进一步完善实验方法,提高实验数据的可靠性和准确性。
七、参考文献。
1. Smith, A. B., & Jones, C. D. (2017). A review of protein isoelectric focusing: methods, applications, and advances. Critical Reviews in Biotechnology, 37(4), 399-408.2. Wang, L., & Smith, R. (2019). Determination of protein isoelectric point by capillary isoelectric focusing. Journal of Chromatography A, 1601, 132-137.八、致谢。
蛋白质等电点测定及性质实验一、目的:了解等电点的意义及其与蛋白质分子聚沉能力的关系。
初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。
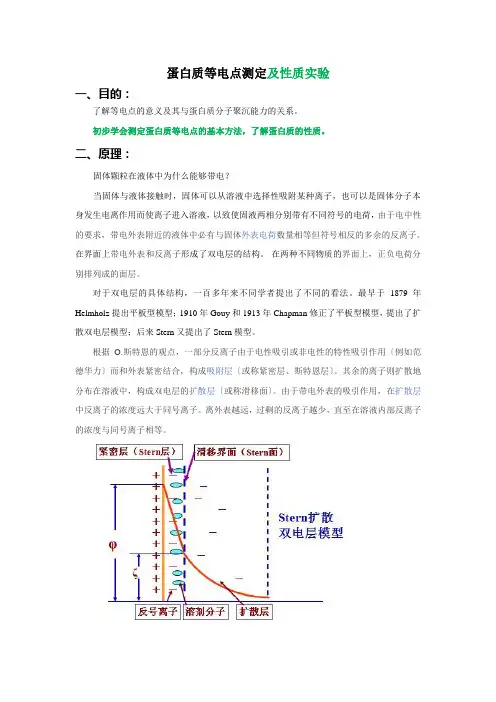
二、原理:固体颗粒在液体中为什么能够带电?当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,由于电中性的要求,带电外表附近的液体中必有与固体外表电荷数量相等但符号相反的多余的反离子。
在界面上带电外表和反离子形成了双电层的结构。
在两种不同物质的界面上,正负电荷分别排列成的面层。
对于双电层的具体结构,一百多年来不同学者提出了不同的看法。
最早于1879年Helmholz提出平板型模型;1910年Gouy和1913年Chapman修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。
根据O.斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用〔例如范德华力〕而和外表紧密结合,构成吸附层〔或称紧密层、斯特恩层〕。
其余的离子则扩散地分布在溶液中,构成双电层的扩散层〔或称滑移面〕。
由于带电外表的吸引作用,在扩散层中反离子的浓度远大于同号离子。
离外表越远,过剩的反离子越少,直至在溶液内部反离子的浓度与同号离子相等。
紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧密吸附在固体外表上。
其余反离子则构成扩散层。
滑动面:指固液两相发生相对移动的界面,是凹凸不平的曲面。
滑动面至溶液本体间的电势差称为ζ电势。
固体颗粒带电量的大小及测量方式?ζ电势只有在固液两相发生相对移动时才能呈现出来。
ζ电势的大小由Zeta电位表示,其数值的大小反映了胶粒带电的程度,其数值越高说明胶粒带电越多,扩散层越厚。
一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。
对于蛋白质分子来说:蛋白质分子的大小在胶粒范围内,约1~100微米。

蛋白质等电点测定实验报告一、实验目的。
本实验旨在通过等电点测定方法,探究蛋白质在不同pH值下的电荷性质,从而确定其等电点,并通过实验数据的分析,加深对蛋白质分子结构与功能的理解。
二、实验原理。
蛋白质的等电点是指在特定pH值下,蛋白质分子带有零净电荷的状态。
当pH 值等于蛋白质的等电点时,蛋白质分子中的阳离子与阴离子数目相等,呈中性状态。
在此pH值下,蛋白质分子在电场中不受力的作用,因而在电泳过程中停滞不动。
因此,通过等电点测定,可以得到蛋白质的等电点。
三、实验步骤。
1. 制备蛋白质溶液,取适量蛋白质样品,加入适量缓冲液,使得蛋白质浓度为1mg/ml。
2. 调节pH值,将蛋白质溶液分别加入不同pH值的缓冲液中,使得溶液的pH值分别为2、4、6、8、10和12。
3. 电泳,将调节好pH值的蛋白质溶液加载至等电聚丙烯酰胺凝胶电泳板上,进行电泳分离。
4. 染色观察,电泳结束后,将凝胶板取出,进行染色观察,记录蛋白质在不同pH值下的迁移情况。
四、实验结果与分析。
通过实验数据的分析,可以得到蛋白质在不同pH值下的迁移情况。
当蛋白质分子带有净电荷时,会受到电场的作用而发生迁移。
而在等电点附近,蛋白质分子呈中性状态,不受电场作用而停滞不动。
因此,通过观察凝胶板上蛋白质的迁移情况,可以确定蛋白质的等电点。
五、实验结论。
通过本次实验,我们成功确定了蛋白质的等电点,并得到了蛋白质在不同pH 值下的电荷性质。
这对于进一步研究蛋白质的结构与功能具有重要意义,也为蛋白质的纯化与分离提供了重要依据。
六、实验注意事项。
1. 实验过程中需注意操作规范,避免蛋白质溶液的污染。
2. 实验中所用的缓冲液需提前调节好pH值,确保实验的准确性。
3. 在电泳过程中需注意电场的设置,确保实验结果的可靠性。
七、参考文献。
1. Berg, J. M., Tymoczko, J. L., & Gatto, G. J. (2002). Biochemistry (5th edition). WH Freeman.2. 王志刚, 张立志, & 王斌. (2003). 生物化学实验教程. 高等教育出版社.以上为蛋白质等电点测定实验报告。

常见蛋白质等电点参考值氨基酸的解离常数和等电点辣根过氧化物酶过氧化物酶,酶学分类号为EC 1.11.1.7。
该酶催化Donor+ H2O2--→Oxidized donor+2 H2O。
过氧化物酶,通常来源于辣根(因此称辣根过氧化物酶),是临床检验试剂中的常用酶。
该产品不但广泛用于多个生化检测项目,也广泛运用于免疫类(ELISA)试剂盒。
过氧化物酶作为多个试剂盒显色体系的关键成分,对试剂盒的质量有重要影响。
辣根过氧化物酶(Horseradish Peroxidase, HRP)比活性高,稳定,分子量小,纯酶容易制备,所以最常用。
HRP广泛分布于植物界,辣根中含量高,它是由无色的酶蛋白和棕色的铁卟啉结合而成的糖蛋白,糖含量18%。
HRP由多个同功酶组成,分子量为40,000,等电点为PH3~9,酶催化的最适PH因供氢体不同而稍有差异,但多在PH5左右。
酶溶于水和58%以下饱和度硫酸铵溶液。
HRP的辅基和酶蛋白最大吸收光谱分别为403nm和275nm,一般以OD403nm /OD275nm的比值RZ(德文Reinheit Zahl)表示酶的纯度。
高纯度的酶RZ值应在3.0左右(最高可达3.4)。
RZ值越小,非酶蛋白就越多。
英文名称:Glucose oxidase;GOX;GODCAS号:9001-37-0分子量:15.4~16万KDa(SDS-PAGE中约80KDa,等电点4.6)活力:100~250u/mg酶活定义:37℃,PH5.7条件下,每分钟形成1umol过氧化氢所需要的酶量Solubility (1%, Water):PassPH稳定性:4.5~6.5最佳PH:5.5热稳定性:<50℃(PH7.0,15min)最适作用温度30℃~60℃使用方法:测活时,用10mM 柠檬酸钠缓冲液(PH5.7)溶解冻干粉末性状:黄色粉末。
一种能氧化葡萄糖生成葡萄糖酸的氧化还原酶。
该酶需黄素腺嘌呤二核苷酸(FAD)作为辅酶,每个分子中含两个FAD。

等电点聚焦测蛋白质等电点一.实验目的1.了解蛋白质的两性解离性质和等电点聚焦的原理;2. 学习测定蛋白质等电点的方法并掌握圆盘电泳技术。
二.实验原理等电点聚焦(IEF)是在电场中分离蛋白质技术的一个重要发展,IEF实质就是在稳定的pH梯度中按等电点的不同分离两性大分子的平衡电泳方法。
在电场中充有两性载体和抗对流介质,当加上电场后,由于两性载体移动的结果,在两极之间逐步建立起稳定的pH梯度,当蛋白质分子或其它两性分子存在于这样的pH梯度中时,这种分子便会由于其表面电荷在此电场中运动,并最终到达一个使其表面静电荷为0的区带,这时的pH则是这种分子的pI。
聚焦在等电点的分子也会不断地扩散。
一旦偏离其等电点后,由于pH环境的改变,分子又立即得到正电荷或负电荷,从而又向pI迁移。
因此,这些分子总是处于不断地扩散和抗扩散的平衡之中,在pI处得以“聚焦”。
三.实验步骤1.凝胶制备按表1的比例配制4ml工作胶液,在真空干燥器中抽气10min。
每组4管,每管加胶液1.8ml。
混匀后立即注入到已准备好的凝胶管中,胶液加至离管顶部1cm 处,在胶面上再覆盖3mm厚的水层,应注意不要让水破坏胶的表面,室温下放置20~30min即可聚合。
表1 凝胶工作液配比凝胶母液(丙烯酰胺30%:甲叉双丙烯1ml酰胺0.8%)10%过硫酸铵0.02ml水 2.68ml载体两性电解液0.15ml蛋白样品液0.1ml,0.05mlTEMED 0.02ml2.电泳吸去凝胶柱表面上的水层,将凝胶管垂直固定于圆盘电泳槽中。
于电泳槽下槽加入0.2%的500ml硫酸作正极;上槽加入0.5%的800ml乙醇胺作负极打开电源,将电压恒定为300V,因为聚焦过程是电阻不断加大的过程,故聚焦电泳过程中,电流将不断下降,降至稳定时,即表明聚焦已完成,继续电泳约30min后,停止电泳,全程约需3h。
3.剥胶电泳结束后,取下凝胶管,用水洗去胶管两端的电极液,按照柱状电泳剥胶的方法取出胶条,以胶条的正极为“头”,负极为“尾”,正极端呈酸性,负极端呈碱性。

蛋白质等电点的测定实验报告一、实验目的1、了解蛋白质等电点的概念及其重要性。
2、掌握测定蛋白质等电点的基本原理和方法。
3、学会使用酸度计等仪器进行实验操作。
二、实验原理蛋白质是两性电解质,在溶液中会发生解离。
当蛋白质溶液处于某一 pH 值时,蛋白质解离成正、负离子的趋势相等,即净电荷为零,此时溶液的 pH 值称为该蛋白质的等电点(pI)。
在等电点时,蛋白质的溶解度最低,容易沉淀析出。
利用这一性质,可以通过调节溶液的 pH 值,使蛋白质沉淀,从而测定蛋白质的等电点。
本实验采用醋酸纤维素薄膜电泳法来测定蛋白质的等电点。
醋酸纤维素薄膜具有均一的微孔结构,对蛋白质分子的吸附作用小,电泳时泳动速度快,分辨率高。
在一定的电场强度下,不同 pH 值的缓冲溶液中,蛋白质分子会向与其所带电荷相反的电极方向移动。
当溶液的 pH值等于蛋白质的等电点时,蛋白质分子的净电荷为零,泳动速度为零。
三、实验材料与仪器1、材料新鲜鸡蛋醋酸纤维素薄膜巴比妥缓冲液(pH 86、pH 74、pH 64、pH 54)蛋白质染色液(氨基黑 10B)漂洗液2、仪器电泳仪酸度计培养皿镊子剪刀直尺四、实验步骤1、醋酸纤维素薄膜的处理将醋酸纤维素薄膜剪成 2×8cm 的小条,在巴比妥缓冲液(pH 86)中浸泡 30 分钟,使其充分浸透。
用镊子取出薄膜,用滤纸吸干多余的缓冲液。
2、点样用毛细管吸取少量鸡蛋清样品,在薄膜的无光泽面距一端 15cm 处轻轻点样,点样宽度不超过 05cm。
3、电泳将点样后的薄膜光滑面朝下,搭在电泳槽的支架上,两端分别与电泳槽的正、负极相连。
在电泳槽中加入巴比妥缓冲液(pH 86),使薄膜完全浸没在缓冲液中。
接通电源,调节电压为 160V,电泳 40 分钟。
4、染色与漂洗电泳结束后,将薄膜取出,放入氨基黑 10B 染色液中染色 10 分钟。
取出薄膜,放入漂洗液中漂洗数次,直至背景无色,蛋白质条带清晰可见。
5、测定 pH 值分别配制 pH 74、pH 64、pH 54 的巴比妥缓冲液。


蛋白质等电点的测定蛋白质是生命体内构成最广泛的一类生物大分子,具有各种生物功能。
在生物体内,蛋白质具有正负电荷,并在不同PH值的溶液中表现出不同的电性质。
蛋白质在pH等于其等电点时,蛋白质的电荷处于中性状态,亦是纯蛋白质最稳定的情况,因此准确测定蛋白质等电点对于分离、纯化和鉴定蛋白质具有重要意义。
本文中将介绍三种测定蛋白质等电点的方法。
方法1. 等电点电泳法等电点电泳法是一种电泳分离方法,利用蛋白质在不同pH值下的电荷变化探测其等电点。
该方法的原理为将蛋白质经过电泳分离,直到电泳缓冲液pH等于蛋白质的等电点,此时蛋白质处于中性带中心。
与常规电泳仪不同的是,该仪器在酸性电极和碱性电极之间加入溶液,以确保酸碱缓冲系统能够维持所需的pH值。
等电点电泳法可以快速而准确地测定蛋白质等电点,但需要特殊仪器和耗时较长,且样品纯度较高。
方法2. 等电聚焦法等电聚焦法是一种电泳技术,利用在连续的pH梯度中,使具有等电点的蛋白质依次停止迁移,从而分离蛋白质。
该方法的原理是,利用蛋白质在不同pH值下的等电点特性,将样品置于pH梯度中,通过电压控制,使蛋白质在等电点处停止迁移,从而实现蛋白质分离。
等电聚焦法具有高分辨率和高分离效率,同时还可以同时分离出等电点相似但分子量不同的蛋白质,但样品量较小,需要特殊仪器和大量控制。
方法3. pH梯度管柱法pH梯度管柱法是一种可溶性蛋白质的标准测定方法,也是等电点法中最广泛应用的方法之一。
该方法的基本原理是,在含有不同pH值的缓冲液梯度的柱子上,蛋白质会在不同的pH值时呈现出不同的电荷状态。
在pH值等于其等电点时,蛋白质处于中性状态,停止迁移。
通过检测蛋白质在不同pH值下的吸收值,可以确定样品的等电点。
pH梯度管柱法的优点包括样品量较大,操作简单,数据可靠,但分辨率较低,需要特殊的柱子。
三种测定蛋白质等电点的方法各有侧重,实验操作难度大小也不同,一般来说,选择合适的测定方法应根据样品特点和实验条件。
蛋自质的等电点测定一、实验目的了解蛋白质的两性解离性质。
学习测定蛋白质等电点的—种方法,加深对蛋白质胶体溶液稳定因素的认识。
了解沉淀蛋白质的几种力法。
二、实验原理蛋白质是两性电解质。
在蛋白质溶液中存在下列平衡:蛋白质分子的解离状态和解离程度受溶液的酸碱度影响。
当溶液的PH达到一定数值时.蛋由质颗粒上正负电荷的数目相等.在电场中,蛋白质既不向阴极移动,也不向阳极移动,此时溶液的PH称为此种蛋白质的等电点pI。
在等电点时.蛋白质的理化性质都有变化,可利用此性质测定各种蛋白质的等电点。
最常用的方法是测其溶解度最低时溶液的pH。
本实验通过观察酪蛋白在不同pH溶液下的溶解度以测定酪蛋白的等电点。
用乙酸与乙酸钠配制各种不同PH酌缓冲液。
向各缓冲溶液中加入酪蛋白(用乙酸钠溶液配制)后,沉泌出现最多的缓冲液的pH即为酪蛋白的等电点。
在水溶液中的蛋白质分子由于表面形成水化层和双电层而成为稳定的亲水胶体颗粒,在一定的理化因素影响下,蛋白质颗粒可因失去电荷和脱水而沉淀。
蛋白质的沉淀反应可分为两类。
(1)可逆的沉淀反应。
此时蛋白质分子的结构尚未发生显著变化,除去引起沉淀的因素后,蛋白质的沉淀仍能溶解于原来的溶剂中,并保持其天然性质而不变性。
例如,大多数蛋白质的盐析作用或在低温下用乙醇(或丙酮)短时间作用于蛋白质。
提纯蛋白质时,常利用此类反应。
(2)不可逆的沉淀反应。
此时蛋白质分子内部结构发生重大改变,蛋白质常变性而沉淀,不再溶于原来的溶剂中。
例如,加热引起的蛋白质沉淀与凝固、蛋白质与重金属离子或某些有机酸的反应都属于此类。
蛋白质变性后,有时由于维持溶液稳定的条件仍然存在(如电荷),并不析出。
因此变性蛋白质并不一定都表现为沉淀,而沉淀的蛋白质也未必都已变性。
三、实验用品(一)实验材料新鲜鸡蛋(二)器皿(1)水浴锅。
(2)温度计。
(3)研钵一套。
(4)吸管、洗耳球。
(5)试管:15mL×ll,试管架。
(6)移液管:1mL×8,10mL×1,0.1mL×1,1.5mL×1,2mL×2。
蛋白质等电点的测定实验报告蛋白质等电点的测定实验报告引言:蛋白质是生命体内最重要的有机物之一,它们在细胞结构、代谢、免疫等方面发挥着重要的作用。
了解蛋白质的性质对于研究生物学和医学具有重要意义。
蛋白质的等电点是指在特定条件下,蛋白质带有的净电荷为零的pH值。
本实验旨在通过测定蛋白质溶液在不同pH值下的电导率,确定蛋白质的等电点。
实验方法:1. 实验材料准备:- 酸性溶液:0.1 M HCl- 碱性溶液:0.1 M NaOH- 蛋白质溶液:选择一种常见的蛋白质溶液,如牛血清白蛋白溶液- pH计:用于测定溶液的pH值- 电导仪:用于测定溶液的电导率2. 实验步骤:1) 将蛋白质溶液分装到多个试管中,每个试管中的蛋白质溶液体积相同。
2) 在第一个试管中加入适量的酸性溶液,使其pH值降低。
3) 在第二个试管中加入适量的碱性溶液,使其pH值升高。
4) 分别用pH计测量每个试管中溶液的pH值,并记录下来。
5) 使用电导仪测量每个试管中溶液的电导率,并记录下来。
实验结果与讨论:通过实验测量,我们得到了蛋白质溶液在不同pH值下的电导率数据。
根据电导率的变化趋势,我们可以确定蛋白质的等电点。
在酸性条件下,蛋白质溶液的电导率较低。
这是因为在酸性环境中,蛋白质分子上的氨基酸会失去部分质子,带有正电荷。
这些正电荷相互排斥,导致蛋白质分子的空间结构发生改变,电导率降低。
随着pH值的升高,蛋白质分子上的氨基酸逐渐失去质子,带正电荷的氨基酸残基减少。
在接近等电点的pH值范围内,蛋白质溶液的电导率逐渐增加。
这是因为在等电点附近,蛋白质分子上的正电荷和负电荷相互抵消,净电荷为零。
此时,蛋白质分子的空间结构稳定,电导率达到最高点。
在碱性条件下,蛋白质溶液的电导率再次降低。
这是因为在碱性环境中,蛋白质分子上的羧基会失去部分质子,带有负电荷。
这些负电荷相互排斥,导致蛋白质分子的空间结构发生改变,电导率降低。
通过实验数据的分析,我们可以确定蛋白质的等电点。
一、实验目的1. 了解蛋白质等电点的概念及其与蛋白质分子聚沉能力的关系。
2. 掌握蛋白质等电点测定的原理和方法。
3. 通过实验,初步学会使用pH计测定蛋白质等电点。
二、实验原理蛋白质在溶液中带有电荷,其电荷性质与溶液的pH值有关。
当溶液的pH值等于蛋白质的等电点(pI)时,蛋白质分子所带正负电荷相等,净电荷为零,此时蛋白质分子处于稳定状态,溶解度最低,容易发生聚沉。
蛋白质的等电点是蛋白质的重要性质之一,对蛋白质的分离、纯化和应用具有重要意义。
实验原理基于以下反应:\[ \text{蛋白质} + \text{H}^+ \rightarrow \text{蛋白质}^+ \]\[ \text{蛋白质} + \text{OH}^- \rightarrow \text{蛋白质}^- \]当溶液的pH值等于蛋白质的pI时,蛋白质分子所带正负电荷相等,净电荷为零。
此时,蛋白质的溶解度最低,容易发生聚沉。
三、实验材料与仪器1. 实验材料:- 蛋白质溶液:鸡蛋清蛋白、牛血清白蛋白等。
- pH缓冲液:0.1 mol/L pH 2.0、4.0、6.0、8.0、10.0缓冲液。
- 0.1 mol/L HCl溶液。
- 0.1 mol/L NaOH溶液。
- 0.1 mol/L NaCl溶液。
- 0.1 mol/L CaCl2溶液。
2. 实验仪器:- pH计。
- 移液器。
- 容量瓶。
- 烧杯。
- 滴定管。
四、实验步骤1. 准备蛋白质溶液:将鸡蛋清蛋白或牛血清白蛋白溶解于0.1 mol/L NaCl溶液中,配制成一定浓度的蛋白质溶液。
2. 设置pH缓冲液:将pH缓冲液稀释至0.1 mol/L,分别配制pH 2.0、4.0、6.0、8.0、10.0的缓冲液。
3. 测定蛋白质等电点:- 分别取5份蛋白质溶液,用pH计测定其pH值。
- 将pH缓冲液加入蛋白质溶液中,逐滴加入0.1 mol/L HCl溶液或NaOH溶液,调节蛋白质溶液的pH值。
实验报告等电点聚焦测蛋白质等电点引言:蛋白质是生物体中一类重要的生物大分子,它们的功能和性质与其结构密切相关。
等电点是指蛋白质在溶液中存在时呈电荷中性的pH值。
当蛋白质的溶液中pH等于它的等电点时,蛋白质的正电荷和负电荷相等,从而净电荷为0。
等电点测定是一种常用的方法,用于确定蛋白质的等电点。
实验目的:1.掌握等电点聚焦技术的原理和操作方法。
2.利用等电点聚焦技术测定其中一种蛋白质的等电点。
材料与方法:1.实验仪器:等电点聚焦仪。
2.实验试剂:蛋白质样品、等电点聚焦凝胶、聚丙烯酰胺凝胶、溶液缓冲液等。
3.样品制备:取适量的蛋白质样品,加入等电点样品溶液缓冲液,使其浓度适当。
4.等电点聚焦凝胶制备:根据实验需要,选择适当的pH梯度,制备等电点聚焦凝胶。
5.实验操作:将已制备好的等电点聚焦凝胶放置于等电点聚焦仪中,按照仪器操作说明进行调试和操作。
将样品加载到凝胶上,通过电场力使其在凝胶中聚焦移动,最终形成pH梯度。
根据蛋白质的等电点,蛋白质在凝胶中会聚焦在对应的位置。
6.凝胶分离与染色:等电点聚焦结束后,取出凝胶,根据需要进行分离和染色。
结果与讨论:等电点聚焦技术是一种高效、准确的测定蛋白质等电点的方法。
它利用电场力将蛋白质在凝胶中聚焦,根据蛋白质在不同pH条件下的电荷变化,最终确定其等电点。
该方法操作简便、结果可靠,适用于各类蛋白质的等电点测定。
结论:本实验利用等电点聚焦技术成功地测定了一种蛋白质的等电点,并通过凝胶分离和染色展示了等电点聚焦的结果。
等电点聚焦技术在蛋白质等电点测定中具有重要的应用价值,可以为蛋白质结构和功能的研究提供重要的参考。
[1]赵海洋.蛋白质等电点聚焦技术[J].广西科技大学学报,2024[2]张桂泉,王运青,刘晓东.蛋白质等电点聚焦的实验教学及质量考察[J].高等教育化学研究,2024。
蛋白质等电点测定实验报告蛋白质等电点测定实验报告引言:蛋白质是生命体中最为重要的有机物之一,它在细胞结构、酶的催化、免疫反应等方面发挥着重要的作用。
蛋白质的等电点是指其在溶液中呈电中性的pH 值,也是蛋白质电荷性质的一个重要指标。
本实验旨在通过测定蛋白质的等电点,进一步了解蛋白质的性质和结构。
实验方法:1. 实验材料准备实验所需材料包括:蛋白质样品、pH缓冲液、酸碱溶液、电泳仪等。
蛋白质样品可以是动物组织、细胞培养液或纯化的蛋白质。
2. 准备蛋白质样品将蛋白质样品溶解在适量的pH缓冲液中,使其浓度适宜,以便于后续的实验操作。
3. 蛋白质电泳将蛋白质样品分别加载到电泳槽中的不同孔道,接通电源,进行蛋白质电泳。
通过电场的作用,蛋白质会在凝胶中移动,根据其等电点的不同,可以观察到蛋白质在凝胶上的分离情况。
4. 染色和观察蛋白质电泳结束后,将凝胶取出,进行染色。
常用的染色方法有银染色和胞质染色等。
染色后,可以通过显微镜观察凝胶上的蛋白质带。
实验结果:根据实验操作的结果,我们可以得到蛋白质的等电点。
蛋白质的等电点是指在溶液中呈电中性的pH值,也就是蛋白质带上的蛋白质停止迁移的pH值。
实验讨论:蛋白质的等电点与其氨基酸组成有关。
蛋白质中的氨基酸分别带有阳离子和阴离子的性质,当溶液的pH值等于蛋白质的等电点时,蛋白质的带电量最小,呈电中性。
在等电点之前,蛋白质带正电;在等电点之后,蛋白质带负电。
实验中,我们可以通过观察蛋白质在凝胶上的分离情况,判断蛋白质的等电点。
当蛋白质的等电点与溶液的pH值相等时,蛋白质不带电,停止迁移;当蛋白质的等电点与溶液的pH值不相等时,蛋白质带电,继续迁移。
蛋白质的等电点与其结构和功能密切相关。
不同的蛋白质具有不同的等电点,这是由于它们的氨基酸组成和序列的差异所致。
蛋白质的等电点对于其溶解性、稳定性和活性都有重要影响。
在制药和生物工程领域,了解蛋白质的等电点是进行蛋白质纯化和结构研究的基础。
蛋白质等电点测定及性质实验
一、目的:
了解等电点的意义及其与蛋白质分子聚沉能力的关系。
初步学会测定蛋白质等电点的基本方法,了解蛋白质的性质。
二、原理:
固体颗粒在液体中为什么能够带电?
当固体与液体接触时,固体可以从溶液中选择性吸附某种离子,也可以是固体分子本身发生电离作用而使离子进入溶液,以致使固液两相分别带有不同符号的电荷,由于电中性的要求,带电表面附近的液体中必有与固体表面电荷数量相等但符号相反的多余的反离子。
在界面上带电表面和反离子形成了双电层的结构。
在两种不同物质的界面上,正负电荷分别排列成的面层。
对于双电层的具体结构,一百多年来不同学者提出了不同的看法。
最早于1879年Helmholz提出平板型模型;1910年Gouy和1913年Chapman修正了平板型模型,提出了扩散双电层模型;后来Stern又提出了Stern模型。
根据O.斯特恩的观点,一部分反离子由于电性吸引或非电性的特性吸引作用(例如范德华力)而和表面紧密结合,构成吸附层(或称紧密层、斯特恩层)。
其余的离子则扩散地分布在溶液中,构成双电层的扩散层(或称滑移面)。
由于带电表面的吸引作用,在扩散层中反离子的浓度远大于同号离子。
离表面越远,过剩的反离子越少,直至在溶液内部反离子的浓度与同号离子相等。
紧密层:溶液中反离子及溶剂分子受到足够大的静电力,范德华力或特性吸附力,而紧密吸附在固体表面上。
其余反离子则构成扩散层。
滑动面:指固液两相发生相对移动的界面,是凹凸不平的曲面。
滑动面至溶液本体间的电势差称为ζ电势。
固体颗粒带电量的大小及测量方式?
ζ电势只有在固液两相发生相对移动时才能呈现出来。
ζ电势的大小由Zeta电位表示,其数值的大小反映了胶粒带电的程度,其数值越高表明胶粒带电越多,扩散层越厚。
一般来说,以pH值为横坐标,Zeta电位为纵坐标作图,Zeta电位为零对应的pH值即为等电点。
对于蛋白质分子来说:
蛋白质分子的大小在胶粒范围内,约1~100微米。
大部分蛋白质分子的表面都有很多亲水集团,这些集团以氢键形式与水分子进行水合作用,使水分子吸附在蛋白质分子表面而形成一层水合膜,具有亲水性;又由于蛋白质分子表面的亲水集团都带有电荷,会与极性水分子中的异性电荷吸引形成双电层。
而水合膜和双电层的存在,使蛋白质的分子与分子之间不会相互凝聚,成为比较稳定的胶体溶液。
如果消除水合膜或双电层其中一个因素,蛋白质溶液就会变得不稳定,两种因素都消除时,蛋白质分子就会互相凝聚成较大的分子而产生沉淀。
在生活实践中,常利用蛋白质的胶体性质沉淀或分离蛋白质。
如做豆腐、肉皮冻就是利用蛋白质的胶凝作用。
蛋白质分子所带的电荷与溶液的pH值有很大关系,蛋白质是两性电解质,在酸性溶液中的氨基酸分子氨基形成-NH3+而带正电,在碱性溶液中羧基形成-COO-而带负电:
蛋白质分子所带净电荷为零时的pH值称为蛋白质的等电点(PI)。
其定义为:在某一pH的溶液中,蛋白质解离成阳离子和阴离子的趋势或程度相等时,呈电中性,此时溶液的pH称为该蛋白质的等电点。
等电点的应用:主要用于蛋白质等两性电解质的分离、提纯和电泳。
蛋白质等电点的测量方式:溶解度最低时的溶液pH。
在等电点时,蛋白质分子在电场中不向任何一极移动,而且分子与分子间因碰撞而引起聚沉的倾向增加,所以这时可以使蛋白质溶液的粘度、渗透压均减到最低,且溶液变混浊。
蛋白质在等电点时溶解度最小,最容易沉淀析出。
蛋白质等电点的测定
各种蛋白质的等电点都不相同,但偏酸性的较多,如牛乳中的酪蛋白的等电点是4.7~4.8,血红蛋白等电点为6.7~6.8,胰岛素是5.3~5.4,鱼精蛋白是一个典型的碱性蛋白,其等电点在pH 12.0~12.4。
本实验采用蛋白质在不同pH溶液中形成的混浊度来确定,即混浊度最大时的pH值即为该种蛋白质的等电点值,这个方法虽然不很准确,但在一般实验条件下都能进行,操作也简便。
蛋白质的等电点比较准确的方法是采用等电聚焦技术加以准确测定,但需一定的实验条件。
等电聚焦电泳(IEF,isoelectric focusing electrophoresis)
利用特殊的一种缓冲液(两性电解质)在凝胶(常用聚丙烯酰胺凝胶)内制造一个pH 梯度,电泳时每种蛋白质就将迁移到等于其等电点(pI)的pH处(此时此蛋白质不再带有净的正或负电荷),形成一个很窄的区带。
IEF的基本原理
在IEF的电泳中,具有pH梯度的介质其分布是从阳极到阴极,pH值逐渐增大。
如前所述,蛋白质分子具有两性解离及等电点的特征,这样在碱性区域蛋白质分子带负电荷向阳极移动,直至某一pH位点时失去电荷而停止移动,此处介质的pH恰好等于聚焦蛋白质分子的等电点(pl)。
同理,位于酸性区域的蛋白质分子带正电荷向阴极移动,直到它们的等电点上聚焦为止。
可见在该方法中,等电点是蛋白质组分的特性量度,将等电点不同的蛋白质混合物加入有pH梯度的凝胶介质中,在电场内经过一定时间后,各组分将分别聚焦在各自等电点相应的pH位置上,形成分离的蛋白质区带。
沉淀反应:蛋白质在某种理化条件下,蛋白胶体溶液的水化层或者电荷层破坏,蛋白胶体相互聚集的现象。
主要的沉淀现象有(1)盐析:在蛋白质水溶液中加入足量的盐类(如硫酸铵),可析出沉淀,稀释后能溶解并仍保持原来的性质,不影响蛋白质的活性。
这是一个可逆的过程,可用于蛋白质的分离与初级提纯。
(2)变性:在重金属盐、强酸、强碱、加
热、紫外线等作用下,引起蛋白质某些理性质改变和生物学功能丧失。
这是一个不可逆过程。
(3)加入一定量的溶剂如乙醇、丙酮,它们与蛋白质分子争夺水分子,破坏水化膜,短时间内是可逆反应;(4)加入生物碱试剂(含氮的碱性物质):能使生物碱沉淀或作用产生颜色反应的物质,称为生物碱试剂。
当溶液的pH小于PI时,蛋白质为阳离子,能与生物碱试剂的阴离子结合而生成沉淀。
酪蛋白是牛奶蛋白质的主要成分,常温下在水中可溶解0.8~1.2%,微溶于25度水和有机溶剂,溶于稀碱和浓酸中,能吸收水分。
当浸入水中则迅速膨胀。
在牛奶中以磷酸二钙、三钙或两者的复合物形式存在。
构造极为复杂,没有确定的分子式。
分子量约为
57000~375000,在牛奶中约含3%,占牛奶蛋白质的80%。
三、器材及试剂:
1.器材:
①试管1.5×厘米(×9)。
②吸管1毫升(×2),2毫升(×2),10毫升(×2)。
③容量瓶50毫升(×2),500毫升(×1)。
④试管架。
2.试剂:
①0.01mol·L-1醋酸溶液。
②0.1mol·L-1醋酸溶液。
③1 mol·L-1醋酸溶液。
④1 mol·L-1氢氧化钠溶液(氢氧化钠和醋酸溶液的浓度要标定)。
⑤酪蛋白。
四、操作步骤:
1.制备蛋白质胶液
(1)称取酪蛋白3克,放在烧杯中,加入40℃的蒸馏水。
(2)加入50毫升1 mol·L-1氢氧化钠溶液,微热搅拌直到蛋白质完全溶解为止。
将溶解好的蛋白溶液转移到500毫升容量瓶中,并用少量蒸馏水洗净烧杯,一并倒入容量瓶。
(3)在容量瓶中再加入1 mol·L-1醋酸溶液50毫升,摇匀。
(4)加入蒸馏水定容至500毫升,得到略现浑浊的,在0.1 mol·L-1NaAC溶液中的酪蛋白胶体。
2.等电点测定
按下表顺序在各管中加入蛋白质胶液,并准确地加入蒸馏水和各种浓度的醋酸溶液,加入后立即摇匀。
观察各管产生的混浊并根据混浊度来判断酪蛋白的等电点。
观察时可用+,++,+++,表示浑浊度。
3. 蛋白质性质实验
(1)蛋白质的盐析
在试管里加入1~2毫升蛋白质的水溶液,然后逐滴加入硫酸铵饱和溶液,观察现象,有无白色浑浊产生。
滴加过程中不要摇动试管,现象不明显时,多加几滴硫酸铵饱和溶液。
(2)蛋白质的变性
在试管里加入2毫升蛋白质的水溶液,沸水浴加热5分钟,观察现象。
把试管里的下层物质取出一些放在水里,观察现象。
在试管里加入3毫升蛋白质的水溶液,加入1毫升硫酸铜溶液,观察现象。
(有无淡蓝色絮状浑浊沉淀产生)。
把少量沉淀放入盛有蒸馏水的试管里,观察沉淀是否溶解。
五、思考题
1、在等电点时蛋白质的溶解度为什么最低?请结合你的实验结果和蛋白质的胶体性质加以说明。
在等电点时,蛋白质分子以两性离子形式存在,其分子净电荷为零(即正负电荷相等),此时蛋白质分子颗粒在溶液中因没有相同电荷的相互排斥,分子相互之间的作用力减弱,其颗粒极易碰撞、凝聚而产生沉淀,所以蛋白质在等电点时,其溶解度最小,最易形成沉淀物。
2、本实验中,酪蛋白质在等电点时从溶液中沉淀析出,所以说凡是蛋白质在等电点时必然。