高三化学一轮复习课件:515原子结构
- 格式:ppt
- 大小:1.69 MB
- 文档页数:59

原子结构
【学习目标】
1、了解原子的构成,了解原子序数、核电荷数、质子数、中子数、核外电子数、及相互关系
2、了解元素、核素、同位素的定义
3、了解原子核外电子排布规律
【课前预习】
一、原子结构
1、原子组成:
原子是由 、 构成的。原子的质量主要集中在 上。
原子组成符号: 其中,X为 ,Z为 ,A为 。表示意义:
2、
微粒 电子 质子 中子
质量(kg)
相对质量
电量(C)
电荷
3、几种关系:
①质量关系:质量数(A)=
( ) +
( )
②数量关系:核内质子数=核外电子数(原子中)
③电性关系:a、若核电荷数=质子数=核外电子数=原子序数( )
b、若质子数>核外电子数( ) 质子数— 电荷数=
c、若质子数<核外电子数( ) 质子数 + 电荷数=
【练习】
1、下列核素中,中子数和质子数相等的是( )。
①18O;②12C;③26Mg;④40K;⑤32
A、①② B、②⑤ C、只有④
D、③④
2、在离子RO3n-中共有x个核外电子,R原子的质量数是A,则R原子核内含有的中子数目( )
A、A-x+n+48 B、A-x-n-24 C、A-x+n+24 D、A+x-n-24
二、几个重要的概念
1、元素 同一类原子.....的总称
2、核素
一种..原子

新教材适用·高考化学
原子结构
[考纲要求] 1.掌握元素、核素、同位素、相对原子质量、相对分子质量、原子构成、原子核外电子排布的含义。2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.掌握1~18号元素的原子结构示意图的表示方法。
考点一 原子构成
1.构成原子的微粒及作用
2.微粒之间的关系
(1)质子数(Z)=核电荷数=核外电子数;
(2)质量数(A)=质子数(Z)+中子数(N);
(3)阳离子的核外电子数=质子数-阳离子所带的电荷数;
(4)阴离子的核外电子数=质子数+阴离子所带的电荷数。
3.一个信息丰富的符号
深度思考
1.有5种单核粒子,它们分别是4019□、4018□、4019□+、4020□2+、4120□(“□”内元素符号未写出),则它们所属元素的种类有________种。
答案 3
解析 质子数决定元素种类,质子数有19、18、20共3种,所以B正确。
2.(1)4822Ti的质子数为________、中子数为________、电子数为________、质量数为________。
(2)27Al3+的质子数为________、中子数为________、电子数为________、质量数为________。
(3)35Cl-的质子数为________、中子数为________、电子数为________、质量数为________。
答案 (1)22 26 22 48 (2)13 14 10 27 (3)17 18 18
35
题组一 粒子中微粒关系的判断
1.下列离子中,电子数大于质子数且质子数大于中子数的是 ( )
A.D3O+ B.Li+
C.OD- D.OH-
答案 D
2.现有bXn-和aYm+两种离子,它们的电子层结构相同,则a与下列式子有相等关系的是 ( )
A.b-m-n B.b+m+n

知识点回顾
考点一:原子、原子结构与元素性质的关系
考点二:原子核外电子排布
考点三:核素
考点四:化学键
考点五:分子间作用力、氢键
例1、136C—NMB(核磁共振)可以用于含碳化合物的结构分析,136C表示的碳原子( )
A.核外有13个电子,其中6个能参与成键
B.核内有6个质子,核外有7个电子
C.质量数为13,原子序数为6,核内有7个质子
D.质量数为13,原子序数为6,核内有7个中子
例2、法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是( )
A.该粒子不显电性 B.该粒子质量数为4
C.与氢元素的质子数相同 D.该粒子质量比氢原子大
例3、下列物质属于同分异构体的一组是( )同素异形体的是( )
A.淀粉和纤维素
B. CH3-CH2-CH2-CH3 与
C.H和D D. O2与O3
例4、下列微粒结构示意图正确的是( )
A B C D E
例5、下列叙述中,正确的是 ( )
A.两种微粒,若核外电子排布完全相同,则其化合价一定相同
B.凡单原子形成的离子,一定具有稀有气体元素原子的核外电子排布
C.两种原子,如果核外电子排布相同,则一定属于同种元素
D.同位素的核外电子排布不一定相同
例6、XY2中含有离子键,X和Y离子的电子层结构都与氖原子相同,则X、Y为( )
A、Ca和Cl B、K和S C、Ca和F D、Mg和F
例7、下列说法中正确的是( )
A.所有的单质分子都是由共价键形成的 B.离子化合物中一定不含共价键

1 原子结构
班级_______ 组别 姓名
【学习目标】1、了解原子的构成及原子序数、核电荷数、质子数、中子数、核外电子数之间的关系;能够辨析元素、核素、同位素的含义
2、小组合作讨论,探究相对原子质量、相对分子质量的定义,并能进行有关计算
3、以极度的热情,全力以赴投入学习,体验学习的快乐。
【使用说明】利用一节课,认真阅读课本,完成学案,下课收齐。下节课修改10 分钟后,讨论10分钟,小组内知识互查,师生探究、学生展示20分钟,巩固落实5分钟。 标有★★的B层可不做,标有★或★★的C层可不做。
【课前导学】
一、原子构成
1、表示原子或核素的符号是_______,意义是________________________________________
2、构成原子的各微粒的作用
中子
在质子数确定后,决定__________种类
决定________________种类
原子核
质量数 近似相对原子质量
质子 核电荷数 决定_________种类
原子 决定整个原子显不显电性
最外层电子数
电子数 决定____________________________
各层电子数
核外电子
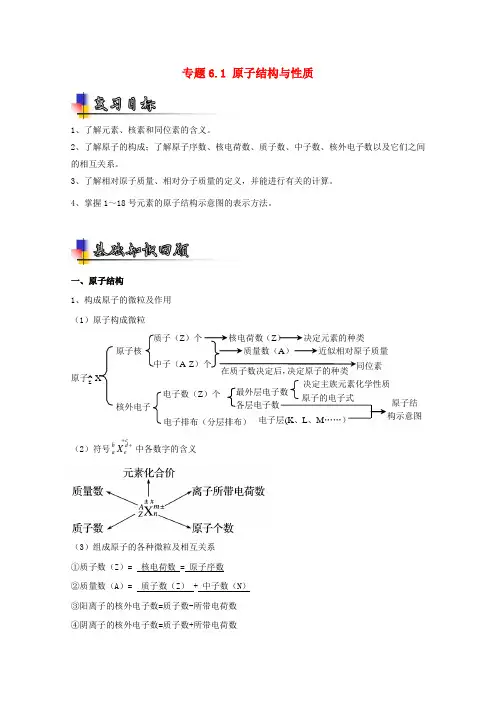
专题6.1 原子结构与性质
1、了解元素、核素和同位素的含义。
2、了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3、了解相对原子质量、相对分子质量的定义,并能进行有关的计算。
4、掌握1~18号元素的原子结构示意图的表示方法。
一、原子结构
1、构成原子的微粒及作用
(1)原子构成微粒
(2)符号cbdaeX中各数字的含义
(3)组成原子的各种微粒及相互关系
①质子数(Z)= 核电荷数 =
原子序数
②质量数(A)= 质子数(Z) + 中子数(N)
③阳离子的核外电子数=质子数-所带电荷数
④阴离子的核外电子数=质子数+所带电荷数 原子AZ X 原子核
核外电子 质子(Z)个
中子(A-Z)个
电子数(Z)个
电子排布(分层排布) 核电荷数(Z) 决定元素的种类
质量数(A) 近似相对原子质量
在质子数决定后,决定原子的种类
最外层电子数
各层电子数 同位素
决定主族元素化学性质
原子的电子式
电子层(K、L、M„„) 原子结
构示意图
【特别提示】规避4个易失分点
①任何微粒中,质量数=质子数+中子数,但质子数与电子数不一定相等,如阴、阳离子。
②有质子的微粒不一定有中子,如1H,有质子的微粒不一定有电子,如H+。
③质子数相同的微粒不一定属于同一种元素,如F与OH-。
④核外电子数相同的微粒,其质子数不一定相同,如Al3+和Na+、F-等,NH+4与OH-等。
2、元素、核素、同位素的概念及相互关系
元素 核素 同位素
概念 具有相同核电荷数(质子数)的同一类原子的总称 具有一定数目质子和一定数目中子的一种原子 质子数相同而中子数不同的原子或同一元素的不同核素
范围 宏观概念,对同一类原子而言,既有游离态又有化合态 微观概念,对某种元素的一种原子而言 微观概念,对某种元素的原子而言。因同位素的存在而使原子的种类多余元素的种类
特性 主要通过形成的单质或化合物来体现 不同的核素可能质子数相同、或中子数相同、或质量数相同,或各类数均不同。 同位素质量数不同,物理性质有差异,化学性质相同。

第 1 页 共 4 页 第32讲 原子结构与元素性质
【考纲要求】
1、了解原子核外电子的运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义。
2、了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示常见元素(1-36号)原子核外电子的排布。
3、了解同一周期、同一主族元素电离能的变化规律,了解元素电离能和核外电子排布的关系。
4、了解同一周期、同一主族元素电负性的变化规律,能根据元素电负性说明2周期中元素金属性和非金属性的变化规律。
【课前预习区】
一、核外电子排布(原子结构)
1、描述核外电子的运动状态涉即________(即能层)、________(即能级)、________、________;核外电子的排布遵循 、 、 。
2、写出24号元素原子的电子排布式、外围电子(价电子排布式)排布式、外围电子轨道表示式;确定其在周期表中的分区?
二、元素性质
★1、元素的第一电离能的周期性变化
同周期从左至右________________________________________要注意什么?为什么?
同主族从上至下_______________________________________
★ 2、元素电负性的周期性变化
同周期从左至右________________________________________要注意什么?
同主族从上至下_______________________________________
【课堂互动区】
【考点1】:了解原子核外电子的能级分布,能用电子排布式表示常见元素(1-36号)原子核
外电子的排布。了解原子核外电子的运动状态。
例1:下列各组原子中,彼此化学性质一定相似的是 ( )
A、原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子

1/15
第13讲原子结构化学键
1.掌握元素、核素、同位素、相对原子质量、相对分子质量、原子构成、原子核外电子排布的含义。
2.掌握原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
3.掌握1~18号元素的原子结构示意图的表示方法。
4.了解化学键的定义。
5.了解离子键、共价键的形成。
6.掌握电子式的表示方法。
本部分内容是高考的常考点,高考中常以选择题型出题。考查原子(离子)的结构及微粒间的数量关系,
也常考查对元素、核素、同位素概念的理解以及结合元素周期表的推断等。
【核心素养分析】
1.宏观辨识与微观探析:能从离子或原子结构示意图等不同层次认识原子的结构以及核外电子的排布规
律,能从宏观和微观相结合的视角分析原子结构与元素性质的关系。能从不同层次认识分子的构型,并对
共价键进行分类,能从宏观和微观相结合的视角分析与解决实际问题。
2.证据推理与模型认知:能运用原子结构模型解释化学现象,揭示现象的本质与规律。能运用构造原理
和能量最低原理揭示元素原子核外电子排布规律。认识共价键的本质及类型,能多角度、动态地分析分子
的空间结构及性质,并运用相关理论解决实际问题。
3.科学态度与社会责任:具有可持续发展意识和绿色化学观念,能对与原子结构有关的社会热点问题做出正确的价值判断。
知识点一原子结构、同位素
1.原子结构
(1)原子的构成粒子
原子AZ
X)
原子核质子Z个——决定元素的种类
中子(A-Z)个在质子数确定后
决定原子种类同位素
核外电子Z个——最外层电子数决定元素的化学性质
(2)构成原子或离子的微粒间的数量关系
2/15
①原子中:质子数(Z)=核电荷数=核外电子数。
②质量数(A)=质子数(Z)+中子数(N)。
③阳离子的核外电子数=质子数-阳离子所带电荷数。如Mg2+的核外电子数是10。
④阴离子的核外电子数=质子数+阴离子所带电荷数。如Cl-的核外电子数是18。
(3)一个信息丰富的符号
【特别提醒】
①原子中不一定都含有中子,如11H中没有中子。

高三化学一轮复习方法策略
高三化学复习过程一般分三轮进行。第一轮按章节复习,夯实基础,查缺补漏,使知识系统化。第二轮主要进行专题复习,同时进行相应的专项训练,突破知识难点,使知识网络化、结构化。下面给大家分享一些关于高三化学一轮复习方法策略,希望对大家有所帮助。
高三化学一轮复习方法策略
1.研究考试大纲,循纲务本
考纲和考试说明是备考的指南针,认真研究考纲和考试说明,可增强日常复习的针对性和方向性,避免盲目备考,按方抓药,弄清楚高考检测什么,检测的价值取向,高考的命题依据。对考纲的实际操作是——考纲不要求的不复习,考纲降低要求的不拓展,考纲所要求的大力复习。
2.精练高考真题,明确方向
考纲的要求是通过考题来体现的,所以,研究历年特别是近五年新课改地区的高考题,有利于更好的理解考纲,明确备考方向。
经过对近几年高考题的横、纵向分析,可以得出以下三点:一是主干知识考查“集中化”,二是基础知识新视角,推陈出新,三是能力考查“综合化”。
3.摸清问题所在,对症下药
要提高后期的备考质量,还要真正了解学生存在的问题,只有如此,复习备考才能更加科学有效。所以,必须加大信息反馈,深入总结学情,明确备考方向,对症开方下药,才能使学生的知识结构更加符合高考立体网络化要求,才能实现基础→能力→分数的转化。
4.切实回归基础,提高能力
复习训练的步骤包括强化基础,突破难点,规范作答,总结方法,通过这样的总结,学生印象深刻,应用更加灵活。
高三一轮化学复习攻略
一、整合教材、科学安排
复习时要以化学知识块、教材章节、方法与技能相结合的方式整合教材。并按概念和理论与技能的主线形成单元,进行复习。并将计算和实验融合、穿插到各单元中。在整合教材组成单元的过程中,注意感受知识的内在联系和规律,形成完整的知识结构和网络,促进能力的培养和提高。
二、注重基础、落实细节
高考要求的化学主干知识有:原子结构元素,周期律、周期表,分子结构、晶体类型,热化学方程式,反应速率与化学平衡,电解质溶液,氧化还原原理,卤素,氧族元素,氮族元素,碳族元素,碱金属,镁、铝、铁,同分异构,烃及其衍生物,糖类、蛋白质、油脂,有机合成材料,物质的量及计算,化学式和结构式计算,化学实验常用仪器及操作,实验室制法,物质的检验、分离、推断化学,实验设计。

目 录
第一章 化学反应及能量变化
第一课时 氧化还原反应
第二课时 离子反应
第三课时 化学反应中的能量变化 燃烧热和中和热
第二章 碱金属
第一课时 钠及其化合物
第二课时 碱金属元素
第三章 物质的量
第一课时 物质的量和气体摩尔体积
第二课时 物质的量浓度
第三课时 有关物质的量的计算
第四章 卤素
第一课时 氯气及其化合物
第二课时 卤族元素
第五章 物质结构 元素周期律
第一课时 原子结构
第二课时 元素周期律 元素周期表
第三课时 化学键和分子结构

1 高三总复习专题十二 ----物质结构与性质
课时1 原子结构与性质
考点一 原子核外电子排布原理
1.能层、能级与原子轨道
(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。通常用K、L、M、N、O、P、Q„„表示相应的第一、二、三、四、五、六、七„„能层,能量依次升高
(2)能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即E(s)
(3)原子轨道:表示电子在原子核外的一个空间运动状态。电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图也就是原子轨道的形象化描述。
原子轨道 轨道形状 轨道个数
s 球形 1
p 纺缍形
3
—————————[特别提醒]———————
第一能层(K),只有s能级;第二能层(L),有s、p两种能级;第三能层(M),有s、p、d三种能级;s能级上只有一个原子轨道,p能级上有三个原子轨道px、py、pz,d能级上有五个原子轨道,各能级上的原子轨道具有相同的能量。
2.基态原子核外电子排布的三个原理
(1)能量最低原理:电子尽先占有能量低的轨道,然后依次进入能量较高的轨道,使整个原子的能量处于最低状态。即原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。如图为构造原理示意图:
———————————[特别提醒]—————————————————
能级交错现象:核外电子的能量并不是完全按能层序数的增加而升高,不同能层的能级之间的能量高低有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
(2)泡利原理
在一个原子轨道中,最多只能容纳2个电子,并且这两个电子的自旋状态相反。
(3)洪特规则
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,并且自旋状态相同。