期末复习二有机物的性质(1)
- 格式:doc
- 大小:462.00 KB
- 文档页数:4

高三化学有机物性质知识点高三化学学习中,有机物性质是一个重要的知识点。
有机物是由碳元素构成的,含有碳-碳键或碳-氢键的化合物。
它们的性质是由其分子结构和化学键的特性所决定的。
本文将从有机物的燃烧性质、氧化性质、酸碱性质以及加成反应等几个方面进行讨论。
1. 有机物的燃烧性质有机物的燃烧是指在适当条件下与氧气反应,释放出大量的热和光。
有机物的燃烧是一种氧化反应,其一般化学方程式为:有机物+氧气→二氧化碳+水+能量。
燃烧反应通常是放热反应,因此会伴随着火焰和生成物的形成。
不同有机物的燃烧性质会有所差异,如饱和烃燃烧无火焰,而不饱和烃燃烧则会产生明亮的火焰。
2. 有机物的氧化性质有机物的氧化性是指有机物与氧气或其他氧化剂反应的性质。
有机物的氧化反应主要是由于碳-碳和碳-氢键的断裂,然后生成新的碳-氧键、碳-氮键等。
有机物的氧化性质的表现主要有:易被氧化,如醇、醚等;具有还原性,如醛、酮等;以及易进行氧化分解,如羧酸等。
氧化反应在有机物的合成和分解过程中起到重要作用。
3. 有机物的酸碱性质有机物的酸碱性质是指有机物在水溶液中的酸碱性表现。
有机物可以分为酸性有机物、中性有机物和碱性有机物。
酸性有机物包括羧酸、酚等,它们能够在水溶液中产生H+离子。
中性有机物如烃、醇等在水中不会产生氢离子或氢氧根离子。
碱性有机物如胺则能够在水溶液中生成OH-离子。
有机物的酸碱性质不仅可以影响它们在化学反应中的行为,还可以影响它们在生物体内的代谢和作用。
4. 有机物的加成反应有机物的加成反应是指有机物中的双键或三键断裂并与其他化合物形成新的化学键的反应。
加成反应是有机合成中常用的反应之一,常用于合成大分子化合物或改变有机物的分子结构。
加成反应可以是热力学或动力学控制的,常见的加成反应包括烯烃的加成反应、芳香烃的加成反应以及烃的加成反应等。
有机物的加成反应在化学工业、药物合成和材料科学等领域具有重要应用价值。
总结起来,高三化学学习中的有机物性质是一个重要的知识点。

有机物性质总结一、脂肪烃1、烷烃(1)物理性质:①状态:在室温下,含有1~4个碳原子的烷烃为气体;常温下,含有5~8个碳原子的烷烃为液体;含有8~16个碳原子的烷烃可以为固体,也可以为液体;含有17个碳原子以上的正烷烃为固体。
②密度:烷烃的密度随相对分子质量增大而增大,这也是分子间相互作用力的结果,密度增加到一定数值后,相对分子质量增加而密度变化很小。
且均小于水的密度。
③熔点、沸点:同类烃中,碳原子个数越多,熔点和沸点越高;碳原子个数相同时,支链越多,熔点和沸点就越低。
④溶解性:可溶于非极性溶剂如四氯化碳、烃类化合物中,不溶于极性溶剂,如水中。
(2)化学性质:(以甲烷为例)①氧化反应:CH4+2O2→CO2+2H2O(燃烧)②取代反应:CH4+Cl2→(光照)CH3Cl(气体)+HClCH3Cl+Cl2→(光照)CH2Cl2(油状物)+HClCH2Cl2+Cl2→(光照)CHCl3(油状物)+HClCHCl3+Cl2→(光照)CCl4(油状物)+HCl2、烯烃(1)物理性质:C2~C4烯烃为气体;C5~C18为易挥发液体;C19以上固体。
随着相对分子质量的增加,沸点和密度升高。
相同碳原子个数的烷烃和烯烃,烯烃沸点比烷烃高(2)化学性质:(以乙烯为例)①氧化反应:1、CH2═CH2+3O2→2CO2+2H2O(燃烧)2、使酸性高猛酸钾溶液褪色。
②加成反应:CH2═CH2+Br2→CH2Br—CH2Br(常温下使溴水褪色) CH2═CH2+HCl—催化剂、加热→CH3—CH2Cl(制氯乙烷) CH2═CH2+H2O—催化剂、170℃→CH3CH2OH(制酒精)③加聚反应:nCH2═CH2→-[CH2—CH2]-n (制聚乙烯)3、炔烃(1)物理性质:炔烃的熔沸点低、密度小、难溶于水、易溶于有机溶剂,一般也随着分子中碳原子数的增加而发生递变。
(2)化学性质:(以乙炔为例)①氧化反应:1、2C₂H₂+5O₂→4CO₂+2H₂O(条件:点燃)2、能使紫色酸性高锰酸钾溶液褪色。

初中化学有机物总结有机物是指由碳原子构成的化合物,是化学中一类重要的物质。
下面将对初中化学中有机物的基本特性、命名规则以及常见的有机物进行总结。
1. 有机物的基本特性有机物具有以下特性:(1) 多数有机物是无色的,但也有一些有机物是有色的,如染料类有机物;(2) 有机物一般具有相对较低的熔点和沸点,也有少数有机物具有较高的熔点和沸点,如焦油;(3) 大多数有机物可以燃烧,可以参与各种化学反应;(4) 有机物的溶解性一般较好,可以溶于许多有机溶剂,也可以溶于一些无机溶剂;(5) 有机物的化学惰性相对较高,不容易参与化学反应。
2. 有机物的命名规则有机物的命名使用一定的规则,主要包括以下几个方面:(1) 前缀:根据有机物中碳原子的数目,有甲、乙、丙、丁、戊等一系列的前缀,分别对应1个、2个、3个、4个、5个碳原子的有机物。
(2) 主链:有机物中最长的碳原子链被称为主链,有机物的命名通常以主链为基础。
(3) 功能团:有机物中的一些特定基团被称为功能团,如醇、酮、醚、酸等。
根据这些功能团的存在,可以对有机物进行进一步的命名。
(4) 后缀:根据有机物中的功能团,可以在主链的末端加上相应的后缀,比如醇类加上-ol,酮类加上-one,醛类加上-al等。
3. 常见的有机物以下是初中化学中常见的有机物及其简要描述:(1) 甲烷:甲烷分子由一个碳原子和四个氢原子组成,是最简单的饱和烃。
它是天然气的主要成分之一。
(2) 乙醇:乙醇,也被称为酒精,是最简单的醇类化合物。
它广泛应用于药品、卫生产品、溶剂等领域。
(3) 乙醛:乙醛是一种醛类化合物,常见于水果的香气中,也是酒精的代谢产物之一。
(4) 乙烯:乙烯是一种重要的烯烃,由两个碳原子和四个氢原子构成。
它广泛应用于塑料、合成纤维等材料的制造过程中。
(5) 甲苯:甲苯是一种芳香烃,具有特殊的芳香气味。
它广泛应用于溶剂、香料等领域,也是某些化学物质的重要中间体。
(6) 乙酸:乙酸是一种酸类化合物,是醋的主要成分。

有机化学基础知识点整理有机物的物理性质与化学性质有机化学是研究有机物质的合成、结构、性质和反应的一门学科。
有机物是指含有碳元素的化合物,在自然界中广泛存在,也是生命体系的基础。
本文将对有机化学的基础知识点进行整理,重点探讨有机物的物理性质和化学性质。
一、有机物的物理性质1. 密度:有机物的密度通常较小,大多数有机物的密度在0.5-1.5g/cm³之间。
这是因为有机物分子中的碳元素轻,且通常含有较多的非金属元素,使得有机物相对来说比较轻。
2. 熔点和沸点:有机物的熔点和沸点通常较低。
这是由于有机物的分子间力较弱,主要是由范德瓦尔斯力引起的,因此需要较低的温度才能克服这种力。
3. 溶解性:有机物通常具有较好的溶解性,特别是在有机溶剂中溶解性更好。
这是由于有机溶剂和有机物具有相似的分子结构,分子间有较强的相互作用力。
4. 颜色:有机化合物中的某些基团或官能团可以赋予有机物不同的颜色。
例如,含有共轭结构的化合物通常具有颜色,如苯环具有共轭双键结构的芳香族化合物呈现出紫色。
5. 光学活性:部分有机物具有旋光性,即能使入射的偏振光旋转一定角度。
这是由于有机物分子中的立体异构体所引起的。
二、有机物的化学性质1. 燃烧性:有机物在氧气存在下可燃烧。
燃烧产生水和二氧化碳,同时也会释放出大量的热能。
2. 反应活性:有机物通常具有较强的反应活性,容易与其他物质发生各种化学反应。
例如,有机物可以进行取代反应、加成反应、消除反应等。
3. 氧化还原性:有机物可以参与氧化还原反应。
一般来说,含有较多键合氧的有机物容易发生氧化反应,而含有多个亲电原子的有机物则容易发生还原反应。
4. 酸碱性:有机物可以表现出酸性或碱性。
酸性有机物通常含有能够解离产生氢离子的官能团,而碱性有机物则含有能接受氢离子的官能团。
5. 亲核性:有机物中的亲电子对亲核试剂具有吸引作用,容易发生亲核取代反应或亲核加成反应。
综上所述,有机化学基础知识点整理了有机物的物理性质和化学性质。
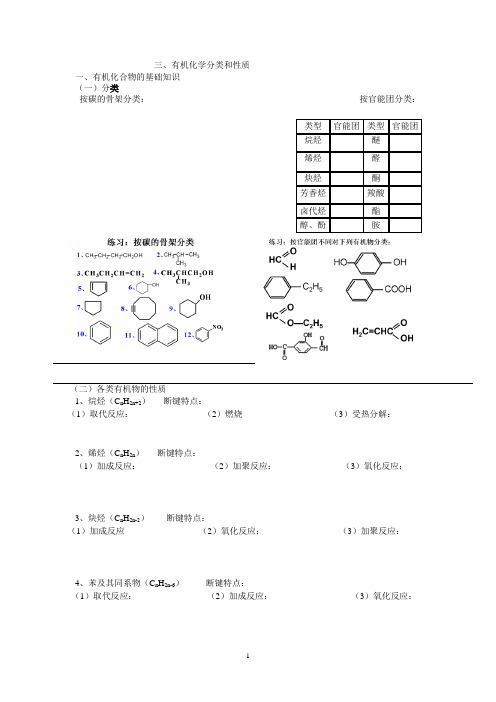
三、有机化学分类和性质
一、有机化合物的基础知识 (一)分类
按碳的骨架分类: 按官能团分类:
(二)各类有机物的性质
1、烷烃(C n H 2n+2) 断键特点:
(1)取代反应: (2)燃烧 (3)受热分解:
2、烯烃(C n H 2n ) 断键特点:
(1)加成反应: (2)加聚反应: (3)氧化反应:
3、炔烃(C n H 2n-2) 断键特点:
(1)加成反应 (2)氧化反应: (3)加聚反应:
4、苯及其同系物(C n H 2n-6) 断键特点:
(1)取代反应: (2)加成反应: (3)氧化反应:
5、卤代烃断键特点:
(1)碱性条件下水解:(2)消去反应:
6、醇饱和一元醇(C n H2n+1OH)断键特点:
(1)与Na等活泼金属反应:(2)催化氧化:
(3)消去反应:(4)酯化反应:(5)分子间脱水:
7、酚(石炭酸)断键特点:
(1)氧化:(2)弱酸性:
(3)取代反应:(4)显色反应:(5)苯环上的加成:
8、醛(C n H2n O)RCHO 断键特点:
(1)还原反应(加成反应):(2)氧化反应:
9、羧酸(C n H2n O2)RCOOH 断键特点:
10、酯(C n H2n O2)断键特点:
(三)、反应类型和规律总结
从属关系:
2、由反应条件确定官能团:
3、根据反应物性质确定官能团:
5.官能团的改变
(1)官能团之间的衍变:
(2)官能团数目的改变
(3)官能团位置的改变
(4)官能团的消除
(5)碳骨架的增减
(四)、有机物衍变关系知识网络
1、知识网1(单官能团)
2、知识网2(双官能团)
3、芳香线。

有机物的性质有机物是由碳、氢和其他一些元素(如氧、氮、硫等)组成的化合物,在自然界中广泛存在。
它们具有多样的性质,包括物理性质和化学性质。
本文将介绍一些常见的有机物性质,以及它们在日常生活和科学研究中的重要应用。
1. 物理性质(1) 熔点和沸点:有机物的熔点和沸点通常比较低,但也有一些高沸点的有机物存在。
这是因为有机物分子之间的相互作用相对较弱,容易被破坏。
(2) 密度:有机物的密度一般较小,但也有一些例外。
不同有机物的密度可以通过比较分子结构来推测,但并不总是准确可靠。
(3) 颜色:有机物可以呈现各种不同的颜色,这取决于其化学组成和分子结构。
许多有机染料和天然色素都是有机物。
2. 化学性质(1) 燃烧性:大多数有机物可燃,它们能够与氧气反应产生二氧化碳和水。
一些有机物,如石油和天然气,是重要的燃料资源。
(2) 氧化还原:有机物可以参与氧化还原反应,其中它们可以被氧化或还原。
例如,醛类和酮类化合物可以被还原为相应的醇化合物。
(3) 水解性:一些有机物可以与水反应产生新的化合物。
例如,酯可以通过水解成醇和酸。
(4) 聚合性:有机物可以进行聚合反应,即小分子有机物可以结合形成大分子化合物。
这是合成聚合物的基础,如塑料和纤维。
3. 应用(1) 药物:有机合成化学在药物研发中起着重要作用。
许多药物都是有机化合物,通过调节生物分子的活性来治疗疾病。
(2) 化妆品和个人护理产品:许多化妆品和护肤品中含有有机化合物,如香料、防腐剂和增稠剂。
(3) 农药和肥料:有机合成化学也广泛应用于农业领域,用于生产农药和肥料,以提高农业生产效率。
(4) 材料科学:有机化合物在材料科学中有着多种应用,例如合成塑料、橡胶和纤维等。
(5) 能源:某些有机物,如生物质和生物柴油,可以用作可再生能源资源。
总结起来,有机物具有多样的性质,包括物理性质和化学性质。
这些性质使得有机物在各个领域都有着广泛的应用,从药物到材料科学,都离不开有机合成化学的贡献。
有机物物理性质 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN1 有机物物理性质归类一密度烃的密度一般随碳原子数的增多而增大;一氯代烃的相对密度随着碳原子数的增加而减小。
注意:1.通常气态有机物的密度与空气相比,相对分子质量大于29的,比空气的密度大。
2.通常液态有机物与水相比:密度比水小:烃,酯,一氯代烃,一元醇,醛,酮,高级脂肪酸等密度比水大:硝基苯,溴代烃,二氯(或以上)代烃,乙二醇,丙三醇等二状态[常温常压(1个大气压、20℃左右)]由于有机物大都为大分子(相对无机物来说),所以有机物分子间引力较大,因此一般情况下呈液态和固态,只有少部分小分子的有机物呈气态支链越多,熔沸点越低1.随着分子中碳原子数的增多,烃由气态经液态到固态。
分子中含有1~4个碳原子的轻一般为气态,5~16个碳原子的烃一般为液态,17个以上的为固态。
如通常状况下CH4、C4H8呈气态,苯及苯的同系物一般呈液态,大多数呈固态。
2.醇类、羧酸类物质中由于含有—OH,分子之间存在氢键,所以醇类、羧酸类物质分子中碳原子较少的,在通常状况下呈液态,分子中碳原子较多的呈固态,如:甲醇、乙醇、甲酸和乙酸等呈液态。
3.醛类通常状况下除碳原子数较少的甲醛呈气态、乙醛等几种醛呈液态外,相对分子质量大于100的醛一般呈固态。
4.酯类通常状况下一般分子中碳原子数较少的酯呈液态,其余都呈固态。
5.苯酚及其同系物由于含有_OH,且苯环相对分子质量较大,故通常状况下此类物质呈固态。
常见物质(1)气态:①烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态②衍生物类:一氯甲烷(CH3Cl,沸点为-24.2℃)氟里昂(CCl2F2,沸点为-29.8℃)氯乙烯(CH2==CHCl,沸点为-13.9℃)甲醛(HCHO,沸点为-21℃)氯乙烷(CH3CH2Cl,沸点为12.3℃)一溴甲烷(CH3Br,沸点为3.6℃)四氟乙烯(CF2==CF2,沸点为-76.3℃)甲醚(CH3OCH3,沸点为-23℃)特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
有机物化学性质总结一、烷烃1、在光照条件下,可与卤素单质发生取代反应....HX X X H C n n +−→−+++12n n 222H C 光2、在空气或氧气中点燃,发生氧化反应....。
烷烃燃烧通式为: O H n O n H C n n 22222)1(nCO213++−−→−+++点燃二、 烯烃1、氧化反应a. 乙烯易燃烧,燃烧时火焰明亮并伴有黑烟。
O 2H CO2322222+−−→−+=点燃O CHCH※ 注意:①点燃前需验纯。
②当温度高于100摄氏度时,乙烯燃烧前后的气体体积不变。
b. 乙烯能使酸性KMnO 4溶液褪色,因此可用酸性KMnO 4溶液鉴别4CH 和42H C ,但不能用KMnO 4溶液除去乙烯,因为与其反应时有2CO 生成。
2、加成反应乙烯能跟溴水、卤素单质)(X 2、氢气、水、卤化氢、氰化氢等在适宜的条件下发生加成反应。
r r r CHCHB CH B CH B 22222—−→−+=(常温下使溴水褪色)因此可用溴水鉴别4CH 和42H C 。
(用溴水可除甲烷中混有的乙烯) 3、加聚反应三、苯1、取代反应a. 与2Br 反应在3FeBr 催化作用下,苯与溴反应生成溴苯,说明苯具有烷烃的性质。
溴苯的密度比谁大,化学方程式为 。
b.与3HNO 反应(硝化反应)。
.在浓42SO H 作用下,苯在50℃—60℃时与浓硝酸反应,化学方程式为 。
浓硫酸的作用是催化剂和吸水剂。
反应在水浴中进行。
c.磺化反应:2、加成反应(苯又能与22C l H 或分别在催化作用下发生加成反应,说明苯具有烯烃的性质)。
3、氧化反应①苯在空气中燃烧发出明亮的带有浓烟的火焰。
O 6H CO 1215222266+−−→−+点燃O H C②苯不能使酸性4O KM n 溶液褪色;也不能使溴水褪色,但苯能将溴从溴水中萃取出来。
由此可知苯在化学性质上与烯烃有很大差别。
四、苯的同系物1、都能燃烧..,燃烧时发出明亮的带浓烟的火焰,其燃烧通式为:C n H 2n-6+233-n O 2−−→−点燃nCO 2+(n-3)H 2O 2、都能与卤素单质(X 2)、硝酸、硫酸等发生取代反应.... 3、都能与氢气等发生加成反应....4、苯的同系物与苯在化学性质上的不同之处:a.由于侧链对苯环的影响,使苯的同系物的苯环上氢原子的活性增强,发生的取代反应有所不同。
有机物知识点总结有机物知识点总结有机物知识点总结1一、重要的物理性质1.有机物的溶解性(1)难溶于水的有:各类烃、酯、绝大多数高聚物、高级的(指分子中碳原子数目较多的,下同)醇、醛、羧酸等。
(2)易溶于水的有:低级的[一般指N(C)≤4]醇、醛、羧酸及盐、氨基酸及盐、单糖、二糖。
(3)具有特殊溶解性的:① 乙醇是一种很好的溶剂,既能溶解许多无机物,又能溶解许多有机物。
② 乙酸乙酯在饱和碳酸钠溶液中更加难溶,同时饱和碳酸钠溶液还能通过反响吸收挥发出的乙酸,溶解吸收挥发出的乙醇,便于闻到乙酸乙酯的香味。
③有的淀粉、蛋白质可溶于水形成胶体。
蛋白质在浓轻金属盐(包括铵盐)溶液中溶解度减小,会析出(即盐析,皂化反响中也有此操作)。
④线型和局部支链型高聚物可溶于某些有机溶剂,而体型那么难溶于有机溶剂。
2.有机物的密度小于水的密度,且与水(溶液)分层的有:各类烃、酯(包括油脂)3.有机物的状态[常温常压(1个大气压、20℃左右)](1)气态:① 烃类:一般N(C)≤4的各类烃注意:新戊烷[C(CH3)4]亦为气态② 衍生物类:一氯甲烷(CH3Cl,沸点为-24.2℃) 甲醛(HCHO,沸点为-21℃)(2)液态:一般N(C)在5~16的烃及绝大多数低级衍生物。
如,己烷CH3(CH2)4CH3 甲醇CH3OH甲酸HCOOH 乙醛CH3CHO特殊:不饱和程度高的高级脂肪酸甘油酯,如植物油脂等在常温下也为液态(3)固态:一般N(C)在17或17以上的链烃及高级衍生物。
如,石蜡 C12以上的烃饱和程度高的高级脂肪酸甘油酯,如动物油脂在常温下为固态4.有机物的颜色绝大多数有机物为无色气体或无色液体或无色晶体,少数有特殊颜色淀粉溶液(胶)遇碘(I2)变蓝色溶液;含有苯环的蛋白质溶胶遇浓硝酸会有白色沉淀产生,加热或较长时间后,沉淀变黄色。
5.有机物的气味许多有机物具有特殊的气味,但在中学阶段只需要理解以下有机物的气味:甲烷:无味乙烯:稍有甜味(植物生长的调节剂)液态烯烃:汽油的气味乙炔:无味苯及其同系:芳香气味,有一定的毒性,尽量少吸入。
化学有机化合物的性质化学有机化合物的性质是研究有机物理化学性质的重要内容之一。
有机化合物是由碳和氢以及其他一些元素组成的化合物,具有复杂多样的性质。
了解有机化合物的性质对于我们理解和应用有机化学有着重要的意义。
一、物理性质1. 熔点和沸点:有机化合物的熔点和沸点通常较低。
这是因为有机分子之间的作用力较弱,分子间距较大,容易发生相变。
同时,不同有机化合物的熔点和沸点也受分子结构和分子量的影响。
2. 溶解性:有机化合物在有机溶剂中溶解度较高。
这是因为有机化合物通常是非极性或弱极性分子,与有机溶剂有较好的相容性。
但在水等极性溶剂中溶解度较低。
3. 密度:有机化合物的密度通常较小。
这是因为有机物的分子量相对较小,其分子体积较大。
二、化学性质1. 燃烧性:有机化合物一般易燃。
这是因为有机物中含有丰富的化学键能,可以在氧气的存在下进行燃烧反应,释放大量的热能。
2. 氧化还原性:有机化合物可以进行氧化还原反应。
例如,醛或酮可被还原为醇,醇可以被氧化为醛或酮。
3. 加成反应:有机化合物常发生加成反应。
例如,烯烃可以与卤素发生加成反应,得到相应的卤代烃。
4. 反应活性:不同的有机化合物具有不同的反应活性,可以发生不同的化学反应。
例如,芳香烃由于环上的共轭结构稳定,不容易发生加成或氧化反应。
三、结构与性质的关系有机化合物的性质与其分子结构有密切的关系。
分子结构的不同会导致性质的差异。
例如,同分子式的不同衍生物可能具有不同的物理性质和化学性质。
此外,还有其他一些因素会影响有机化合物的性质,如分子大小、分子间作用力、立体构型等。
这些因素都会对有机化合物的性质产生重要影响。
总结起来,有机化合物的性质是由其分子结构和组成决定的。
通过对有机化合物性质的研究和了解,我们可以更好地理解有机化学的基础理论,也能更好地应用于有机合成、药物和材料等领域的研究和开发中。
有机化合物的性质是化学研究中的重要内容之一,也是化学发展的基石之一。
期末复习二有机物的性质
班级姓名学号【知识回顾】
一、烃
1.下列除杂质(括号内为杂质)的实验设计不能达到预期目的是 ( )
A .乙烷(乙烯):溴水,洗气
B .甲苯(苯酚):浓溴水,过滤
C .乙酸乙酯(乙酸):饱和Na 2CO 3溶液,分液
D .乙醇(乙酸):碱石灰,蒸馏
2、下列各组中两个变化所发生的反应,属于同一类型的是: ( )
①由甲苯制甲基环己烷、由乙烯制溴乙烷
②乙烯使溴水褪色、乙炔使酸性高锰酸钾水溶液褪色
③由乙烯制聚乙烯、由1,3-丁二烯制顺丁橡胶;④由苯制硝基苯、由苯制苯磺酸
A. 只有②③
B. 有①③④
C. 只有①③
D. 只有①④
3.分子式为C 8H 16O 2的有机物X ,水解生成Y 、Z 两种碳原子数相同的直链有机物,其中Z 可与
Na 2CO 3溶液反应,Y 不能转化为Z ,则X 为 ( )
A .2-甲基丙酸丁酯
B .丁酸丁酯
C .丁酸-2-丁酯
D .丁烯酸丁酯
4.右图是某有机物的球棍模型,下列关于该有机物的性质叙述中错误..
的是 ( ) A .既能与NaOH 发生反应,又能与盐酸反应
B .能合成高分子化合物
C .能发生加成反应
D .能发生水解反应
5.某有机物的结构简式为CH 2CHO
CH 2COOH CH 2CH 2OH ,它在一定条件下可能发生的反应是( )
①加成;②水解;③酯化;④氧化;⑤中和;⑥消去;⑦还原 A .①③④⑤⑥⑦ B .①③④⑤⑦ C .①③⑤⑥⑦ D . ②③④⑤⑥
6.已知苯酚能跟碳酸钠溶液反应而溶解于碳酸钠溶液中。
在下图所示的转化关系中,括号内编号①—④表示转化所需化学试剂:
(1)用化学式填空:
①是 、②是 、 ③是 、④是 、
(2)A 的结构简式是 。
COOH H 2C OH
【课后练习一】
1. 丙烯酸的结构简式为CH 2=CH —COOH ,其对应的性质中不正确的是 ( )
A .与钠反应放出氢气
B . 能与溴水发生取代反应
C .与新制的Cu(OH)2悬浊液反应 D.发生相互加成反应生成高分子化合物
2.下列反应属于取代反应的是 ( )
A.甲醇→甲醛
B.丙醛→丙酸
C.苯酚→三溴苯酚
D.丁醇→丁烯
3.下列各组物质的最简式相同的是 ( )
A.乙酸和乙二酸
B.丁酸和乙醛
C.甲醛和乙酸
D.乙二酸和乙二醇
4.苯甲酸(C 6H 5COOH )和山梨酸(CH 3-CH =CH -CH =CH -COOH )都是常用的食品防腐剂。
下列物质中只能与其中一种酸发生反应的是 ( )
A .溴水
B .氢氧化钠
C .金属钠
D .乙醇 5、扑热息痛是一种优良的解热镇痛药,其结构为:
,它可能具有的性
质是
( )
A.不与氢氧化钠溶液反应
B.能与浓溴水发生取代反应
C.不能被氧化
D.遇三氯化铁溶液呈现紫色
6、对某结构为右图所示的化合物,则有关生成该物质的叙述正确的是 ( )
A.由两分子乙醇分子间脱水而成
B.由乙酸与乙二醇酯化而成
C.由两分子乙二醇脱水而成
D.苯酚经加氢而成
7.PHB 塑料是一种可在微生物作用下降解的环保型塑料,其结构简式为:。
下面有关PHB 说法不正确的是 ( )
A.PHB 是一种聚酯
B.PHB 的单体是CH 3CH 2CH(OH)COOH
C.PHB 的降解产物可能有CO 2和H 2O
D.PHB 通过加聚反应制得
8、已知酸性大小:羧酸>碳酸>酚。
下列含溴化合物中的溴原子,在适当条件下都能被羟基( OH)取代(均可称为水解反应),所得产物能跟NaHCO 3溶液反应的是 ( )
9.已知: + 有机物G (C 20H 18O 4)是一种酯,合成路线如下:
回答下列问题: (1)指出下列反应类型:反应① ;反应② ;
(2)A 的结构简式: ;F 的结构简式: ;
(3)B 转化为C 的化学方程式:
;
HO NH -C -CH 3 O
CH 2-CH 2 CH 2-CH 2 O O 3 Br 2 CH 2Br 2 C -Br
2 Br A B C D OH -
① H + 脱水 新制Cu(OH)2
CHO CH 3CHO
R CHO R 'CH 2CHO OH -
(4)C 和F 转化为G 的化学方程式:。
10.法国化学家V.Grignard,所发明的Grignard 试剂(卤代烃基镁)广泛运用于有机合成。
Grignard 试剂的合成方法是:RX +Mg −−→−乙醚
RMgX (Grignard 试剂)。
生成的卤代烃基镁
与具有羰基结构的化合物(醛、酮等)发生反应,再水解就能合成各种指定结构的醇:
现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C 10H 16O 4的具有六元环的物质J ,合成线路如下,H 的一氯代物只有3种。
请按要求填空:
(1)F 的结构简式是 ;
(2)C +D →E 的反应类型是 ,F→G 的反应类型是 ;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ,
I→J 。
(4)I 和该二元酸除了能反应生成J 外,还可以在一定条件下发生缩聚反应生成高聚物, 试写出此高聚物的结构简式 。
11. A 、B 都是芳香族化合物,相对分子质量都不超过200,完全燃烧都只生成CO 2和H 2O 。
1 molA 与1mol 某一元羧酸发生酯化反应生成B ,B 能在一定条件下发生银镜反应而A 不能;A 中氧元素的质量分数为31.6%,B 的溶液有酸性,但不能和FeCl 3溶液发生显色反应。
请根据上述信息,完成下列填空:
⑴A 的分子式是 ,你确定A 分子中氧原子数目的理由是 ⑵若1molA 只能与1molNaOH 发生反应,且A 苯环上一取代产物只有两种,则A 的结构简式为 。
⑶B 的同分异构体甚多。
其中不属于酚类且1mol 能与3molNaOH 反应的同分异构体的结构筒式为 (任写一种); 不属于酚类且1mol 能与4molNaOH 反应的同分异构体的结构筒式为 (任写一种)。