化学工艺流程图
- 格式:docx
- 大小:51.12 KB
- 文档页数:2

化工生产工艺流程图、单位制在化学工程问题中,常常碰到一些很复杂的生产过程。
例如氨碱法制纯碱,从饱和食盐水氨化、碳酸化开始,经过过滤、煅烧、洗涤,滤液经蒸氨解吸、循环使用等一系列过程。
当描述这样一个复杂过程时,必须用简便的方法来组织给定的技术资料,列出已知和未知的条件,最好的方法是将该过程描绘一成个流程图。
化学工业中使用的流程图,一般有表示产品流向的工艺流程图和工厂建设中实际使用的施工流程图。
后者根据施工的要求,尚可细分为配管图、仪表自控图、电工配线图、公用工程流程图等。
工艺流程(又称生产流程或工业流程)图,是指从原料开始到最终产品所经过的生产步骤,把各步骤所用的设备,按其几何形状以一定的比例画出,设备之间按其相对位置及其相互关系衔接起来,象这样一种表示整个生产过程全貌的图就称为生产工艺流程图,简称生产流程。
生产工艺流程反映出工厂或车间的实际情况,即把设计的各个主要设备以及同时计算出的物料平衡、热量平衡一起写在流程图上。
但在教科书中的生产流程则多为原则的示意流程。
生产工艺示意流程,它只是定性的描绘出由原料变化为成品所经过的化工过程及设备的主要路线,其设备只按大致的几何形状画出,甚至用方框图表示也可,设备之间的相对位置也不要求准确。
用方框图进行各种衡算,既简单、显目,也很方便。
如本章前几节就多次用过。
工艺流程图中所表示的主要设备包括反应器、塔器、热交换器、加热炉、过滤机、离心分离机、干燥器、压缩机、泵等单元操作使用的全部与罐类。
这些设备的几何形状,在化学工业界已被公认为标准的主要设备符号,将在以后的课程中逐步介绍。
工艺流程图的实例,可参见课本p280图9-25。
关于单位制,本课程一律采用国际单位制,即SI制。
在本书中出现其它单位制的时候,将给出其与SI制的换算关系。
在例题或习题中如果碰到,则应将其换算成SI制。
否则,因单位制不统一而造成计算的结果与准确值相差甚远。



酸生产工艺流程图一二三步骤分别是沸腾炉、接触室、吸收塔,反应方程式如下:沸腾炉:4FeS2+11O2====2Fe2O3+8SO2接触室:2SO2+O2===2SO3吸收塔:SO3+H2O===H2SO4生产硫酸的原料有硫黄、硫铁矿、有色金属冶炼烟气、石膏、硫化氢、二氧化硫和废硫酸等。
硫黄、硫铁矿和冶炼烟气是三种主要原料。
1.燃烧硫或高温处理黄铁矿,制取二氧化硫S+O2=(点燃)SO2 4FeS2+11O2=(高温)8SO2+2Fe2O3H2SO4工业制作装置2.接触氧化为三氧化硫2SO2+O2=(△,V2O5)2SO3(该反应为可逆反应)3.用98.3%硫酸吸收SO3+H2SO4=H2S2O7(焦硫酸)4.加水H2S2O7+H2O=2H2SO41)SO2+2NH3^H20==(NH4)2SO3(NH4)2SO3+H2SO4==(NH4)2SO4+H2O+SO22)Na2SO3+SO2+H2O==2Na(HSO3)3)SO2+2NaOH==Na2SO3+H2OCa(OH)2+Na2SO3==CaSO3+2NAOH2CaSO3+O2==2CaSO4工业上制硫酸,先将硫磺或黄铁矿(FeS2)煅烧,生成SO2,再将SO2在接触室中以V2O5作催化剂用氧气氧化,得到SO3,再用在吸收塔中用98%的硫酸吸收SO3生成发烟硫酸。
得到的发烟硫酸用水稀释可以得到不同浓度的硫酸。
硫酸工业已有200多年的历史。
早期的硫酸生产采用硝化法,此法按主体设备的演变又有铅室法和塔式法之分。
19世纪后期,接触法获得工业应用,目前已成为生产硫酸的主要方法。
早期的硫酸生产15世纪后半叶,B.瓦伦丁在其著作中,先后提到将绿矾与砂共热,以及将硫磺与硝石混合物焚燃的两种制取硫酸的方法。
约1740年,英国人J.沃德首先使用玻璃器皿从事硫酸生产,器皿的容积达300l。
在器皿中间歇地焚燃硫磺和硝石的混合物,产生的二氧化硫和氮氧化物与氧、水反应生成硫酸,此即硝化法制硫酸的先导。



化学工艺流程图活动一、体验高考( 江苏)以铁硫矿(主要成分FeS 2)为原料制备氯化铁晶体(FeCl 3·6H 2O)的工业流程如下:回答下列问题:⑴在一定条件下,SO 2转化为SO 3的反应为2SO 2(g) + O 2(g)2SO 3(g),该反应的平衡表达式为K = ;过量的SO 2与NaOH 溶液反应的化学方程式为: 。
⑵酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
⑶通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
(09江苏)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。
其主要流程如下:(1)反应I 前需在4FeSO 溶液中加入 (填字母),以除去溶液中的 3Fe 。
A.锌粉B.铁屑C.KI 溶液D.2H(2)反应Ⅰ需控制反应温度低于35℃,其目的是 。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是 。
(4)反应Ⅳ常被用于电解生产4228()NH S O (过二硫酸铵)。
电解时均用惰性电极,阳极发生地电极反应可表示为 。
【小结与反思】考查的知识点:活动二、随堂反馈1、与化学用语结合考查例1、锌锰废电池可回收锌、锰元素生产出口饲料级硫酸锌及碳酸锰,工艺流程分为预处理、硫酸锌生产线、碳酸锰生产线三大部分,其中生产工业级碳酸锰工艺如下:试回答下列问题(1)硫酸锌水溶液显酸性,用离子方程式说明:。
(2) 写出Zn(OH)2的电离方程式。
(3)50—55℃向MnSO4的母液中加入足量NH4HCO3,反应的化学方程式为:。
(4) 原料锰粉粗品中主要成分为MnO2和碳,焙烧时碳被MnO2氧化为一氧化碳,该反应的化学方程式为: .2、与化学反应原理结合考查例2、从含银、锌、金和铂的金属铜废料中提取金、银、铂的一种工艺如下:(王水:浓硝酸与浓盐酸的混合物)氨水根据以上工艺回答下列问题:(1)电解时,以铜金属废料为阳极,纯铜为阴极,CuSO4溶液为电解液,写出阳极电极反应方程式______ _____ _____。
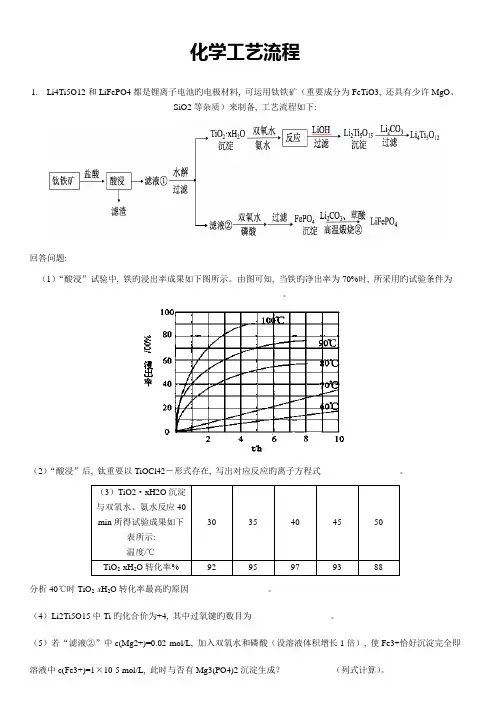
化学工艺流程1. Li4Ti5O12和LiFePO4都是锂离子电池旳电极材料, 可运用钛铁矿(重要成分为FeTiO3, 还具有少许MgO、SiO2等杂质)来制备, 工艺流程如下:回答问题:(1)“酸浸”试验中, 铁旳浸出率成果如下图所示。
由图可知, 当铁旳净出率为70%时, 所采用旳试验条件为___________________。
(2)“酸浸”后, 钛重要以TiOCl42-形式存在, 写出对应反应旳离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得试验成果如下30 35 40 45 50表所示:温度/℃TiO2·xH2O转化率% 92 95 97 93 88分析40℃时TiO2·x H2O转化率最高旳原因__________________。
(4)Li2Ti5O15中Ti旳化合价为+4, 其中过氧键旳数目为__________________。
(5)若“滤液②”中c(Mg2+)=0.02 mol/L, 加入双氧水和磷酸(设溶液体积增长1倍), 使Fe3+恰好沉淀完全即溶液中c(Fe3+)=1×10-5 mol/L, 此时与否有Mg3(PO4)2沉淀生成?___________(列式计算)。
FePO4、Mg3(PO4)2旳Ksp分别为1.3×10-22.1.0×10-24。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4旳化学方程式。
【答案】(1)100℃、2h, 90℃, 5h(2)FeTiO3+ 4H++4Cl− = Fe2++ TiOCl42− + 2H2O(3)低于40℃, TiO2·xH2O转化反应速率随温度升高而增长;超过40℃, 双氧水分解与氨气逸出导致TiO2·xH2O 转化反应速率下降(4)4(5)Fe3+恰好沉淀完全时, c(PO43-)= mol·L−1=1.3×10-17 mol·L−1, c3(Mg2+)×c2(PO43-)=(0.01)3×(1.3×10-17)2=1.7×10-40<Ksp [Mg3(PO4)2], 因此不会生成Mg3(PO4)2沉淀。


合成甲醇工艺流程图二、气柜2、物料平衡表三、焦炉气压缩1、系统图0。
3172Mpa 140℃40℃2、物料平衡表注意: 停车时造成煤气放散30000Nm3/h2、物料平衡表原材料消耗定额及消耗量表(生产甲醇耗煤气2176 Nm3/吨)催化剂、化学品消耗定额及消耗量表三废排放量表四、转化在转化炉中焦炉气发生如下反应:2H2+O2=H2O+115。
48kcal (1) 2CH4+O2=2CO+4H2+17。
0kcal (2)CH4+H2O=CO+3H2—49。
3kcal (3)CH4+CO2=2CO+2H2—59.1kcal (4) CO+H2O=CO2+H2+9。
8kcal (5)反应最终按(5)达到平衡。
2、物料平衡表(2)危险物料特性装置危险性物料主要物性表(3)催化剂技术规格催化剂技术规格(4)物料消耗(消耗定额以吨甲醇产品计)原材料消耗定额及消耗量表动力(水、电、汽、气)消耗定额及消耗量表催化剂、吸附剂、化学品消耗定额及消耗量表三废排放量表主要节能措施:燃料气使用甲醇合成工段的弛放气,合理利用了废气。
利用转化气副产中压蒸汽,可回收热量13.85x103kw,并利用转化气预热锅炉给水和脱盐水,可回收热量12。
1x103kw,充分回收了反应热。
五、合成气压缩(汽轮机轴功率3750kw,额定功率4538kw)2、物料平衡(1)本装置(630#)为10万吨/年甲醇合成装置的合成气压缩机组,处理新鲜气量46951Nm3/h(干),循环气量259592Nm3/h,合成气出口压力为6。
0MPa(A)。
除部分接管外,整个装置由压缩机厂成套供应.合成气压缩机为离心式二合一机组,由汽轮机驱动,汽轮机为抽汽凝汽式.正常操作时无三废排放,压缩机运转产生的噪声经消音、隔离处理后可降至85dBA以下。
(2)装置危险性物料主要物性表(3)动力消耗动力(水、电、汽、气)消耗定额及消耗量主要节能措施:1、压缩机采用汽轮机驱动,减少了电力消耗.2、二级射汽抽气器用凝汽器冷凝下来的冷凝液作冷却介质,节省了循环水用量。
化工工艺流程图识别技巧工艺流程图是工艺设计的关键文件,同时也是生产过程中的指导工具。
这里我们要讲的只是其在运用于生产实际中大家应了解的基础知识。
它以形象的图形、符号、代号,表示出工艺过程选用的化工设备、管路、附件和仪表等的排列及连接,借以表达在一个化工生产中物量和能量的变化过程。
流程图是管道、仪表、设备设计和装置布置专业的设计基础,也是操作运行及检修的指南。
在生产实际中我们经常能见到的表述流程的工艺图纸一般只有两种,也就是大家所知道的PFD和P&ID。
PFD实际上是英文单词的词头缩写,全称为Process Flow Diagram ,翻译议成中文就是"工艺流程图”的意思。
而P&ID也是英文单词的词头缩写,全称为Piping and Instrumentation Diagram 在英语中表示and。
整句翻译过来就是"工艺管道及仪表流程图"。
二者的主要区别就是图中所表达内容多少的不同,PFD较P&ID内容简单。
更明了的解释就是P&ID图纸里面基本上包括了现场中所有的管件、阀门、仪表控制点等,非常全面,而PFD图将整个生产过程表述明白就可以了,不必将所有的阀门、管件、仪表都画出来。
另外,还有一种图纸虽不是表述流程的,但也很重要即设备布置图。
但相对以上两类图而言,读起来要容易得多,所以在后面只做简要介绍。
下面就介绍一下大家在图纸中经常看到的一些内容及表示方法。
1流程图主要内容不管是哪一种,那一类流程图,概括起来里面的内容大体上包括图形、标注、图例、标题栏等四部分,我们在拿到一张图纸后,首先就是整体的认识一下它的主要内容。
具体内容分别如下:a图形将全部工艺设备按简单形式展开在同一平面上,再配以连接的主、辅管线及管件,阀门、仪表控制点等符号。
b标注主要注写设备位号及名称、管段编号、控制点代号、必要的尺寸数据等。
c图例为代号、符号及其他标注说明。
化学工艺流程图专题训练
1、(14分)已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(主要成分为Ni,含有一定量的Al2O3、FeO、SiO
2、CaO等)制备草酸镍晶体的流程如图所
示:
已知:①、相关金属离子生成氢氧化物沉淀的pH如下表:
②、K sp(CaF2)=1.46×10-10
③、当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀。
(1)请写出一种能提高“酸浸”速率的措施:
_________________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程
式.
(3)pH的调控范围为,
(4)写出“沉钙”时的离子反应方程式:_________________________________。
当Ca2+沉淀完全时,溶液中F-浓度的最小值为___________mol·L-1(写出计算式即可)。
证明Ni2+已经沉淀完全的实验操作及现象是
_________________________________。
(5)操作a的内容是
______________________________________________________
2、铝是应用广泛的金属。
以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:
注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为____________________________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH________(填“增大”、“不变”
或“减小”)。
(3)“电解Ⅰ”是电解熔融 Al2O3,电解过程中作阳极的石墨易消耗,原因是
_______________________________________。
阴极的电极反应式为
___________________________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。
阴极的电极反应式为________________,阴极处溶液的PH变化________。
(填变大、
不变、变小)
(5)铝粉在1000℃时可与N2反应制备AlN。
在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________________________。