平衡态和准静态
- 格式:pptx
- 大小:176.85 KB
- 文档页数:10

工程热力学名词解释(4×5=20分)1.可逆过程:当系统进行正、反两个过程后,系统与外界均能完全回复到初始状态。
平衡状态:系统在不受外界影响的条件下,如果宏观热力性质不随时间变化,系统内外同时建立了热平衡和力平衡,这是系统的状态称为热力平衡状态,简称平衡状态。
准静态过程:如果造成系统状态改变的不平衡势差无限小,以致该系统在任意时刻均无限接近于某个平衡态,这样的过程称为准静态过程。
状态参数:描述工质状态特性的各种物理量称为工质的状态参数。
2.膨胀功:在压力差作用下,由于系统工质容积发生变化而通过界面向外界传递的机械功。
技术功:热力过程中可被直接利用来做功的能量通称为技术功。
流动功:为推动流体通过控制体界面而传递的机械功,它是维持流体正常流动所必须传递的能量。
轴功:系统通过机械轴与外界传递的机械功。
3.理想气体:分子本身不具有体积、分子间没有作用力的气体称为理想气体。
实际气体:气体的状态处于很高的压力或很低的温度,气体有很高的密度,以致分子本身的体积及分子间的相互作用力不能忽略不计时的气体,称为实际气体。
4.热力学用:闭口系统从给定状态可逆地过渡到与环境状态相平衡,对外所作的最大有用功,称为热力学能用。
焓用:工质流从初态可逆过渡到环境状态,单位质量工质焓降可能做出的最大技术功是工质流的焓用。
热量用:当热源温度T高于环境温度T0时,从热源取得热量Q,通过可逆热机可对外界做出的最大功称为热量用。
冷量用:当热源温度T低于环境温度T0时,在可逆条件下,外界消耗的最小功即为冷量用。
5.闭口系统:没有物质穿过边界的系统。
开口系统:有物质流穿过边界的系统。
绝热系统:系统与外界之间没有热量传递的系统。
孤立系统:系统与外界之间不发生任何能量传递和物质交换的系统。
6.定压比热容:单位质量的物质,在压力不变的条件下,作单位温度变化时相应的焓的变化。
定容比热容:单位质量的物质,在比体积不变的条件下,作单位温度变化时相应的热力学能的变化。

准静态热力学过程
准静态热力学过程是一种热力学系统在过程中足够缓慢地向平衡
态变化的过程,过程中系统的宏观性质始终保持稳定。
在这种过程中,系统可以看作是处于一系列平衡态中,并且在每个平衡态中,系统的
宏观性质可以被准确地测量并被描述。
准静态热力学过程通常可以用来对理想气体的热力学特性进行描述,例如,理想气体的等温膨胀过程就可以近似认为是一个准静态热
力学过程。
在这种过程中,压强随着体积的变化而变化,但是系统的
温度始终保持不变,这是因为在每个平衡态中,系统的温度都被维持
在一个固定的值。
因此,在准静态热力学过程中,系统的温度、压强、体积等宏观性质都可以被精确测量和计算。
总之,准静态热力学过程是热力学领域中一种特殊的过程,其中
的变化足够缓慢,以至于系统的宏观性质始终保持稳定。
通过对这种
过程的研究,可以更加深入地理解热力学理论的相关概念和原理。


一.几个基本概念:1.孤立系,闭系和开系:与其他物质既没有物质交换也没有能量交换的系统叫做孤立系;与外界没有物质交换但有能量交换的系统叫做闭系;与外界既有物质交换也有能量交换的系统叫做开系。
2.平衡态:经验表明,一个孤立系统,不论其初态多么复杂,经过足够长的时间后,将会达到这样的状态,系统的各种宏观性质在长时间内不会发生任何变化,这样的状态称为热力学平衡态。
3.准静态:所谓准静态过程,它是进行的非常缓慢的过程,系统所经历的每一个状态都可以看做是平衡态。
4.可逆过程与不可逆过程:如果一个过程发生后,无论用任何曲折复杂的方法都不可能把它留下的后果完全的消除而使一切恢复原状,这过程称为不可逆过程;反之,如果一个过程发生后,它所产生的影响可以完全消除而令一切恢复原状,这过程称为可逆过程。
5.理想气体:我们把严格遵从玻意耳定律、焦耳定律和阿氏定律的气体称为理想气体。
二.热力学定律1.热平衡定律(即热力学第零定律):如果物体A和物体B各自与处在同一状态C达到平衡,若令A与进行热接触,他们也将处在热平衡,这个实验事实称为热平衡定律。
2.热力学第一定律:自认界的一切物质都具有能量,能量有各种不同的形式,可以从一种形式转化成另一种形式,从一个物体传递到另一个物体,在传递与转化中能量的数量不变。
第一定律也可以表述称为第一类永动机是不可能制成的。
3.热力学第二定律:1)克氏表述:不可能把热量从低温物理传到高温物体而不引起其他变化。
2)开氏表述:不可能从单一热源吸热使之完全变成有用功而不引起其他变化。
热力学第二定律也可表述为第二类永动机是不可能制成的。
关于热力学第二定律有几点需要说明:在两个表述中所说的不可能,不仅指【1】在不引起其他变化的条件下,直接从单一热源吸热而使之完全变成有用的功,或者直接将热量从低温物体送到高温物体是不可能的。
而且指【2】不论用多么复杂的方法,在全部过程终了时,其最终的唯一后果是从单一热源吸热而将之完全变成有用功,或者热量从低温物体传到高温物体是不可能的。


准静态过程的三个条件准静态过程堪称是理论物理中最基础的概念之一,其在热力学领域、流体力学中都有广泛的应用。
准静态过程是指热力学系统通过外部对其施加缓慢变化外场的过程,处于基本与外部恒态平衡的状态,使系统的热力学性质发生缓慢变化的过程。
然而,准静态过程不是随意发生的,必须满足三个条件:1. 系统处于内部平衡状态要满足准静态过程的第一个条件,就必须使系统不断地处于内部平衡状态。
内部平衡状态是指系统在平衡状态下内部各个部分的物理状态始终相等,而在准静态过程中,系统的温度、压强等物理状态应该随着时间缓慢变化。
因此,在每个时刻,系统内部各部分的物理状态应保持平衡并随着时间的变化呈缓慢变化。
2. 外场变化率很小要实现准静态过程的第二个条件,就需要使外场的变化率很小。
通常,外场变化率较小是指,外场的变化时间远大于系统中的弛豫时间。
弛豫时间是指,系统内的物理过程所需的时间。
弛豫时间随着物理过程的不同而变化,如果外场变化速度大于弛豫时间,系统将无法达到内部平衡状态,从而无法实现准静态过程。
3. 外场的变化是可逆的准静态过程的第三个条件是,外场的变化应该是可逆的。
这一条件非常重要,可逆过程是指,在完全相反的集成模拟下可以恢复原始状态的过程。
一旦外场变化是不可逆的,这意味着系统不再沿同一路径回到原始状态,熵值始终在增加,系统最终会变成混沌状态,这就是不可逆过程的实现。
这三个条件是准静态过程发生的必要条件。
这些条件有些不能完全满足,但可以接近满足。
热力学过程的准静态过程应该是平衡过程和非平衡过程的结合,热力学的理论建立在研究系统在平衡态下的宏观行为,而准静态过程是将热力学中的平衡态和非平衡态联系在一起的桥梁。
因此,在实际应用中,研究准静态过程,特别是在非平衡态下研究准静态过程,是十分重要的。
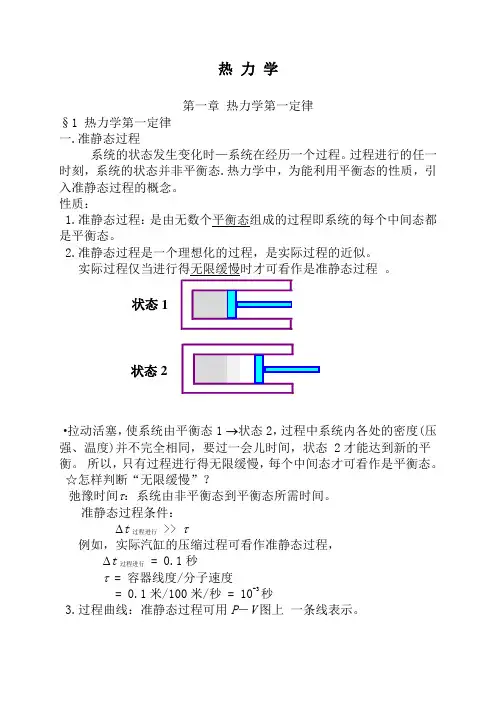
热 力 学第一章 热力学第一定律§1 热力学第一定律 一.准静态过程系统的状态发生变化时—系统在经历一个过程。
过程进行的任一时刻,系统的状态并非平衡态.热力学中,为能利用平衡态的性质,引入准静态过程的概念。
性质:1.准静态过程:是由无数个平衡态组成的过程即系统的每个中间态都是平衡态。
2.准静态过程是一个理想化的过程,是实际过程的近似。
实际过程仅当进行得无限缓慢时才可看作是准静态过程 。
·拉动活塞,使系统由平衡态1 →状态2,过程中系统内各处的密度(压强、温度)并不完全相同,要过一会儿时间,状态 2才能达到新的平衡。
所以,只有过程进行得无限缓慢,每个中间态才可看作是平衡态。
☆怎样判断“无限缓慢”?弛豫时间τ:系统由非平衡态到平衡态所需时间。
准静态过程条件: ∆t 过程进行 >> τ例如,实际汽缸的压缩过程可看作准静态过程, ∆t 过程进行 = 0.1秒τ = 容器线度/分子速度= 0.1米/100米/秒 = 10-3秒3.过程曲线:准静态过程可用P -V 图上 一条线表示。
状态1状态2二.功、内能、热量1.功 ·通过作功可以改变系统的状态。
·机械功(摩擦功、体积功)2.内能·内能包含系统内:(1)分子热运动的能量;(2)分子间势能和分子内的势能;(3)分子内部、原子内部运动的能量; (4)电场能、磁场能等。
·内能是状态的函数*对于一定质量的某种气体,内能一般是T 、V 或P 的函数; *对于理想气体,内能只是温度的函数 E = E (T )*对于刚性理想气体分子, i :自由度; ν :摩尔数 ·通过作功改变系统内能的实质是:分子的有规则运动能量和分子的无规则运动能量的转化和传递。
3.热量·传热也可改变系统的状态,其条件是系统和外界的温度不同。
·传热的微观本质:是分子的无规则运动能量从高温物体向低温物体传递。



热力学基础中的热力学平衡态与热力学过程热力学是研究能量转化与传递规律的学科,其中热力学平衡态和热力学过程是其重要的基础概念。
本文将从热力学平衡态和热力学过程两个方面进行论述,旨在深入解释它们的含义、性质及其在热力学中的重要作用。
一、热力学平衡态热力学平衡态是指系统的各种宏观性质在一段时间内不发生任何变化的状态。
在这种状态下,系统各部分之间的能量传递和物质交换达到了动态的平衡,系统的宏观性质保持稳定。
热力学平衡态的特点主要包括以下几个方面:1. 热力学平衡态的性质稳定。
系统的宏观性质如温度、压力、体积等均保持不变,且在相互间达到平衡。
这种稳定性表明系统内各部分相对于整体来说是静止的,不存在宏观的变化。
2. 热力学平衡态的局部性。
热力学平衡态仅是在系统的各个部分之间达到平衡,而并不要求整个系统都处于平衡态。
例如一个容器内的液体和气体两相共存,虽然液体和气体之间还存在着相互的非平衡现象,但液体和气体分别在自己的相平衡态中。
3. 热力学平衡态的可逆性。
可逆性是热力学平衡态的重要特征之一。
在可逆过程中,系统的宏观性质始终保持稳定,不产生任何熵增,而不可逆过程中则会导致熵的增加。
因此,通过观察熵的变化可以判断系统是处于平衡态还是非平衡态。
二、热力学过程热力学过程是指系统从一个热力学平衡态到另一个热力学平衡态的变化过程。
系统在热力学过程中会发生能量和物质的交换,从而使得整个系统的宏观性质发生变化。
热力学过程的特点如下所述:1. 热力学过程是可逆的或不可逆的。
可逆过程的特点是在系统的所有状态变化过程中都可瞬间变为热力学平衡态,而不可逆过程则存在着无法复原的能量和物质的损失,从而导致系统的宏观性质发生改变。
2. 热力学过程可以是准静态过程或非准静态过程。
准静态过程是指系统的状态变化非常缓慢,以致于系统能够及时地达到平衡态,并且所有步骤可以被视为连续的。
非准静态过程则是指系统的状态变化较快,使得系统无法达到平衡态,其过程是间断的。
热力学中的热力学过程与平衡态热力学是研究能量转化和能量传递规律的科学,其中热力学过程与平衡态是热力学中的重要概念。
本文将介绍热力学过程和平衡态的概念及其在热力学中的重要性。
一、热力学过程热力学过程是指系统从一个状态变化到另一个状态的过程。
根据过程的性质不同,热力学过程可以分为准静态过程、绝热过程和等温过程等。
1. 准静态过程准静态过程是指系统的每个状态变化都接近于平衡态,变化过程十分缓慢。
在准静态过程中,系统内各部分之间的温度、压强、浓度等性质始终保持均匀和一致。
准静态过程可以视为一系列平衡态之间的连续转变。
2. 绝热过程绝热过程是指系统与外界没有热量交换的过程。
在绝热过程中,系统内部的能量只能通过做功或者吸收做功来改变。
绝热过程中,热力学第一定律可以表示为ΔU = Q - W = W,即系统内能的变化等于对外界做功的大小。
3. 等温过程等温过程是指系统与外界保持恒定温度的过程。
在等温过程中,系统从一个状态变化到另一个状态,温度保持不变。
根据理想气体状态方程,等温过程中,气体的压强和体积满足P1V1 = P2V2。
二、平衡态平衡态是指系统各个部分之间达到了动态平衡,没有宏观可观察到的变化。
平衡态分为热平衡、力学平衡、化学平衡等。
1. 热平衡热平衡是指系统内各部分之间达到了相同的温度,并且温度不随时间而变化。
在热平衡状态下,热能没有净传递。
当两个物体处于热平衡状态时,它们之间没有热传递。
2. 力学平衡力学平衡是指系统内各部分的受力之和为零,处于力学平衡的物体不会发生运动。
在力学平衡状态下,物体上的力相互抵消,物体保持静止或匀速直线运动。
3. 化学平衡化学平衡是指化学反应中产物和反应物浓度达到一定比例,反应速率相等,化学反应不再产生净反应。
在化学平衡状态下,反应物和产物之间的反应速率相等,化学反应不再向某一方向改变。
三、热力学过程与平衡态的关系及重要性热力学过程与平衡态密切相关,它们之间存在重要的关系。
热力学中的准静态过程分析热力学是研究能量转化和传递规律的学科,而准静态过程是热力学中的一种重要过程。
本文将对准静态过程进行深入分析,包括定义、特点、计算方法以及准静态过程与实际过程的关系等方面。
一、准静态过程的定义和特点准静态过程是指在热力学系统内,系统各部分之间相互作用的过程相对缓慢,使得系统在整个过程中保持平衡状态。
准静态过程的特点如下:1. 平衡态:在准静态过程中,系统始终处于平衡态,宏观状态参数(如压强、温度、体积)保持稳定。
2. 可逆性:准静态过程是可逆过程的一种特殊情况,因为在整个过程中不存在不可逆的内部耗散。
3. 无宏观动能变化:由于准静态过程的缓慢性质,系统中的宏观动能变化可以忽略不计。
4. 焓守恒:在准静态过程中,系统的焓守恒,即系统的内能变化等于对外做功。
二、准静态过程的计算方法准静态过程的计算方法可以通过对系统进行控制体积或控制压强两种方式进行。
1. 控制体积的准静态过程计算方法:在这种情况下,系统的体积保持不变,通过控制其它参数(如压强、温度)来完成过程。
可以根据理想气体状态方程等进行计算。
2. 控制压强的准静态过程计算方法:在这种情况下,系统的压强保持不变,通过控制其它参数(如体积、温度)来完成过程。
可以根据理想气体状态方程等进行计算。
三、准静态过程与实际过程的关系准静态过程是理论分析中的一种简化假设,而实际过程往往较为复杂,包含了多种内部耗散和非平衡性。
实际过程与准静态过程之间存在一定的差异。
1. 实际过程的不可逆性:在实际过程中,会出现摩擦、传热不均等不可逆现象,使系统无法达到完全平衡状态。
2. 宏观动能的存在:实际过程中,系统的宏观动能变化较为显著,不能忽略不计。
3. 焓守恒的误差:由于实际过程中的不可逆性,系统的焓守恒并不严格成立,虽然误差较小,但需要在计算中加以考虑。
综上所述,准静态过程是热力学中的一种理论假设,能够帮助我们理解系统内部能量转化和传递的基本规律。
第一章概念1.系统:孤立系统、闭系、开系与其他物体既没有物质交换也没有能量交换的系统称为孤立系;与外界没有物质交换,但有能量交换的系统称为闭系;与外界既有物质交换,又有能量交换的系统称为开系;2.平衡态平衡态的特点:1.系统的各种宏观性质都不随时间变化;2。
热力学的平衡状态是一种动的平衡,常称为热动平衡;3.在平衡状态下,系统宏观物理量的数值仍会发生或大或小的涨落;4.对于非孤立系,可以把系统与外界合起来看做一个复合的孤立系统,根据孤立系统平衡状态的概念推断系统是否处在平衡状态.3.准静态过程和非准静态过程准静态过程:进行得非常缓慢的过程,系统在过程汇总经历的每一个状态都可以看做平衡态。
非准静态过程,系统的平衡态受到破坏4.内能、焓和熵内能是状态函数.当系统的初态A和终态B给定后,内能之差就有确定值,与系统由A到达B所经历的过程无关;表示在等压过程中系统从外界吸收的热量等于态函数焓的增加值。
这是态函数焓的重要特性克劳修斯引进态函数熵.定义:5.热容量:等容热容量和等压热容量及比值定容热容量:定压热容量:6.循环过程和卡诺循环循环过程(简称循环):如果一系统由某个状态出发,经过任意一系列过程,最后回到原来的状态,这样的过程称为循环过程。
系统经历一个循环后,其内能不变。
理想气体卡诺循环是以理想气体为工作物质、由两个等温过程和两个绝热过程构成的可逆循环过程。
7.可逆过程和不可逆过程不可逆过程:如果一个过程发生后,不论用任何曲折复杂的方法都不可能使它产生的后果完全消除而使一切恢复原状。
可逆过程:如果一个过程发生后,它所产生的后果可以完全消除而令一切恢复原状.8.自由能:F和G定义态函数:自由能F,F=U-TS定义态函数:吉布斯函数G,G=U-TS+PV,可得GA-GB-W1定律及推论1.热力学第零定律-温标如果物体A和物体B各自与外在同一状态的物体C达到热平衡,若令A与B进行热接触,它们也将处在热平衡.三要素:(1)选择测温质;(2)选取固定点;(3)测温质的性质与温度的关系。
热力学习题答案 Final approval draft on November 22, 2020第9章热力学基础一. 基本要求1. 理解平衡态、准静态过程的概念。
2. 掌握内能、功和热量的概念。
3. 掌握热力学第一定律,能熟练地分析、计算理想气体在各等值过程中及绝热过程中的功、热量和内能的改变量。
4. 掌握循环及卡诺循环的概念,能熟练地计算循环及卡诺循环的效率。
5. 了解可逆过程与不可逆过程的概念。
6. 解热力学第二定律的两种表述,了解两种表述的等价性。
7. 理解熵的概念,了解热力学第二定律的统计意义及无序性。
二. 内容提要1. 内能功热量内能从热力学观点来看,内能是系统的态函数,它由系统的态参量单值决定。
对于理想气体,其内能E仅为温度T的函数,即当温度变化ΔT时,内能的变化功 热学中的功与力学中的功在概念上没有差别,但热学中的作功过程必有系统边界的移动。
在热学中,功是过程量,在过程初、末状态相同的情况下,过程不同,系统作的功A 也不相同。
系统膨胀作功的一般算式为在p —V 图上,系统对外作的功与过程曲线下方的面积等值。
热量 热量是系统在热传递过程中传递能量的量度。
热量也是过程量,其大小不仅与过程、的初、末状态有关,而且也与系统所经历的过程有关。
2. 热力学第一定律 系统从外界吸收的热量,一部分用于增加内能,一部分用于对外作功,即热力学第一定律的微分式为3. 热力学第一定律的应用——几种过程的A 、Q 、ΔE 的计算公式(1)等体过程 体积不变的过程,其特征是体积V =常量;其过程方程为在等体过程中,系统不对外作功,即0=V A 。
等体过程中系统吸收的热量与系统内 能的增量相等,即(2) 等压过程 压强不变的过程,其特点是压强p =常量;过程方程为在等压过程中,系统对外做的功系统吸收的热量 )(12T T C M MQ P molP -=式中R C C V P +=为等压摩尔热容。
(3)等温过程 温度不变的过程,其特点是温度T =常量;其过程方程为pV =常量在等温过程中,系统内能无变化,即(4)绝热过程 不与外界交换热量的过程,其特点是dQ=0,其过程方程pV γ=常量在绝热过程中,系统对外做的功等于系统内能的减少,即7. 循环过程 系统从某一状态出发,经过一系列状态变化后又回到了初始状态的整个变化过程。