第2章 玻尔理论
- 格式:ppt
- 大小:2.44 MB
- 文档页数:56


氢原子光谱(Hydrogen spectral series)卢瑟福的行星模型的困难根据卢瑟福的原子模型,电子像太阳系的行星围绕太阳转一样围绕着原子核旋转。
但是根据经典电磁理论,这样的电子会发射出电磁辐射,损失能量,以至瞬间坍缩到原子核里。
这与实际情况不符,卢瑟福无法解释这个矛盾。
卢瑟福模型遇到的困难实际上是利用经典力学和经典电磁学描述原子的困难,这时候就要利用一种新的方法——量子力学来研究原子。
量子论的提出1900年德国物理学家普朗克(M.Planck)在研究黑体辐射时,为解释辐射能量密度与辐射频率的关系,冲破经典力学的束缚,提出能量量子化的概念。
他认为辐射物体其辐射能的放出式吸收不是连续的,而是一份一份地放出或吸收,每一份辐射能——量子——所代表的能量取决于辐射物体中原子的振荡频率ν即E=hν 。
式中h为普朗克常数,等于6.6262 ×10-34J.S。
1905年德国物理学家爱因斯坦(A.Einstein)为解释光电效应而推广了普朗克的量子概念,认为不仅振荡的原子能量是量子化,而辐射能本身也是量子化的,辐射能也是由一份一份的量子组成的,辐射能和量子也称为光子,提出了光子学说。
建立了量子理论。
氢原子光谱(Hydrogen spectral series)光和电磁辐射1865年麦可斯韦(J.C.Maxwell)指出光是电磁波,即是电磁辐射的一种形式。
电磁辐射包括无线电波、TV波、微波、红外、可见光、紫外X射线、γ射线和宇宙射线。
可见光仅是电磁辐射的一小部分,波长范围是400nm(紫光)至700nm(红光)。
(如右图)太阳光或白炽灯发出的白光,通过玻璃三棱镜时,所含不同波长的光可折射成红、橙、黄、绿、青、蓝、紫等没有明显分界线的光谱,这类光谱称为连续光谱。
当气体原子被激发得到的是分立的、有明显分界的谱线,这类光谱称为不连续光谱或线状光谱。

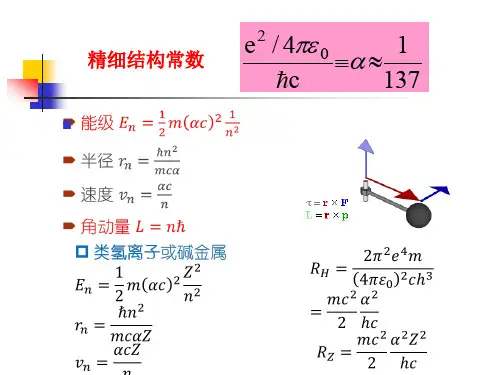



谈谈玻尔理论(河北南宫中学 张朝欣)在物理学史上,玻尔(N.Bohr )的原子原子理论是具有开创性的.㈠ 原子的核式结构对原子能量的描述电子被发现后,卢瑟福(E.Rutherford)在1909至1911年间,通过α粒子散射实验,提出了原子的的核式结构模型:在原子的中心有一个很小的核,叫原子核,原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕核旋转.核外电子和核的关系与行星和太阳的关系类似,卢瑟福将自己的学说称为行星模型. 卢瑟福认为,核外电子在核对它的库仑力的作用下,绕核做匀速圆周运动 rvmre K 222=…………………①由此可得电子动能 reKmvE k 22122==原子的内部能量为电子动能与电势能之和 电势能为 reKE P 2-= (以无穷远为势能零点,中学不要求,可参阅有关书籍)所以原子的内部总能量为reKE E E p k 22-=+=卢瑟福原子的核式结构还是很不完善的,它并没有告诉我们电子在核外是如何分布的,也不能说明不同原子的物理、化学性质不同起源于什么,这是需要进一步探讨的问题.更严重的是,它和经典物理理论不可调和的矛盾.㈡ 原子的核式结构与经典物理理论的矛盾由原子内部能量reKE 22-=可知,r 越大,能量E 越大(绝对值越小).也就是说,只要能量是确定的,则电子轨道半径就是确定的,原子的核式结构就是一个稳定的系统.但是,根据经典的电磁理论来看,情况并非如此.由麦克斯韦的电磁场理论,我们知道,变化的电场产生磁场. 电子绕核做匀速圆周运动,会在空间产生震荡变化的电场,此电场会产生同频率的震荡变化的磁场,磁场再产生电场……互相激发而产生电磁波.也就是说,电子绕核做匀速圆周运动,要辐射电磁波,辐射电磁波的频率等于电子周期运动的频率.辐射电磁波的过程,也是辐射能量的过程.伴随着电磁波的辐射,系统能量也相应减少.由reKE 22-=来看,随着能量E 的减少,电子轨道半径r 变小,最终,电子要落到原子核上.也就是说,按照经典电磁理论,原子应当是不稳定的系统,然而实际上原子是非常稳定的! 另外,按照经典电磁理论,原子辐射电磁波的频率等于电子周期运动的频率.频率rv T⋅==πγ21 ,将①解出v 代入可得32mrK e πγ=由此式可知,随着电子轨道半径r 的减小,频率γ将增大.即随着电磁波的辐射,r 将伴随着能量E 的连续减少而连续地变小,因而辐射电磁波的频率γ将连续地变大.由此可以推断,原子发光光谱应是包含一切频率的连续光谱,然而实际上原子光谱是不连续的.由以上分析可知,将我们熟悉的力学和电磁理论应用于微观的原子系统,推出的结论是原子应该是不稳定的,原子光谱应连续光谱.然而实验事实恰好相反.原子是稳定的,原子光谱是不连续的. 经典理论面临着前所未有的困难!㈢玻尔的原子理论1913年,卢瑟福的学生玻尔在原子的核式结构基础上,在普朗克的能量量子化和爱因斯坦的光子理论启发下,从原子是稳定的,原子光谱是不连续的的实验结果出发,将能量量子化的观点引入原子结构中,提出了一些基本假设,解救了原子行星模型的困境,成功地建立了氢原子理论,并为其它元素的原子结构和性质的研究奠定了基础.玻尔原子理论提出的主要假设为:⑴ 轨道量子化 能量是量子化的,原子的能量状态也是量子化的,即原子只能处于一系列不连续的能量状态中.原子的不同能量状态对应电子的不同运行轨道,由于原子的能量状态也是量子化的,因此电子的可能轨道也是不连续的.电子不能在任意半径的轨道上运行.这种现象叫轨道量子化.玻尔指出,只有满足下列条件的轨道才是可能的:轨道半径r 与电子动量mv 的乘积等于π2h 的整数倍,即 π2h nmvr =,3,2,1=n …… 为正整数,叫量子数⑵ 定态 原子只能处于一系列不连续的能量状态中,在这些状态中原子是稳定的.在这些稳定状态中运动的电子虽然具有加速度,但并不向外辐射能量.这些状态叫定态.一些能量的改变,(不管是由于吸收或辐射电磁波,或由于碰撞的结果)都只能从一个定态变为另一个定态的变化(跃迁)而产生,决不能任意连续地改变.⑶ 跃迁 原子从一个能量状态m E 的定态跃迁到另一个能量状态n E 的定态时,它辐射或吸收一定频率的光子,光子的能量由这两个定态的能级差决定:m n E E h -=γ这个关系叫频率条件。

第4节氢原子光谱与能级结构学习目标知识脉络1。
了解氢原子光谱的特点,明白巴尔末公式及里德伯常量、(重点)2。
理解玻尔理论对氢原子光谱规律的解释、(重点)3、了解玻尔理论的局限性、(难点)错误!1、氢原子光谱的特点(1)从红外区到紫外区呈现多条具有确定波长的谱线;Hα~Hδ的这n个波长数值成了氢原子的“印记”,不论是何种化合物的光谱,只要它里面含有这些波长的光谱线,就能断定这种化合物里一定含有氢、(2)从长波到短波,Hα~Hδ等谱线间的距离越来越小,表现出明显的规律性、2、巴尔末公式1λ=R(错误!—错误!)(n=3,4,5,…),其中R叫做里德伯常量,数值为R=1、096 77581×107m-1。
\o([再判断])1。
氢原子光谱是不连续的,是由若干频率的光组成的。
(√)2、由于原子都是由原子核和核外电子组成的,因此各种原子的原子光谱是相同的、(×)3。
由于不同元素的原子结构不同,因此不同元素的原子光谱也不相同。
(√) [后考虑]氢原子光谱有什么特征,不同区域的特征光谱满足的规律是否相同?【提示】氢原子光谱是分立的线状谱。
它在可见光区的谱线满足巴耳末公式,在红外和紫外光区的其他谱线也都满足与巴耳末公式类似的关系式、\o([核心点击])系的有________条。
【解析】在氢原子光谱中,电子从较高能级跃迁到n=2能级发光的谱线属于巴尔末线系。
因此只有由n=3能级跃迁至n=2能级的1条谱线属巴尔末线系。
【答案】 12、依照巴耳末公式,指出氢原子光谱巴耳末线系的最长波长和最短波长所对应的n,并计算其波长、【解析】对应的n越小,波长越长,故当n=3时,氢原子发光所对应的波长最长。
当n=3时,1λ1=1。
10×107×错误!m-1解得λ1=6、55×10-7m。
当n=∞时,波长最短,错误!=R错误!=R×错误!,λ=4R=41、1×107m=3。


高中物理玻尔理论教案
学科:物理
年级:高中
课时:1
教学目标:
1.了解波尔理论的基本概念和内容;
2.掌握波尔理论中的原子结构和能级的基本原理;
3.能够运用波尔理论解释原子的光谱和能级跃迁;
4.培养学生分析问题和解决问题的能力。
教学重点:
1.波尔理论的基本概念和内容;
2.原子的光谱和能级的解释;
3.能级跃迁的原理。
教学难点:
1.能级跃迁的解释;
2.原子光谱的应用。
教学准备:
1.教材:《物理课本》;
2.多媒体教学设备。
教学过程:
一、导入(5分钟)
教师引入波尔理论的基本概念和历史背景,激发学生对波尔理论的兴趣。
二、讲解波尔理论(15分钟)
1.波尔理论的提出和基本内容;
2.原子结构的描述;
3.能级和量子数的概念。
三、应用波尔理论分析问题(15分钟)
1.波尔理论解释原子的光谱;
2.能级跃迁的过程;
3.量子数的物理意义。
四、课堂练习(10分钟)
学生进行波尔理论相关的练习,加深对波尔理论的理解和掌握。
五、总结与拓展(5分钟)
教师总结本节课的内容,提出问题,引导学生思考波尔理论的应用和拓展。
作业:完成相关习题;查阅资料,了解波尔理论的实验验证。
教学反思:
通过本节课的教学,学生可以了解波尔理论的基本概念和内容,掌握波尔理论的原子结构和能级的基本原理,培养学生分析问题和解决问题的能力。
同时,注重培养学生的实践能力和思考能力,促进学生对物理知识的理解和运用。
玻尔理论玻尔简介尼尔斯。
玻尔,丹麦人,1885年or月7日生于哥本哈根。
其父是哥本哈根大学生理学教授,外祖父是丹麦很有影响的犹太银行家。
玻尔从小受到良好教育,他坦率正直、爱沉思,不甚活跃。
1903年进人哥本哈根大学,主修物理学,兼及数学、天文等。
19的年获科李硕士,1911年获哲学博士。
两篇学术论文都是有关金属电子论的。
1911年9月,他师从汤姆逊研究金属电子论。
1912年拜卢瑟福为师,转而研究原子结构理论。
卢瑟福对他一生产生了巨大影响。
他在卢瑟福实验室看到了一个生气勃勃具有国际性的创造集体,决心把英国的方法移植到丹麦大学中去。
这就是后来的玻尔研究所。
1912年7月底,玻尔回到哥本哈根大学任助理教授,继续研究原子结构理论。
1913年初升任副教授。
28岁的玻尔发表了他的成名作《论原子分子结构》并因此荣获1922年诺贝尔物理学奖。
1916年,31岁的玻尔出任哥本哈根大学为他特设的理论物理学教授。
1921年3月3日他创建的哥本哈根大学理论物理研究所(后改称玻尔研究所)正式成立, 该所以他特有的学术风格和对量子力学的杰出贡献,很快成为量子物理学的“国际首都”。
对应原理和互补原理是和玻尔的名字紧紧连在一起的,它们是玻尔科学哲学思想的核心。
他喜欢与人交流合作,随时愿意与任何人就任何问题作轻松自如灵活多变的讨论,他听凭灵感飘逸,惯于在交谈中进行综合思考,边讨论边孕育和完善新的思想观念。
玻尔对人对事最不抱成见,是一个很随和的人。
他随时准备抛弃现成不合时代的观念,去拥抱代表新时代的新思想;他对经典物理学中的特征,如连续性、决定论和原子发光机制的反思就是如此。
玻尔有一种巨大的魅力,把世界各地的优秀青年物理学家聚集在自己周围。
他有很强的组织能力,为推动国际科学合作做出了不朽的贡献,被誉为“科学国际化之父”。
历史背景玻尔生活的年代,是科学发现层出不穷,科学理论飞速发展,但非常混沌和杂乱的时期。
十九世纪末,经典物理学已日趋完善,而且化学研究中以道尔顿原子论和门捷列夫元素周期律为主体的科学理论,也基本上能够解释物质的组成和化学变化。
第4节玻尔的原子模型__能级一、玻尔的原子结构理论(1)电子围绕原子核运动的轨道不是任意的,而是一系列分立的、特定的轨道,当电子在这些轨道上运动时,原子是稳定的,不向外辐射能量,也不吸收能量,这些状态称为定态。
(2)当原子中的电子从一定态跃迁到另一定态时,才发射或吸收一个光子,其光子的能量hν=E n-E m,其中E n、E m分别是原子的高能级和低能级。
(3)以上两点说明玻尔的原子结构模型主要是指轨道量子化和能量量子化。
[特别提醒]“跃迁”可以理解为电子从一种能量状态到另一种能量状态的瞬间过渡。
二、用玻尔的原子结构理论解释氢光谱1.玻尔的氢原子能级公式E n=E1n2(n=1,2,3,…),其中E1=-13.6 eV,称基态。
2.玻尔的氢原子中电子轨道半径公式r n=n2r1(n=1,2,3,…),其中r1=0.53×10-10 m。
3.玻尔理论对氢光谱解释按照玻尔理论,从理论上求出里德伯常量R H的值,且与实验符合得很好。
同样,玻尔理论也很好地解释甚至预言了氢原子的其他谱线系。
三、玻尔原子结构理论的意义1.玻尔理论的成功之处第一次将量子观念引入原子领域,提出了定态和跃迁的概念,成功地解释了氢原子光谱的实验规律。
2.玻尔理论的局限性不能说明谱线的强度和偏振情况;不能解释有两个以上电子的原子的复杂光谱。
1.判断:(1)玻尔的原子结构假说认为电子的轨道是量子化的。
()(2)电子吸收某种频率条件的光子时会从较低的能量态跃迁到较高的能量态。
()(3)电子能吸收任意频率的光子发生跃迁。
()(4)玻尔理论只能解释氢光谱的巴尔末系。
()答案:(1)√(2)√(3)×(4)×2.思考:卢瑟福的原子模型与玻尔的原子模型有哪些相同点和不同点?提示:(1)相同点:①原子有带正电的核,原子质量几乎全部集中在核上。
②带负电的电子在核外运转。
(2)不同点:卢瑟福模型:库仑力提供向心力,r的取值是连续的。
玻尔理论解析玻尔理论是现代物理学的重要理论之一。
它是由丹麦物理学家尼尔斯.玻尔于1913年提出的,用来解释原子发射和吸收光的能量量子化现象。
本文将对玻尔理论进行深入解析,探讨它的意义和应用。
原子结构与玻尔理论在玻尔理论之前,对原子内部的结构和电子运动的认识非常有限。
人们只知道电子以某种方式绕原子核旋转,但具体的过程和原理并不清楚。
玻尔在研究氢原子时发现了光谱线的量子化现象,即当高能量的电子从外向里跃迁时,会放出特定的频率的光。
他将这种现象归结为电子的能量量子化,即电子只能在能量水平上跃迁,不能跃到中间的过渡状态。
这种跃迁所释放的能量正好与所放出的光的能量相等,从而产生了光谱吸收和发射的现象。
玻尔理论的出现,让我们对原子的电子结构和运动有了更深层次的认识。
根据玻尔理论,原子的电子以离散的能级存在,而这些能级是量子化的。
在每一个能级上,电子的能量是稳定的,不会出现停留在中间的临时状态。
当电子由高能级跃迁到低能级时,会释放出一定能量的光子,称为辐射。
反之,当电子从低能级跃迁到高能级时,会吸收一定能量的光子,称为吸收。
这种跃迁只能发生在某些特定的条件下,如外部激发或热激发。
物理学中的量子观念玻尔理论的出现,不仅深化了对原子结构的认识,也对量子物理学的发展产生了深远影响。
量子观念,即物理学中基本粒子的量子化现象和描述,是从玻尔理论开始的。
在量子观念中,粒子的性质和运动是离散和量子化的,与经典物理学所描述的连续性和定量化的性质有很大的不同。
量子观念的出现,开启了现代物理学的新纪元,对多个物理学分支的发展产生了巨大的推动作用。
应用价值玻尔理论在物理学中的应用价值非常大。
它不仅对原子结构和运动的研究有巨大的促进作用,也同时拓展了理论物理学的应用范围。
该理论广泛应用于物理学、化学、生物学、医学等众多领域中,包括原子能源、材料科学、光学技术、电子学等方面。
玻尔理论的实用价值,让它成为现代物理学中的一项核心理论之一,应用前景广阔。