学生铝的图像题
- 格式:doc
- 大小:184.50 KB
- 文档页数:2

铝元素重要图象现将与铝元素相关的重要图象分析如下,供参考。
1. 向AlCl 3溶液中滴加NaOH 溶液直至过量 原理:↓=+-+33)OH (Al OH 3Al (先)O H 2AlO OH )OH (Al 223+=+--(后)现象:先沉淀后溶解。
图1图象1的特点:图象通过坐标原点,且横坐标上的比值为“3:1”,A 点坐标为(3n ,n )。
2. 向NaOH 溶液中滴加AlCl 3溶液直至过量 原理:O H 2AlO OH 4Al 223+=+--+(先)↓=++-+3223)OH (Al 4O H 6AlO 3Al (后)现象:开始没有沉淀产生,中间产生沉淀,且最终沉淀不溶解。
图2图象2的特点:横坐标上的比值为“3:1”,A 点坐标为(4n ,4n )。
3. 向NaAlO 2溶液中滴加HCl 溶液直至过量原理:↓=+++-322)OH (Al O H H AlO (先)O H 3Al H 3)OH (Al 233+=+++(后)现象:先沉淀后溶解。
图3图象3的特点:图象通过坐标原点,横坐标上的比值为“1:3”,A 点坐标为(n ,n )。
4. 向盐酸溶液中滴加NaAlO 2溶液直至过量原理:O H 2AlH 4AlO 232+=+++-(先) ↓=++-+3223)OH (Al 4O H 6AlO 3Al (后)现象:首先没有沉淀,中间产生沉淀,且最终沉淀不溶解。
图4图象4的特点:横坐标上的比值为“1:3”,A 点坐标为(4n ,4n )。
5. 向NaAlO 2溶液中通入CO 2气体至过量原理:222CO O H 3AlO 2++-(少量)-+↓=233CO )OH (Al 2 222CO O H 2AlO ++-(足量)-+↓=33HCO )OH (Al现象:产生的沉淀逐渐增多,且最终沉淀不溶解。
图5图象5的特点:图象通过坐标原点,先上升后平行(平行于横坐标)。
6. 向AlCl 3溶液中滴加氨水原理:+++↓=⋅+43233NH 3)OH (Al O H NH 3Al 现象:产生沉淀逐渐增多,达到最大值后保持不变。

专题金属镁、铝图像训练1.下列图象均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图,其中正确的是()A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡B.向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡C.向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量D.向含等物质的量浓度的NaOH、Ba(OH)2、NaAlO2的混合溶液中通入二氧化碳至过量2.下列反应中,相关示意图错误的是()将二氧化硫通入到一定量的饱和氯水中将盐酸滴入到NaHCO3和Na2CO3的混合溶液中C D将铜粉加入到一定量的浓硝酸中将铁粉加入到一定量的氯化铁溶液中3.用NaHCO3溶液处理NaAlO2溶液(由Al2O3过量NaOH溶液反应制得),测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积的变化情况如图所示。
下列说法正确的是()A.Al(OH)3的生成是因为NaHCO3促进了NaAlO2的水解B.b点和c点溶液所含微粒种类不同C.NaHCO3溶液的物质的量浓度为1.0 mol·L-1D.d点时:c(Na+)=c(CO2-3)+c(HCO-3)+c(H2CO3)4.在200 mL含Mg2+、Al3+、NH+4、H+、Cl-的溶液中,逐滴加入5 mol·L-1 NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)的关系如图所示。
下列叙述不正确的是()A.x-y=0.01 molB.原溶液中c(Cl-)=0.75 mol·L-1C.原溶液的pH=1D.原溶液中n(Mg2+)∶n(Al3+)=5∶15.有一块镁铝合金,其中镁与铝的质量比是8∶9。
加入足量稀H2SO4使其完全溶解后,再加入NaOH溶液,生成沉淀的质量随NaOH溶液体积变化的曲线如下图,其中正确的是()6.如图所示是向MgCl2和AlCl3的混合溶液中加入一定量NaOH溶液,紧接着再加入一定量稀盐酸,生成沉淀的物质的量y与加入溶液的体积x的关系图。

镁铝的图象专题解析练习【学习目标】1、使学生掌握有关铝的图象知识,并由此来巩固对本部分知识的理解和掌握;2、增强学生识别、分析、解决图象题的能力。
【学习重难点】图象题的解题思路。
【教学过程】一、四个基本图象1、向AlCl3溶液中逐滴滴加NaOH溶液直至过量现象:先产生沉淀,后沉淀消失。
离子方程式:Al3+ + 3OH-= Al(OH)3↓Al(OH)3 + OH-= AlO2-+2H2O2、向NaOH溶液中逐滴滴加AlCl3溶液直至过量现象:离子方程式:3、向NaAlO2溶液中逐滴滴加HCl溶液直至过量现象:离子方程式:4、向HCl溶液中逐滴滴加NaAlO2溶液直至过量现象:离子方程式:二、基本图象的拓展1、若AlCl3溶液中混有MgCl2,向此溶液中逐滴滴加NaOH溶液直至过量,发生了什么反应?图象是怎样的?现象:离子方程式:2、若AlCl3溶液中除混有外MgCl2,还混有盐酸,向此溶液中逐滴滴加NaOH溶液直至过量,发生的反应有何不同,图象有什么样的变化?现象:离子方程式:3、若AlCl3溶液中除混有MgCl2和盐酸外,还混有NH4Cl,向此溶液中逐滴滴加NaOH 溶液直至过量,发生的反应又有何不同,图象又有什么样的变化?现象:离子方程式:[练习] 若含有1molMg2+和1molAl3+的混合溶液,现按下图横坐标依次加入NaOH溶液、盐酸、通入CO2气体,纵坐标为混合沉淀的物质的量。
请画出沉淀的物质的量随反应的变化曲线,并写出各步反应的离子方程式。
【巩固练习】1、向NaOH和NaAlO2的混合液中不断滴加盐酸,下列图象中, 能正确表示上述反应的是(横坐标表示加入HCl溶液的体积, 纵坐标表示反应生成沉淀的质量) ()2、将物质的量相等的硫酸铝和硫酸铵溶水形成V mL混合溶液,向混合溶液中逐滴加入某氢氧化钠的溶液(其物质的量浓度为混合溶液中两溶质的物质的量浓度之和),直至过量。
下列表示氢氧化钠溶液加入的体积(x)与溶液中沉淀物的量(y)的关系示意图中正确的是()3、在一定的硫酸酸化的硫酸铝溶液中逐滴加入氢氧化钡溶液, 用所加入氢氧化钡的溶液的体积(毫升)为横坐标, 以生成沉淀的量(克)为纵坐标, 下列图中正确的是()4、向1.0mol/L的甲溶液中逐滴加入1.0mol/L的乙溶液,产生Al(OH)3沉淀的质量(用y轴表示)与所加入乙溶液的体积(用x轴表示)的关系如下图所示.符合图中关系的是下5、向KAl(SO4)2的溶液中,逐滴滴加Ba(OH)2溶液直至过量,写出各步反应的离子方程式,并完成图象。

高三专题:有关镁、铝、铁的典型图像、推断、实验题1、在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为A、6:1B、3:1C、2:1D、1:22、某溶液中可能含有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。
当加入一种淡黄色固体并加热溶液时,有刺激性气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出沉淀和产生气体的物质的量(纵坐标)的关系,如下图所示。
请填写下列空白:⑴在该溶液中含有的离子是:,它们的物质的量浓度之比为:。
⑵所加的淡黄色固体是(化学式)。
3、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO 4溶液中,然后再滴加1 mol/L NaOH溶液。
请回答:⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
当V1=160mL时,则金属粉末中n(Mg)= mol,V2= mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条件的a的取值范围是:。
4、将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A。
将质量为m的固体A加入到300 mL 2 mol/L盐酸中使之完全溶解。
测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如右图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出)。
已知:①加入固体A的质量m≤3.2 g时,收集到的气体为H2;②当m>3.2 g时,收集到的气体为H2和H2S的混合气体。

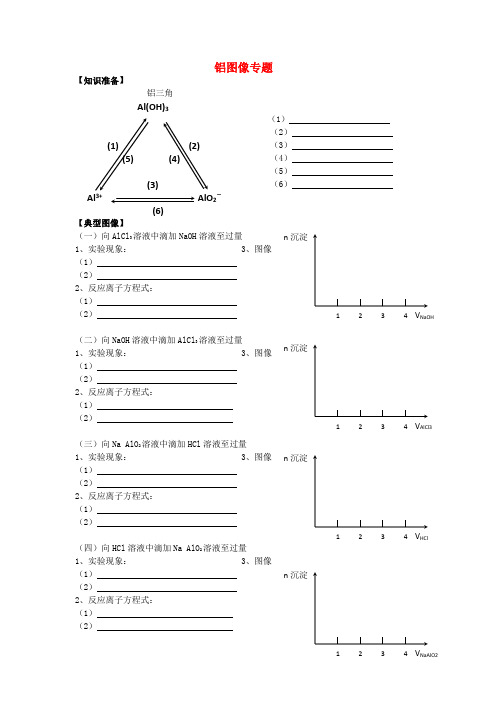
Al(OH)3(1) (2)(5) (4)(3)Al 3+AlO 2-(6)铝图像专题【知识准备】铝三角(1) (2) (3) (4) (5) (6) 【典型图像】(一)向AlCl 3溶液中滴加NaOH 溶液至过量 1、实验现象: 3、图像(1) (2) 2、反应离子方程式: (1) (2)(二)向NaOH 溶液中滴加AlCl 3溶液至过量 1、实验现象: 3、图像(1) (2) 2、反应离子方程式: (1) (2)(三)向Na AlO 2溶液中滴加HCl 溶液至过量1、实验现象: 3、图像(1) (2)2、反应离子方程式: (1) (2) (四)向HCl 溶液中滴加Na AlO 2溶液至过量1、实验现象: 3、图像(1) (2)2、反应离子方程式: (1) (2)【变式训练】现有下列几种情况,分别用哪种图象表示?(1)向AlCl3溶液中加入氨水 (2)向NaAlO2溶液中通入CO2(3)向HCl和AlCl3溶液中加入NaOH溶液 (4)向MgCl2和AlCl3溶液中加入NaOH溶液(5)向AlCl 3和NH 4Cl 混合溶液中加入NaOH 溶液【课后作业】1、 下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是( )A .硫酸铝和氢氧化钠B .硫酸铝和氨水C .偏铝酸钠和硫酸D .硫酸铜和氢氧化钠2、在100ml0.1mol/L 的AlCl 3 溶液中加入3mol/L 的NaOH 溶液,在产生0.39g 沉淀时,加入的NaOH 的体积是多少?3、在100mL0.1mol/L 的NaAlO2溶液中加入1mol/L 的盐酸溶液,在产生0.39g 沉淀时,加入的盐酸的体积是多少?♠ 4、把一小块镁铝合金溶于100mL 盐酸中,然后向其中滴入NaOH L mol 11-⋅溶液,生成沉淀的质量和加入NaOH 溶液的体积如下图所示。
0.58求:(1)镁铝合金的质量组成。
(2)盐酸的物质的量浓度。
(3)B 点沉淀的质量。
九年级化学图像题金属及酸碱盐反应专项训练及答案及解析一、化学图像题金属及酸碱盐反应的图像1.将等质量的铁粉和铝粉分别放入相同溶质质量分数且足量的稀盐酸中充分反应,产生氢气的质量与时间的关系如图所示。
下列说法正确的是A.X表示铁B.X与稀盐酸反应的实验现象是溶液由无色变为浅绿色C.反应消耗的稀盐酸的质量相等D.金属活动性顺序:X> Y【答案】D【解析】【分析】等质量的铁粉和铝粉分别放入相同溶质质量分数且足量的稀盐酸中充分反应,铝产生的氢气质量大,X表示的是金属铝,Y是铁。
【详解】A、X表示的是金属铝,故A错误;B、铝与稀盐酸反应时溶液颜色无明显变化,故B错误;C、反应生成氢气的质量不相等,则消耗的稀盐酸的质量不相等,故C错误;D、由图中可知X完全反应所用时间短,X反应速率较大,则金属活动性顺序是X> Y,故D 正确。
故选D。
2.下列图象能正确反映其对应实验过程中相关量的变化关系的是()A.向饱和的石灰水中加入少量的生石灰B.向等质量分数的稀硫酸中,分别加入足量的镁粉和铁粉C.向稀盐酸中不断加入硝酸银溶液D.向一定质量硝酸银和硝酸铜的混合溶液中加入铁粉【答案】A【解析】【分析】【详解】A、生石灰能与水化合生成氢氧化钙,放出热量,氢氧化钙的溶解度随温度的升高而减小,向饱和的石灰水中加入少量的生石灰,温度升高,溶液中溶质质量减小,当温度恢复到室温时溶质质量增大,反应过程消耗了水,最后溶液中溶质的质量小于原来的质量,图像与事实相符,故A正确;B、稀硫酸是等质量且等质量分数,硫酸的质量是相同的,镁和铁的质量是足量的,稀硫酸一定会反应完,由于产生氢气的氢元素全部来自硫酸,所以生成氢气质量相等;镁和铁与稀硫酸反应化学方程式分别为:Mg + H2SO4 = MgSO4 + H2↑,Fe + H2SO4 = FeSO4 + H2↑,根据化学方程式可知,每24份质量镁可生成2份质量的氢气,每56份质量镁可生成2份质量的氢气,所以消耗等质量的金属时,镁产生的氢气多,图像与事实不相符,故B错误;C、盐酸与硝酸银反应生成氯化银沉淀和硝酸,由于有硝酸生成,向稀盐酸中不断加入硝酸银溶液,溶液的pH不会升高到7,图像与事实不相符,故C错误;D、在发生置换反应时,活泼金属一般会先置换活动性较弱的金属,然后再置换活动性较强的金属,铁先与硝酸银发生置换反应后会生成硝酸亚铁和银,根据化学方程式2AgNO3+Fe=Fe(NO3)2+2Ag可知,每56份铁能生成216份质量银,溶液质量会逐渐变小,铁与硝酸铜发生置换反应后生成硝酸亚铁和铜,根据化学方程式Fe+ Cu(NO3)2= Cu + Fe(NO3)2可知,每56份铁能生成64份质量银,溶液质量会逐渐变小。
2018_2019学年北京高三化学总复习 铝元素有关的图像总结一、基本图像(1)、向AlCl 3溶液中逐滴滴加NaOH 溶液直至过量Al 3+ + 3OH - = Al(OH)3↓Al(OH)3 + OH - = AlO 2- + 2H 2Al 3+ + 4OH - = AlO 2- + 2H 2O(2)向NaOH 溶液中逐滴滴加AlCl 3溶液直至过量Al 3+ + 4OH - = AlO 2- + 2H 2O Al 3+ + 3AlO 2- + 6H 2O = 4Al(OH)3↓(3)向NaAlO 2溶液中逐滴滴加HCl 溶液直至过量 AlO2- + H + + H 2O = Al(OH)3 ↓3H + + Al(OH)3 = Al 3+ + 3H 2O 4H+ + AlO 2- = Al 3++ 2H 2O(4)向HCl 溶液中逐滴滴加NaAlO 2 溶液直至过量4H + + AlO 2- = Al 3+ + 2H 2O Al 3+ + 3AlO 2- + 6H 2O = 4Al(OH)3↓(5)向盐酸、氯化铝、氯化镁的混合溶液中逐滴滴加NaOH 溶液直至过量 2O3+3NaOH=Al(OH)3↓+3NaCl 2+2NaOH=Mg(OH)2↓+2NaCl 3+NaOH=NaAlO 2+2H 2O2 ) 沉淀 0 NaOH(6)向NaAlO 2溶液通入CO 2到过量2NaAlO 2+CO 2+3H 2O=2Al(OH)3↓+Na 2CO 3Na 2CO 3+CO 2+H 2O=NaHCO 3(7)向AlCl 3溶液中逐滴滴加氨水溶液直至过量AlCl 3+3NH 3·H 2O=Al (OH )3↓+NH 4Cl(8)向氢氧化钙溶液中通入CO 2到过量Ca (OH )2+CO 2=CaCO 3↓+H 2OCaCO 3+H 2O+CO 2=Ca (HCO 3)2二、试剂的滴加顺序不同产生的现象不同1、NaOH 和AlCl 3:向AlCl 3溶液中滴加NaOH 溶液,先出现白色沉淀后消失:Al 3++3OH -=Al(OH)3↓ Al(OH)3+OH -=AlO 2-+2H 2O向NaOH 溶液中滴加AlCl 3溶液,开始无现象后出现白色沉淀:Al 3++4OH -= AlO 2-+2H 2O Al 3++3AlO 2-+6H 2O=4Al(OH)3↓2、NaAlO 2和盐酸:向NaAlO 2溶液中滴加盐酸,先出现白色沉淀后消失:NaAlO 2+HCl+H 2O= Al(OH)3↓+NaCl Al(OH)3+3H +=Al 3++3H 2O向盐酸中滴加NaAlO 2溶液,开始无现象后出现白色沉淀:4HCl+NaAlO 2= NaCl+AlCl 3+2H 2O AlCl 3+3NaAlO 2+6H 2O=4Al(OH)3↓+3NaCl3、Na 2CO 3和盐酸:向Na 2CO 3溶液中滴加盐酸,开始无现象,后产生气泡:Na 2CO 3+HCl=NaCl+NaHCO 3 NaHCO 3+HCl=NaCl+H 2O+CO 2↑向盐酸中滴加Na 2CO 3溶液,立即产生气泡:Na 2CO 3+2HCl=2NaCl+H 2O+CO 2↑4硝酸银溶液和氨水(1) 将氨水逐滴加入到硝酸银溶液中现象:开始生成白色沉淀,后沉淀消失,生成银氨溶液方程式:AgNO 3+NH 3·H 2O=AgOH ↓+NH 4NO 3 AgOH+2NH 3·H 2O=Ag (NH 3)2OH+2H 2O(2) 将硝酸银溶液加入到氨水中,现象:没有沉淀。
【化学】九年级化学图像题金属及酸碱盐反应试题(有答案和解析)及解析一、化学图像题金属及酸碱盐反应的图像1.相同质量的M、N两种活泼金属,分别与足量的稀盐酸反应(M、N在生成物中均为+2价),生成H2的质量和反应时间的关系如图。
下列叙述正确的是()A.金属的活泼性N>MB.两个反应生成H2的体积相等C.相对原子质量N>MD.两个反应消耗盐酸的质量一定相等【答案】C【解析】【分析】【详解】A、根据图像可知,相同质量的M、N两种活泼金属,分别与足量的稀盐酸反应,完全时M所用时间较少,所以M比N反应的速度快,所以金属的活泼性M>N,故A错误;B、根据图像可知,M产生的氢气多,N产生的氢气少,两种金属产生的氢气质量不同,两个反应生成H2的体积不相等,故B错误;C、根据图像可知,M产生的氢气比N多,价态相同的金属与足量的酸反应,相对原子质量越大,产生的氢气越少,说明N的相对原子质量大,故C正确;D、相同质量的M、N两种活泼金属,分别与足量的稀盐酸反应,生成氢气中的氢元素全部来自酸,根据图像可知,两个反应产生的氢气不相等,所以两个反应消耗盐酸的质量不相等,故D错误。
故选C。
2.如图所示的四个图象,能正确反映对应变化关系的是()A.镁在氧气中燃烧B.等质量的镁、铝分別与质量分数相等且足量的稀硫酸反应C.向二氧化锰中加入过氧化氢溶液D.向一定量铁粉和铜粉的混合物中加入硫酸铜溶液【答案】C【解析】【分析】【详解】A、镁在氧气中燃烧生成氧化镁,镁和氧气不可能同时过量,选项错误;B、镁比铝活泼,所以等质量的镁、铝与足量酸反应,镁反应需要时间短,但等质量的镁、铝和稀硫酸反应后铝生成的氢气多,选项错误;C、二氧化锰能加快过氧化氢生成氧气的速率,则向二氧化锰中加入过氧化氢溶液,随着过氧化氢的加入,不断产生氧气,氧气的质量逐渐增加,选项正确;D、向一定量铁粉和铜粉的混合物中加入硫酸铜溶液,硫酸铜和铁立即反应生成硫酸亚铁和铜,固体质量增大,直至铁粉完全反应后固体的质量不再增加,即图像应从零点开始,选项错误,故选C。
2、铝三角转化及铝的图像问题
(1) 向Al3+的溶液中加入强碱(OH―)
现象:先出现白色溶液后消失
方程式:Al3++3OH―==A l(O H)3↓A l(O H)3+OH―==AlO2―+H2O 图像:
(2) 向强碱溶液中加入Al3+
现象:先没有沉淀后出现并不消失
方程式:Al3++4OH―==AlO2―+2H2O 3AlO2―+Al3++6H2O==4A l(O H)3↓图像:
(3) 向AlO2―溶液中加入H+
现象:先生成白色沉淀,然后白色沉淀逐渐溶解。
方程式:AlO2―+H++H2O==A l(O H)3↓A l(O H)3+3H+==Al3++3H2O 图像:
(4) 向H+溶液中加入AlO2―
现象:开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解
方程式:AlO2―+4H+==Al3++2H2O
3AlO2―+Al3++6H2O==4A l(O H)3↓
图像:
例1、有一定质量的Mg、Al 合金投入100 mL一定物质的量浓度的盐酸溶液中,合金全部溶液,向所得溶液中滴加5 mol/L NaOH溶液到过量,生成沉淀的质量与加入NaOH溶液的体积关系如图所示,求(1) 原合金中Mg、Al的质量各是多少?(2) HCl的浓度是多少?
1、0.1molAl2(SO4)3跟2mol/L NaOH溶液350mL混合,所得沉淀的质量为( )
A.78g
B.15.6g
C.7.8g
D.3.9g
2.向10mL 0.2mol/L的AlCl3溶液中,逐滴加入未知浓度的Ba(OH)2溶液,测得滴加15mL和45mL 时,所得沉淀同样多,求Ba(OH)2溶液的物质的量浓度。
例2、将0.1 mol的镁、铝混合物溶于100 mL 2mol/LH2SO4溶液中,然后再滴加1 mol/L NaOH溶液。
请回答:
⑴若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如右图所示。
当V1
=160mL时,则金属粉末中n(Mg)=mol,V2=mL。
⑵若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入
NaOH溶液的体积
V(NaOH)mL。
⑶若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。
满足此条件的a的取值范围是:。
1.将溶液(或气体)X逐渐加入到(或通入到)一定量的Y溶液中,产生沉淀的量m与加入X物
质的量n的关系如下图,符合图中情况的一组物质是
2.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58克白色沉淀,在所得浊液中,逐滴加入0.5mol/l的盐酸,加入盐酸的体积与生成沉淀的质量关系如右图所示:
(a)混合物中NaOH的质量为;(b)混合物中AlCl3质量为
(c)混合物中MgCl2质量为;(d)P点表示盐酸的体积是。
3、向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8g的沉淀,则加
入的NaOH溶液体积为()A.100 mL B. 200 mL C.300 mL D.400mL。