蛋白质专题定
- 格式:ppt
- 大小:1.51 MB
- 文档页数:30

高中生物蛋白质小专题(精选.)1.教材中和蛋白质有关的知识点归纳:2.自然界常见蛋白质的成分(1)大部分酶:酶是活细胞产生的一类具有生物催化作用的有机物,除少数的酶是RNA外,绝大多数的酶是蛋白质。
(2)部分激素:如胰岛素、生长激素,其成分为蛋白质。
(3)载体:位于细胞膜上,在物质运输过程中起作用,其成分为蛋白质。
(4)抗体:指机体受抗原刺激后产生的,并且能与该抗原发生特异性结合的具有免疫功能的球蛋白。
主要分布于血清中,也分布于组织液等细胞外液中。
(5)抗毒素:属于抗体,成分为蛋白质。
一般指用外毒素给动物注射后,在其血清中产生的能特异性中和外毒素毒性的成分。
(6)凝集素:属于抗体,成分为蛋白质。
指用细菌给动物注射后,在其血清中产生的能使细菌发生特异性凝集的成分。
另外,人体红细胞膜上存在不同的凝集原,血清中则含有相应种类的凝集素。
(7)部分抗原:引起机体产生抗体的物质叫抗原,某些抗原成分是蛋白质。
如红细胞携带的凝集原、决定病毒抗原特异性的衣壳,其成分都是蛋白质。
(8)神经递质的受体:突触后膜上存在的一些特殊蛋白质,能与一定的递质发生特异性的结合,从而改变突触后膜对离子的通透性,激起突触后膜神经元产生神经冲动或发生抑制。
(9)朊病毒:近年来发现的,其成分为蛋白质,可导致疯牛病等。
(10)糖被:位于细胞膜的外表面,由蛋白质和多糖组成,有保护、润滑、识别等作用。
(11)单细胞蛋白:指通过发酵获得的大量微生物菌体。
可用作饲料、食品添加剂、蛋白食品等。
(12)丙种球蛋白:属于被动免疫生物制品。
(13)细胞色素C:是动、植物细胞线粒体中普遍存在的一种呼吸色素,由一条大约含有110个氨基酸的多肽链组成。
(14)血浆中的纤维蛋白原和凝血酶原:均为蛋白质。
在凝血酶原激活物的作用下,凝血酶原转变成凝血酶,在凝血酶的作用下纤维蛋白原转变成不溶性纤维蛋白,起到止血和凝血作用。
(15)血红蛋白:存在于红细胞中的含Fe2+的蛋白质。
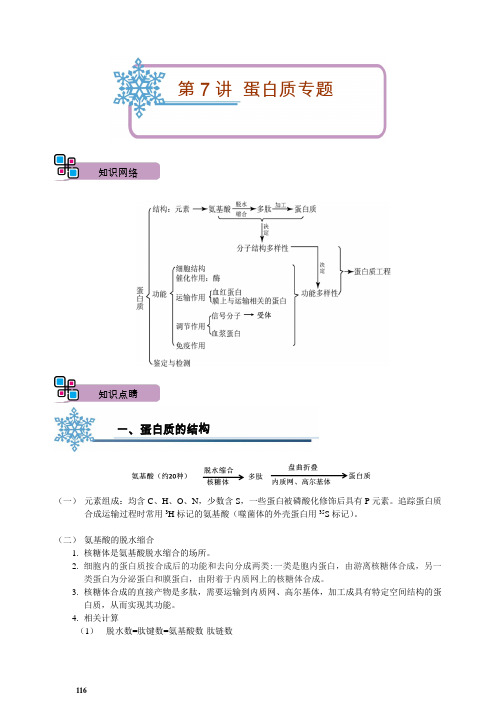
第7讲蛋白质专题知识网络知识点睛一、蛋白质的结构(一)元素组成:均含C、H、O、N,少数含S,一些蛋白被磷酸化修饰后具有P元素。
追踪蛋白质合成运输过程时常用3H标记的氨基酸(噬菌体的外壳蛋白用35S标记)。
(二)氨基酸的脱水缩合1.核糖体是氨基酸脱水缩合的场所。
2.细胞内的蛋白质按合成后的功能和去向分成两类:一类是胞内蛋白,由游离核糖体合成,另一类蛋白为分泌蛋白和膜蛋白,由附着于内质网上的核糖体合成。
3.核糖体合成的直接产物是多肽,需要运输到内质网、高尔基体,加工成具有特定空间结构的蛋白质,从而实现其功能。
4.相关计算(1)脱水数=肽键数=氨基酸数-肽链数116肽链数氨基酸数肽键数脱水数氨基酸平均分子量蛋白质相对分子质量氨基数羧基数m n n-m n-m a na-(n-m)×18 至少m个至少m个(2)多肽种类的计算如:有5种氨基酸,组成的三肽有53=125种,如果氨基酸种类不重复则有5×4×3=60种(3)氨基酸数、mRNA的碱基数和DNA的碱基数比较内容数量基因中能编码蛋白质的碱基数6mmRNA上的碱基数3m蛋白质中的氨基酸数m①基因中部分序列不转录,准确的说,基因上碱基数目比对应的mRNA上碱基数目的2倍还要多一些;②真核基因编码区中的内含子只转录成前体mRNA,但不翻译;③翻译时,mRNA上的终止密码子不决定氨基酸,准确的说,mRNA上的碱基数目比对应的蛋白质中氨基酸数目的3倍还要多一些。
基因上的碱基数目比对应的蛋白质中氨基酸数目的6倍还要多一些。
因此,在回答问题时,应加上“最多”或“至少”。
如:mRNA上有n个碱基,转录产生它的基因中至少有2n个碱基;该mRNA指导合成的蛋白质中最多有n/3个氨基酸。
(三)多肽的加工修饰1.肽段的切除:由专一性的蛋白酶催化,将部分肽段切除,使蛋白质能够正确盘曲折叠,形成有功能的蛋白质。
(1)胰岛素的合成(2)血液中的凝血酶原2.甲硫氨酸的切除:当起始密码子AUG对应的氨基酸是甲硫氨酸,使得多肽链合成时第一个氨基酸是甲硫氨酸。

“蛋白质相关计算”专题一、氨基酸、多肽、肽键、肽链和蛋白质的关系可归纳成下图:例题1.能正确表示蛋白质分子由简到繁的结构层次的一组是:①氨基酸②C、H、O、N 等化学元素③氨基酸分子互相结合④多肽⑤肽链⑥形成具有一定空间结构的蛋白质分子()A.①②③④⑤⑥ B.②①④③⑤⑥ C.②①④③⑥⑤ D.②①③④⑤⑥二、求氨基酸的分子式此类题型的关键就是按照氨基酸分子通式和所给R基写出氨基酸的分子式,涉及到多肽时则根据脱水缩合原理反向推断。
例题2.谷胱甘肽(C10H17O6N3S)是存在于动植物和微生物细胞中的一种重要三肽,它是由谷氨酸(C5H9O4N)、甘氨酸(C2H5O2N)和半胱氨酸缩合而成的,则半胱氨酸可能的分子式为()A.C3H3NS B.C3H5NS C.C3H7O2NS D.C3H3O2NS三、有关蛋白质中氨基酸数、肽链数、肽键数、脱水数的计算1.n个氨基酸脱水缩合形成一条多肽链,则肽键数=脱水数=氨基酸数-1=(n−1)个;2.n个氨基酸脱水缩合形成一个由m条多肽链组成的蛋白质时,则脱去的水分子数和形成的肽键数为(n-m)个;3.无论蛋白质中有多少条肽链,始终有:脱水数=肽键数=氨基酸数-肽链数;4.注:环状肽特点是肽键数与氨基酸数相同。
即肽键的数目=脱去的水分子的数目=氨基酸的数目。
例题3.某蛋白质分子共有四条肽链,300个肽键,则形成这个蛋白质分子所需氨基酸分子数以及它们在脱水缩合过程中生成的水分子数分别是()A.296和296 B.304和304 C.304和300 D.300和300例题4.某三十九肽中共有丙氨酸4个,现去掉其中的丙氨酸得到4条长短不等的多肽(如图),这些多肽中肽键总数为()A.31 B.32C.34 D.35例题5.氨基酸分子脱水缩合形成含2条肽链的蛋白质分子时,相对分子量减少了900,由此可知,此蛋白质分子中含有的氨基酸数和肽键数分别是()A.52、52 B.50、50 C.52、50 D.50、49四、有关蛋白质中游离的氨基或羧基数目的计算氨基酸间脱水缩合时,原来的氨基和羧基已不存在,形成的多肽的一端是-NH2,另一端是—COOH,所以对于n条肽链的多肽,每1条肽链至少应有1个-NH2,1个—COOH,若还有--NH2或—COOH,则存在于R基中。


专题03 蛋白质1.组成蛋白质的氨基酸及其种类(1)组成元素:C 、H 、O 、N ,有的还含有P 、S 等。
(2)结构特点①氨基和羧基的数量:每个氨基酸至少有一个氨基和一个羧基。
②氨基和羧基的连接位置:都有一个氨基和一个羧基连接在同一个碳原子上。
③氨基酸不同的决定因素:R 基的不同。
(3)种类:约20种。
根据能否在人体内合成⎩⎪⎨⎪⎧ 必需氨基酸8种,婴儿9种非必需氨基酸12种2.蛋白质的结构及其多样性(1)二肽的形成过程①过程a 名称:脱水缩合,场所为核糖体。
②物质b 名称:二肽。
③结构c 名称:肽键,其结构简式为:—NH —CO —(或—CO —NH —)。
④H 2O 中各元素的来源:H 来自—COOH 和—NH 2,O 来自—COOH 。
⑤多个氨基酸发生脱水缩合,产物名称为多肽。
(2)蛋白质的结构层次 氨基酸―――→脱水缩合多肽―――――→盘曲、折叠蛋白质(3)蛋白质分子多样性的原因①氨基酸⎩⎪⎨⎪⎧a.种类不同b.数目成百上千c.排列顺序千变万化②多肽链的盘曲、折叠方式及其形成的空间结构千差万别。
3.蛋白质的功能(连线)一、巧用“一、二、三、四、五”助记蛋白质的结构与功能二、利用原子守恒法进行蛋白质的计算氨基酸的结构通式是解答此类题目的突破口。
在一个氨基酸中,若不考虑R基,至少含有2个碳原子、2个氧原子、4个氢原子和1个氮原子。
在脱水缩合形成多肽时,要失去部分氢、氧原子,但是碳原子、氮原子的数目不会减少。
其相关数量关系如下:(1)碳原子数=氨基酸的分子数×2+R基上的碳原子数。
(2)氢原子数=各氨基酸中氢原子的总数-脱去的水分子数×2。
(3)氧原子数=各氨基酸中氧原子的总数-脱去的水分子数。
(4)氮原子数=肽链数+肽键数+R基上的氮原子数=各氨基酸中氮原子的总数。
(5)由于R基上的碳原子数不好确定,且氢原子数较多,因此以氮原子数或氧原子数的计算为突破口,计算氨基酸的分子式或氨基酸个数最为简便。

蛋白质定量的五种方法方法一双缩脲法测定蛋白质浓度[目的]掌握双缩脲法测定蛋白质浓度的原理和标准曲线的绘制。
[原理]双缩脲(NH2CONHCONH2)在碱性溶液中与硫酸铜反应生成紫红色化合物,称为双缩脲反应,蛋白质分子中含有许多肽键(-CONH-)在碱性溶液中也能与Cu2+反应产生紫红色化合物。
在一定范围内,其颜色的深浅与蛋白质浓度成正比。
因此,可以利用比色法测定蛋白质浓度。
双缩脲法是测定蛋白质浓度的常用方法之一。
操作简便、迅速、受蛋白质种类性质的影响较小,但灵敏度较差,而且特异性不高。
除-CONH-有此反应外,-CONH2、-CH2NH2、-CS-NH2等基团也有此反应。
[操作]取中试管7支,按下表操作。
各管混匀、放置37℃水浴中保温20分钟。
用540nm比色,以空白管调零点,读取各管光密度值。
[计算](一)在座标纸上以光密度为纵座标,以蛋白质浓度为横座标绘制标准曲线。
(二)从标准曲线中查出待测血清样本的蛋白质浓度(g/L),并求出人血清样本的蛋白质浓度。
(三)再从标准管中选择一管与测定管光密度相接近者,求出人血清样本的蛋白质浓度(g/L)。
[器材]中试管7支,l毫升刻度吸管3支,10毫升刻度吸管1支,水浴箱,721型分光光度计、坐标纸。
[试剂](—)6N NaOH:称取240g氢氧化钠溶于1000ml水中。
(二)双缩脲试剂:称取CuS04·5H2O 3.0克,酒石酸钾9.0 克和碘化钾5.0克,分别溶解后混匀,加6N NaOH l00ml,最后加水至1000ml,贮于棕色瓶中,避光,可长期保存。
如有暗红色沉淀出现,即不能使用。
(三)0.9%NaCl。
(四)蛋白质标准液(10mg/m1),称取干燥的牛血清蛋白100.0mg,以少量生理盐水溶解后倒入l0ml容量瓶中,淋洗称量瓶数次,一并倒入容量瓶中,最后加生理盐水至刻度线,或用凯氏定氮法测定血清蛋白质含量,然后稀释成l0mg /m1作为蛋白质标准液。
“蛋白质相关计算”专题一、氨基酸、多肽、肽键、肽链和蛋白质的关系可归纳成下图:例题1.能正确表示蛋白质分子由简到繁的结构层次的一组是:①氨基酸②C、H、O、N 等化学元素③氨基酸分子互相结合④多肽⑤肽链⑥形成具有一定空间结构的蛋白质分子()A.①②③④⑤⑥ B.②①④③⑤⑥ C.②①④③⑥⑤ D.②①③④⑤⑥二、求氨基酸的分子式此类题型的关键就是按照氨基酸分子通式和所给R基写出氨基酸的分子式,涉及到多肽时则根据脱水缩合原理反向推断。
例题2.谷胱甘肽(C10H17O6N3S)是存在于动植物和微生物细胞中的一种重要三肽,它是由谷氨酸(C5H9O4N)、甘氨酸(C2H5O2N)和半胱氨酸缩合而成的,则半胱氨酸可能的分子式为()A.C3H3NS B.C3H5NS C.C3H7O2NS D.C3H3O2NS三、有关蛋白质中氨基酸数、肽链数、肽键数、脱水数的计算1.n个氨基酸脱水缩合形成一条多肽链,则肽键数=脱水数=氨基酸数-1=(n−1)个;2.n个氨基酸脱水缩合形成一个由m条多肽链组成的蛋白质时,则脱去的水分子数和形成的肽键数为(n-m)个;3.无论蛋白质中有多少条肽链,始终有:脱水数=肽键数=氨基酸数-肽链数;4.注:环状肽特点是肽键数与氨基酸数相同。
即肽键的数目=脱去的水分子的数目=氨基酸的数目。
例题3.某蛋白质分子共有四条肽链,300个肽键,则形成这个蛋白质分子所需氨基酸分子数以及它们在脱水缩合过程中生成的水分子数分别是()A.296和296 B.304和304 C.304和300 D.300和300 例题4.某三十九肽中共有丙氨酸4个,现去掉其中的丙氨酸得到4条长短不等的多肽(如图),这些多肽中肽键总数为()A.31 B.32C.34 D.35例题5.氨基酸分子脱水缩合形成含2条肽链的蛋白质分子时,相对分子量减少了900,由此可知,此蛋白质分子中含有的氨基酸数和肽键数分别是()A.52、52 B.50、50 C.52、50 D.50、49四、有关蛋白质中游离的氨基或羧基数目的计算氨基酸之间脱水缩合时,原来的氨基和羧基已不存在,形成的多肽的一端是-NH2,另一端是—COOH,所以对于n条肽链的多肽,每1条肽链至少应有1个-NH2,1个—COOH,若还有--NH2或—COOH,则存在于R基中。
蛋白质合成过程的中的相关计算一.蛋白质中肽键个数或形成蛋白质时失去的水分子数1.肽键数=失去的水分子数=蛋白质中氨基酸总数—肽链的条数2.若为环状蛋白,则为:肽键数=失去的水分子数=蛋白质中氨基酸个数注:若题中没有表明,则按非环状蛋白处理。
例1:结晶牛胰岛素由α、β两条多肽链构成,α链含21个氨基酸、β链含30个氨基酸,其失去的水分子数及形成的肽键数目分别是 ( )A.51和5l B. 50和50 C.50和49 D.49和49变式练习1:人体血红蛋白分子中的一条多肽链有145个肽键,则形成这条多肽链的氨基酸分子数和它们在缩合过程中生成的水分子数分别是 ( )A.145和145 B.145和144 C.145和146 D.146和145二.蛋白质的平均分子量的计算蛋白质的平均分子量=蛋白质中氨基酸总数×20种氨基酸的平均分子量-失去的水分子数×18(若有二硫键,则应再减去二硫键的个数×2)补充:二硫键的形成。
-SH +HS-=-S-S-+2H例2.一种蛋白质是由两条肽链构成的,共含有100个氨基酸,若每个氨基酸的相对分子质最平均是120,则该蛋白质的相对分子质量约是 ( )A.12 000 B. 10 236 C .10 218 D. 13 764变式练习2:某蛋白质分子的相对分子质量为10 412,20种氨基酸的平均相对分子质量为128,在形成该蛋白质分子时脱去的水分子总质量为1 620,则该蛋白质分子的肽链数为( ) A.一条B.两条C.三条D.四条三.蛋白质中氨基数或羧基数(1) 蛋白质中氨基数或羧基数(共)有多少个①氨基数=肽链数十R基上的氨基数=各氨基酸中氨基总数一肽键数②羧基数=肽链数十R基上的羧基数=各氨基酸中羧基总数一肽键数例3:现有氨基酸800个,其中氨基总数为810个,羧基总数为808个,则由这些氨基酸合成的含有2条肽链的蛋白质共有肽键、氨基和羧基的数目依次分别为( ) A.798、2和2 B.798、12和10 C.799、1和I D.799、11和9(2) 蛋白质中氨基数或至少..有多少个至少..有羧基(数)=肽链数..有氨基(数)=至少例4.人体免疫球蛋中,IgG由4条肽链构成,共有764个氨基酸,则该蛋白质分子中至少含有游离的氨基和羧基数分别是 ( )A.746和764 B.760和760 C.762和762 D.4和4变式训练3.某蛋白质由4条肽链组成,共含有109个肽键,则此蛋白质分子,至少含有一NH2和一COOH个数及氨基酸数分别为多少个 ( )A.105,105,105 B.110,110,110 C.4,4,113 D. 1,1,113 注:若为环状蛋白呢?(3)环状肽中Aa l,Aa 2,…,Aa 6表示6种氨基酸,它们相互缩合形成的环状肽如图所示:由图示可知:肽键数=脱去水分子数=氨基酸数,环状肽主链中无氨基和羧基,环状肽中氨基或羧基数取决于构成环状肽氨基酸R基团中的氨基和羧基的数目。
蛋白质知识专题复习蛋白质是构成细胞和生物体的基本物质,是生命现象的承担者,没有蛋白质就没有生命。
有关蛋白质的知识是《生物》必修教材中的重点内容之一。
为此,笔者就蛋白质方面的知识进行专题复习。
一、蛋白质的基本组成单位蛋白质是一种高分子有机化合物.其基本组成单位是氨基酸,氨基酸的基本组成元素是C、H、0、N,氨基酸的结构通式是不同的氨基酸分子具有不同的R基。
判断一种物质是否为组成生物体蛋白质的氨基酸,可用通式去对照;判定某种蛋白质或多肽由几种氨基酸组成,就看该化合物中R基的种类。
例l:赖氨酸的R基为一(CH2)NH2,在一个赖氨酸分子中,含有碳和氮的原子个数依次是 ( )A.6:14 B.6:2 C.4:6 D.2:6解析:根据氨基酸的通式可知赖氨酸的分子式为 C6H1402N2,所以,C和N的原子个数为6和2。
答案:B二、蛋白质的分子结构1.脱水缩合:脱水缩合是指一个氨基酸分子的一COOH与另一个氨基酸分子的一NH2相连接,同时失去一分子水的结合方式。
图示如下:2.肽键:肽键是指连接两个氨基酸分子的化学键,结构式可表示为一CO—NH一或一NH—CO一或任何蛋白质或多肽化合物的肽键结构和组成元素均是相同的。
3.多肽和肽链:由多个氨基酸分子通过肽键连接起来的化合物均称为多肽.多肽通常呈非常复杂的链状,故又称肽链。
一个蛋白质分子可以含一条或几条肽链.肽链与肽链之间通过一定的化学键结合起来,肽链只有经过有规则的盘绕、折叠成一定的空间结构后才是蛋白质,所以多肽并非就是蛋白质。
由于每两个彼此相邻的氨基酸脱水缩合才形成一个肽键.因此,每条肽链的左、右两端一定是游离的一NH2和一COOH。
如果构成某蛋白质的所有氨基酸的R基上都不带一NH,和一COOH。
那么,蛋白质分子中至少含有的氨基数=至少含有的羧基数=肽链数。
4.多样性和稳定性:氨基酸的种类、数目、排列顺序和肽链数以及肽链的空间结构的不同。
使蛋白质分子的结构极其多样.其分子结构的多样性决定了生理功能的多样性。
实验一蛋白质的定量测定蛋白质的定量分析是生物化学和其它生命学科最常涉及的分析内容,是临床上诊断疾病及检查康复情况的重要指标,也是许多生物制品,药物、食品质量检测的重要指标。
在生化实验中,对样品中的蛋白质进行准确可靠的定量分析,则是经常进行的一项非常重要的工作。
蛋白质是一种十分重要的生物大分子:它的种类很多,结构不均一,分子量又相差很大,功能各异,这样就给建立一个理想而又通用的蛋白质定量分析的方法代来了许多具体的困难。
目前测定蛋白质含量的方法有很多种,下面列出根据蛋白质不同性质建立的一些蛋白质测定方法:物理性质:紫外分光光度法化学性质:凯氏定氮法、双缩脲法、Lowry 法,BCA 法,胶体金法染色性质:考马氏亮蓝染色法、银染法其他性质:荧光法蛋白质测定的方法很多,但每种方法都有其特点和局限性,因而需要在了解各种方法的基础上根据不同情况选用恰当的方法,以满足不同的要求。
例如凯氏定氮法结果最精确,但操作复杂,用于大批量样品的测试则不太合格;双缩脲法操作简单,线性关系好,但灵敏度差,样品需要量大,测量范围窄,因此在科研上的应用受到限制;而酚试剂法弥补了它的缺点,因而在科研中被广泛采用,但是它的干扰因素多;考马氏亮兰染色法因其灵敏而又简便开始重新受到关注;BCA 法又以其试剂稳定,抗干扰能力较强,结果稳定,灵敏度高而受到欢迎;胶体金法具有较高的灵敏度,可达到毫微克水平,用于微量蛋白的测定。
常用的测定蛋白质含量方法的比较测定范围(μ 不同种类最大吸收波方法特点g/ml)蛋白的差异长nm 标准方法,准确,操作麻烦,费时,凯氏定氮法小灵敏度低,适用于标准的测定紫外分光光灵敏,快速,不消耗样品,核酸类物100—1000 大280205 度法质有影响重复性、线性关系好,灵敏度低,测双缩脲法1000—10000 小540 定范围窄,样品需要量大Folin-酚试20—500 大750 灵敏,费时较长,干扰物质多剂法考马氏亮蓝灵敏度高,稳定,误差较大,颜色会50—500 大595 G-250 转移灵敏度高,稳定,干扰因素少,费时BCA 50—500 大562 较长由于凯氏定氮法的操作作过于复杂,双缩脲法的灵敏度又太低,下面介绍Folin—酚试剂法,考马氏亮蓝G—250 染色法,紫外分光光度法、胶体金法等几种最常用使用的方法。