第十五章硝基化合物和胺
- 格式:doc
- 大小:835.63 KB
- 文档页数:15





(一) 硝基化合物15.1硝基化合物的分类、结构和命名硝基化合物是指分子中含有硝基(-NO2)的化合物,可以看作是烃分子中的氢原子被硝基取代后得到的化合物,常用RNO2或ArNO2表示。
1..分类⑴根据烃基不同可分为:脂肪族硝基化合物R—NO2和芳香族硝基化合物ArNO2⑵根据硝基的数目可分为:一硝基化合物和多硝基化合物。
⑶根据C原子不同可分为:可分为伯、仲、叔硝基化合物。
2.结构通式:R—NO2 或ArNO2硝基是一个强吸电子基团,因此硝基化合物都有较高的偶极矩。
通过键长的测定发现,硝基中的氮原子和两个氧原子之间的距离相同。
根据杂化轨道理论,硝基中的氮原子是sp2杂化的,它以三个sp2杂化轨道与两个氧原子和一个碳原子形成三个共平面的σ键,未参于杂化的一对p电子所在的p轨道与每个氧原子的一个p轨道形成一个共轭π键体系。
CH3NO2:偶极矩为3.4D;键长均为0.121nm3.命名卤代烃相似,通常硝基作为取代基。
CH3NO硝基甲烷 2-硝基丙烷对硝基苯甲酸2,4,6-三硝基苯酚(苦味酸) 2,4,6-三硝基甲苯(T N T) 1,3,5-三硝基苯(T N B)15.2制备R-R-+或R NO-+R NOO -+CH3CHCH3NO2HOOC NO2OHO2NNO2NO2CH3O2NNO2NO2O2NNO2NO21.烃类直接硝化 ①芳烃硝化②脂肪族硝基化合物2.卤代烷硝基取代15.3物理性质1..硝基是一个强极性基,硝基化合物的偶极矩较大。
2..沸点比相应的卤代烃高。
3.多硝基化合物具有爆炸性。
4.液体硝基化合物是良好的有机溶剂。
5.有毒。
6.比重大于1。
15.4化学性质15.4.1酸性脂肪族硝基化合物中,硝基的α碳原子上有氢原子时,能产生互变异构现象。
CH 2N OH R R O硝基式 酸式酸式含量较低,平衡主要偏向硝基式一方。
加碱可使平衡向右移动,使全部转变为酸式的盐而溶解。
例如:CH 3CH 2CH 3CH 3CH 2CH 2NO 23CH 2NO 23NO 2CH 3CHCH 3NO 2R —X AgNO 2R-NO 2+R-ONO 或 NaNO 2硝基化合物亚硝酸酯O - O —X 尿素DMF N O - OR +X -H 2O N —N O OR +X -在不同的溶剂中可得到不同的主产物N O 2H 2SO 4HNOCH 2NO 2OHNaOHHClCH = NO Na +-15.4.2还原反应硝基容易被还原,尤其是直接连在芳环上的硝基,还原产物随还原介质的不同而有所不同。
第十五章 硝基化合物及胺学习要求1.握硝基化合物及胺的分类、命名法和结构。
2.掌握胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。
3.掌握硝基化合物的性质。
4.理解三种分子重排反应的实例。
5. 了解腈和异腈的性质。
6.了解硝基化合物的性质、制法以及重要代表物。
7.了解硝基化合物及胺的制法。
8.了解相转移原理作为有机合成新方法的原因。
9. 了解表面活性剂。
计划课时数 4课时重点:胺的化学性质:碱性(结构和溶剂化效应),胺的鉴别,季铵盐的性质及霍夫曼规则。
难点:分子重排反应教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
引言:分子中含有C-N 键的有机化合物称为含氮有机化合物。
含氮有机化合物种类很多,本章简单讨论硝基化合物,重点讨论胺、重氮盐和分子重排反应。
硝基化合物硝基化合物一般写为R-NO 2 ,Ar-NO 2 ,不能写成R-ONO (R-ONO 表示硝酸酯)。
§15.1 硝基化合物分类、命名、结构1. 分类 (略)2. 命名 (与卤代烃相次似)硝基乙烷对硝基甲苯3. 硝基的结构 一般表示为(由一个N=O 和一个N →O 配位键组成)物理测试表明,两个N —O 键键长相等,这说明硝基为一P-π共轭体系(N 原子是以sp2杂化成键的,其结构表示如下:共振结构式:NOOR氮带一个正电荷,每个氧各带½负电荷,这与硝基化合物高的偶极矩相联系。
根据R的不同,偶极矩在3.5D和4.0D之间,由于硝基化合物的偶极特征,结果比相同分子量的酮沸点高(挥发慢)。
如硝基甲烷(MW61)沸点101℃,丙酮(MW58)沸点56℃。
意外地,在水中溶解度低,在水中硝基甲烷的饱和溶液,以重量计少于10%,而丙酮完全溶于水。
§15.2硝基化合物的制备1.烷烃的硝化:烷烃可与硝酸进行气相或液相硝化,生成硝基烷烃。
其中以气相硝化更具有工业生产价值.烷烃的硝化是以游离基历程进行的:烷烃的碳骼对硝化速度具有一定的影响,活性次序为:叔C-H > 仲C-H > 伯C-H 。
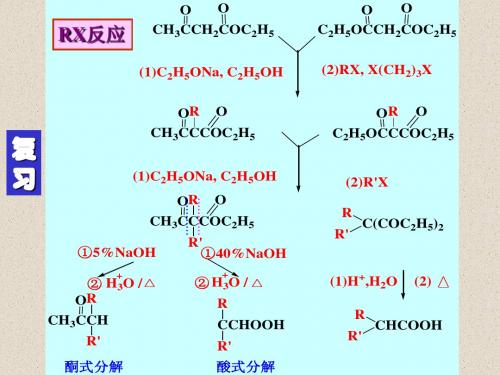
第十五章 硝基化合物和胺一、命名下列化合物:1.CH 3CH 2CHCH(CH 3)2NO 22.CH 3CH 2CH 2NH 23.CH 3NHCH(CH 3)24.NHC 2H 5CH 3H 2N NHC 6H 56.7.C 6H 5SO 2NHC 6H 58.BrN +(CH 3)3Cl -(CH 3)2CHN +(CH 3)3Cl -9.(CH 3)2NNO10.CH 2=CHCNN.N -二甲基-4-亚硝基苯胺 丙烯腈 二、写出下列化合物的构造式:1, 间硝基乙酰苯胺 2,甲胺硫酸盐 3,N -甲基-N -乙基苯胺NO 2NHCOCH 3[CH 3NH 2]2.H 2SO 4NCH 3CH 3CH 24,对甲基苄胺 5, 1,6-己二胺 6,异氰基甲烷CH 2NH 2CH 3NH 2CH 2CH 2CH 2CH 2CH 2CH 2NH 2CH 3NC7,β-萘胺 8,异氰酸苯酯NH 2NCO三、用化学方法区别下列各组化合物: 12、邻甲苯胺 N -甲基苯胺 N,N -二甲基苯胺解:分别与亚硝酸钠+盐酸在低温反应,邻甲苯胺 反应产物溶解, N -甲基苯胺生成黄色油状物,N,N -二甲基苯胺生成绿色固体。
3,乙胺和乙酰胺解:乙胺溶于盐酸,乙酰胺不溶。
4,环己烷与苯胺。
解:苯胺溶于盐酸,环己烷不溶。
四、试用化学方法分离下列化合物:1.CH 3(CH 2)3NO 2(CH 3)3CNO 2CH 3CH 2CH 2NH 2NaOHaq CH 3(CH 2)3NO 2(CH 3)3CNO 2CH 3CH 2CH 2HClCH 3CH 2CH 2NH 2.HClNaOHaqCH 3CH 2CH 2NH 22,苯酚,苯胺和对氨基苯甲酸解:用氢氧化钠水溶液处理,苯酚和对氨基苯甲酸溶于碱溶液,分出有机相。
有机相为含苯胺。
向水相通入二氧化碳,游离出苯酚,对氨基苯甲酸在水相中,酸化得到对氨基苯甲酸。
3,正己醇,2-己酮,三乙胺和正己胺解:加入亚硫酸氢钠饱和水溶液,2-己酮生成晶体分出,然后用稀酸处理这个晶体又得到2-己酮。
·· 162第十四章 含氮有机化合物学习要求:1、掌握芳香族硝基化合物的制法,性质。
理解硝基对苯环邻对位取代基(X 、OH )性质的影响。
2、掌握胺的分类、命名和制法。
3、熟练掌握胺的性质及胺的碱性强弱次序,理解影响胺的碱性强弱的因素。
4、掌握区别伯、仲、叔胺的方法及氨基保护在有机合成中的应用。
5、掌握重氮盐的反应和偶联反应在有机合成中的应用。
6、了解季铵盐、季铵碱的性质和应用,初步了解偶氮染料。
7、学习、掌握重要的分子重排反应。
分子中含有C-N 键的有机化合物称为含氮有机化合物。
含氮有机化合物种类很多,本章简单讨论硝基化合物,重点讨论胺、重氮盐和分子重排反应。
§14-1 硝基化合物硝基化合物一般写为R-NO 2 ,Ar-NO 2 ,不能写成R-ONO (R-ONO 表示硝酸酯)。
一、分类、命名、结构1、分类 (略)2、命名 (与卤代烃相次似)3、硝基的结构一般表示为 (由一个N=O 和一个N →O 配位键组成)物理测试表明,两个N —O 键键长相等,这说明硝基为一P-π共轭体系(N 原子是以sp2杂化成键的,其结构表示如下:二、硝基化合物的制备 见P 430。
1、卤代烃与亚硝酸盐反应。
2、芳烃的硝化。
三、硝基化合物的性质1、物理性质 (略)2、脂肪族硝基化合物的化学性质1)还原 硝基化合物可在酸性还原系统中(Fe 、Zn 、Sn 和盐酸)或催化氢化为胺。
2)酸性硝基为强吸电子基,能活泼α- H ,所以有α- H 的硝基化合物能产生假酸式-酸式互变异构,从而具有一定的酸性。
例如硝基甲烷、硝基乙烷、硝基丙烷的pKa 值分别为:10.2、8.5、7.8 。
N OR R CH 2N O O R CH N OH O NaOH R CH N O O Na 假酸式酸式(主)(较少)实用标准文案精彩文档3)与羰基化合物缩合有α- H 的硝基化合物在碱性条件下能与某些羰基化合物起缩合反应。
其缩合过程是:硝基烷在碱的作用下脱去α- H 形成碳负离子,碳负离子再与羰基化合物发生缩合反应。
4)与亚硝酸的反应第三硝基烷与亚硝酸不起反应。
此性质可用于区别三类硝基化合物。
3、芳香族硝基化合物的化学性质1)还原反应硝基苯在酸性条件下用Zn 或Fe 为还原剂还原,其最终产物是伯胺。
若选用适当的还原剂,可使硝基苯还原成各种不同的中间还原产物,这些中间产物又在一定的条件下互相转化。
见P 4322)硝基对苯环上其它基团的影响硝基同苯环相连后,对苯环呈现出强的吸电子诱导效应和吸电子共轭效应,使苯环上的电子云密度大为降低,亲电取代反应变得困难,但硝基可使邻位基团的反应活性(亲核取代)增加。
(1)使卤苯易水解、氨解、烷基化例如:卤素直接连接在苯环上很难被氨基、烷氧基取代,当苯环上有硝基存在时,则卤代苯的氨化、烷基化在没有催化剂条件下即可发生。
P 433R CH 2NO 2R'C O H (R'' )+OH R'C OH H (R'' )C NO 2R'H R'C H (R'' )C NO 2R'R CH 2NO 2+ HONO CH NO 2NO R C NO 2NO Na R 2CH NO 2+ HONO R 2C NO 2NO 蓝色结晶溶于呈红色溶液蓝色结晶NaOH NaOH 蓝色不变NO 2NH 2℃Cl OH 400 32MPa Cl NO 23130℃ONa NO 2OH NO 2Cl NO 2NO 23100℃ONa NO 2NO 2OH NO 2NO 2·· 164(2)使酚的酸性增强§14-2 胺一、胺的分类和命名1、分类2、命名 (P 434~435)简单胺的命名是在烃基名称后加胺字,称为某胺。
复杂结构的胺是将氨基和烷基作为取代基来命名。
季铵盐或季铵碱的命名是将其看作铵的衍生物来命名。
二、胺的物理性质和光谱性质 (略)三、胺的结构胺分子中,N 原子是以不等性sp 3杂化成键的,其构型呈棱锥形。
故N 原子上连有四个不同基团的化合物存在着对映体,可以分离出左旋体和右旋体。
四、 胺的化学性质1、碱性胺和氨相似,具有碱性,能与大多数酸作用成盐。
胺的碱性较弱,其盐与氢氧化钠溶液作用时,释放出游离胺。
胺的碱性强弱,可用K b 或pK b 表示:碱性: 脂肪胺 > 氨 > 芳香胺pK b < 4.70 4.75 >8.40 见P 440表14-2脂肪胺 在气态时碱性为: (CH 3)3N > (CH 3)2NH > CH 3NH 2 > NH 3OHOH OH 2NO 2NO 2OH NO 2NO 2O 2N pK a 9.897.150.384.09R NH 2R 2NH R 3N R 4R 4ArNR 2ArNH 2Ar 2NH ArNHR 芳胺伯胺( 胺)仲胺叔胺°123°°( 胺)( 胺)脂肪胺季铵盐季铵碱H 33R NH 2+ HCl R NH 3Cl R NH 2+ HOSO 3H R NH 3 OSO 3H R NH 3Cl + NaOH RNH 2 + Cl + H 2O R NH 2+ H 2O R NH 3 + OH K b K b =R NH 3 OH RNH 2pK b = logK b实用标准文案精彩文档在水溶液中碱性为: (CH 3)2NH > CH 3NH 2 > (CH 3)3N > NH 3原因:气态时,仅有烷基的供电子效应,烷基越多,供电子效应越大,故碱性次序如上。
在水溶液中,碱性的强弱决定于电子效应、溶剂化效应等。
溶剂化效应——铵正离子与水的溶剂化作用(胺的氮原子上的氢与水形成氢键的作用)。
胺的氮原子上的氢越多,溶剂化作用越大,铵正离子越稳定,胺的碱性越强。
芳胺的碱性 ArNH 2 > Ar 2NH > Ar 3N例如: NH 3 PhNH 2 (Ph)2NH (Ph)3NpK b 4.75 9.38 13.21 中性对取代芳胺,苯环上连供电子基时,碱性略有增强;连有吸电子基时,碱性则降低。
2、酸性 (略)3、烃基化反应 (P 441)胺作为亲核试剂与卤代烃发生取代反应,生成仲胺、叔胺和季铵盐。
此反应可用于工业上生产胺类。
但往往得到的是混合物。
4、酰基化反应和磺酰化反应1)酰基化反应 伯胺、仲胺易与酰氯或酸酐等酰基化剂作用生成酰胺。
酰胺是具有一定熔点的固体,在强酸或强碱的水溶液中加热易水解生成酰胺。
因此,此反应在有机合成上常用来保护氨基。
(先把芳胺酰化,把氨基保护起来,再进行其他反应,然后使酰胺水解再变为胺)。
2)磺酰化反应(兴斯堡——Hinsberg 反应)胺与磺酰化试剂反应生成磺酰胺的反应叫做磺酰化反应。
常用的磺酰化试剂是苯磺酰氯和对甲基苯磺酰氯R N H H H R 2N H H R 3N H O H H OH 2OH 2OH 2OH 2OH2RNH 22RNHCOR'(Ar)R 2NH R'COCl R 2NCOR'NHCH 3CH 3COCl NCOCH 3CH 3R 3N R'COCl 2(Ar)3N SO 2Cl SO 2Cl CH 3苯磺酰氯对甲基苯磺酰氯( TsCl )RNH 2R 2NH R 3N SO 2NHR SO 2NR 2白色固体无反应不溶于碱,仍为固体溶于碱白色固体NaOH NaOH SO 2N-R Na·· 166兴斯堡反应可用于鉴别、分离纯化伯、仲、叔胺。
5、与亚硝酸反应亚硝酸(HNO 2 )不稳定, 反应时由亚硝酸钠与盐酸或硫酸作用而得。
脂肪胺与HNO 2的反应伯胺与亚硝酸的反应:生成的碳正离子可以发生各种不同的反应生成烯烃、醇和卤代烃。
(P 443 )例如:所以,伯胺与亚硝酸的反应在有机合成上用途不大。
仲胺与HNO 2反应,生成黄色油状或固体的N-亚硝基化合物。
叔胺在同样条件下,与HNO 2不发生类似的反应。
因而,胺与亚硝酸的反应可以区别伯、仲、叔胺。
芳胺与亚硝酸的反应:此反应称为重氮化反应。
芳香族仲胺与亚硝酸反应,生成棕色油状和黄色固体的亚硝基胺。
P 443。
芳香族叔胺与亚硝酸反应,亚硝基上到苯环,生成对亚硝基胺。
P 443。
芳胺与亚硝酸的反应也可用来区别芳香族伯、仲、叔胺。
6、氧化反应胺容易氧化,用不同的氧化剂可以得到不同的氧化产物。
叔胺的氧化最有意义。
具有β-氢的氧化叔胺加热时发生消除反应,产生烯烃。
RNH 2R 2NH R 3N 2NHR 2NR 2馏液(叔胺)余物沉淀HClRCH 2CH 2NH 2NaNO 2 + HCl RCH 2CH 2N 2Cl RCH 2CH 2 + N 2 + Cl 低温重氮盐CH 2NH 22OH CH 3OH 33++++R R NH NaNO 2 + HCl R R N-N=O N-亚硝基胺(黄色油状物)H 2O+NaNO 2 + HCl 2H 2O + NaCl NH 2N 2 Cl 0 5℃氯化重氮苯(重氮盐)不稳定(故要在低温下反应)OH H CH 2N(CH 3)222H CH 2N(CH 3)2O N,N N 二甲基环己基甲胺 氧化物实用标准文案精彩文档此反应称为科普(Cope )消除反应。
科普(Cope )消除反应是一种立体选择性很高的顺式(同侧)消除反应。
反应是通过形成平面五元环的过程完成的。
例如:7、芳胺的特性反应1)氧化反应 芳胺很容易氧化,例如,新的纯苯胺是无色的,但暴露在空气中很快就变成黄色然后变成红棕色。
用氧化剂处理苯胺时,生成复杂的混合物。
在一定的条件下,苯胺的氧化产物主要是对苯醌。
2)卤代反应苯胺很容易发生卤代反应,但难控制在一元阶段。
如要制取一溴苯胺,则应先降低苯胺的活性,再进行溴代,其方法有两种。
方法一: >90%方法二:3)磺化反应H CH 2N(CH 3)2O 160℃CH 2+ (CH 3)2OH98%3)2O 160℃CH2115℃3)23H C 6H C C CH 3H H 3C C 6H 5C C H CH 3H 3C C 6H 5+96%0.1%22410℃O O NH 2苯胺黑NH 2+ Br 2(H 2O)NH 2Br Br Br + 3HBr ,2,4,6-可用于鉴别苯胺NH 2 Br 2NHCOCH 3Br (CH 3CO)2NHCOCH 3CH 3COOH NH 2Br干NH 2NH 3HSO 4NH 3HSO 4NH 2H SO Br 2BrBr NH 2NHSO 3H NH 3HSO NH 2H SO 2180℃SO 3H NH 3SO 2O·· 168对氨基苯磺酸形成内盐。