考马斯亮蓝法测蛋白质
- 格式:docx
- 大小:38.83 KB
- 文档页数:4

考马斯亮蓝法测定蛋白质1976年Bradford建立了用考马斯亮蓝G250与蛋白质结合的原理,迅速、敏感的定量测定蛋白质的方法。
实验原理:考马斯亮蓝法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。
考马斯亮蓝G―250存在着两种不同的颜色形式,红色和蓝色。
它和蛋白质通过范德华力结合,在一定蛋白质浓度范围内,蛋白质和染料结合符合比尔定律(Beer’s law)。
此染料与蛋白质结合后颜色有红色形式和蓝色形式,最大光吸收由465nm变成595nm,通过测定595nm处光吸收的增加量可知与其结合蛋白质的量。
蛋白质和染料结合是一个很快的过程,约2min即可反应完全,呈现最大光吸收,并可稳定1h,之后,蛋白质―染料复合物发生聚合并沉淀出来。
蛋白质―染料复合物具有很高的消光系数,使得在测定蛋白质浓度时灵敏度很高,在测定溶液中含蛋白质5µL/ml 时就有0.275光吸收值的变化,比Lowry法灵敏4倍,比紫外吸收法灵敏10~20倍。
测定范围为10-100µg蛋白质,微量测定法测定范围是1-10µg蛋白质。
此反应重复性好,精确度高,线性关系好。
标准曲线在蛋白质浓度较大时稍有弯曲,这是由于染料本身的两种颜色形式光谱有重叠,试剂背景值随更多染料与蛋白质结合而不断降低,但直线弯曲程度很轻,不影响测定。
此方法干扰物少,研究表明:NaCl,KCl,MgCl2,乙醇,(NH4)2SO4无干扰。
强碱缓冲液在测定中有一些颜色干扰,这可以用适当的缓冲液对照扣除其影响。
Tris,乙酸,2―巯基乙醇,蔗糖,甘油,EDTA及微量的去污剂如Triton X―100,SDS,玻璃去污剂有少量颜色干扰,用适当的缓冲液对照很容易除掉。
但是,大量去污剂的存在对颜色影响太大而不易消除。
试剂与器材考马斯亮蓝试剂:考马斯亮蓝G―250 100mg溶于50ml95%乙醇中,加入100ml85%磷酸,用蒸馏水稀释至1000ml,滤纸过滤。



蛋白质含量测定法——考马斯亮蓝法[实验目的]学习、掌握考马斯亮蓝法(Bradford 法)测定蛋白质含量的方法[实验原理](蓝色)变为氨基酸芳香族碱性染料考马斯亮蓝磷酸nm G 595250max λ−−→−+-[器材与试剂]器材722型可见光分光光度计、漩涡混合器、试管16支 试剂1.标准蛋白质溶液,用牛血清清蛋白(BSA ),配制成1.00mg/ml 。
2.考马斯亮蓝G-250染料试剂:称100mg 考马斯亮蓝,溶于50ml 95%的乙醇后,再加入120ml 85% 的磷酸,用水稀释至1升。
[实验方法]标准方法1.取10支试管,分别编号后按 表1 剂量依次加入标准蛋白(或未知蛋白)、去离子水和考马斯亮蓝染料。
每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用722分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
3.用标准蛋白浓度(mg/ml )为横坐标,用A 595为纵坐标,进行直线拟合,得到标准曲线。
根据测得的未知样品的A 595,代入公式即可求得未知样品的蛋白质含量。
根据所测样品的吸光度,在标准曲线上查得相应的蛋白质含量,按下式计算: 样品蛋白质含量(μg/g 鲜重) =)测定时提取液体积()样品重()提取液总体积()查得的蛋白质(ml g ml g g ⨯⨯/μSDS 干扰实验1.取5支试管,分别编号后按表2剂量依次加入标准蛋白、SDS 、去离子水和考马斯亮蓝染料。
每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用753分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
[实验数据与结果分析](一)标准方法的数据和图表1 考马斯亮蓝标准法实验表格根据表1,以A595为纵坐标,标准蛋白质量/(μg)为横坐标,作图1。
图1 考马斯亮蓝标准法根据线性拟合公式y=a x+b计算所测溶液的蛋白质的含量。
(二)SDS干扰数据和图表2 考马斯亮蓝SDS干扰实验表格根据表2,以A595为纵坐标,SDS浓度为横坐标,作图2。

蛋白质含量测定法——考马斯亮蓝法[实验目的]学习、掌握考马斯亮蓝法(Bradford 法)测定蛋白质含量的方法[实验原理](蓝色)变为氨基酸芳香族碱性染料考马斯亮蓝磷酸nm G 595250m ax λ−−→−+-[器材与试剂]器材722型可见光分光光度计、漩涡混合器、试管16支 试剂1.标准蛋白质溶液,用牛血清清蛋白(BSA ),配制成1.00mg/ml 。
2.考马斯亮蓝G-250染料试剂:称100mg 考马斯亮蓝,溶于50ml 95%的乙醇后,再加入120ml 85% 的磷酸,用水稀释至1升。
[实验方法]标准方法1.取10支试管,分别编号后按 表1 剂量依次加入标准蛋白(或未知蛋白)、去离子水和考马斯亮蓝染料。
每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用722分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
3.用标准蛋白浓度(mg/ml )为横坐标,用A 595为纵坐标,进行直线拟合,得到标准曲线。
根据测得的未知样品的A 595,代入公式即可求得未知样品的蛋白质含量。
根据所测样品的吸光度,在标准曲线上查得相应的蛋白质含量,按下式计算: 样品蛋白质含量(μg/g 鲜重)=)测定时提取液体积()样品重()提取液总体积()查得的蛋白质(ml g ml g g ⨯⨯/μ以蛋白标准溶液浓度为横坐标,以吸光度为纵坐标,绘制标准曲线。
计算出回归方程。
如Y=aX+b让后把待测样品的吸光值代入回归方程,算出待测样品浓度 SDS 干扰实验1.取5支试管,分别编号后按表2剂量依次加入标准蛋白、SDS 、去离子水和考马斯亮蓝染料。
每支试管加完后,立即在漩涡混合器上混合。
2.加完染料20min 后,使用753分光光度计,塑料比色皿,在595nm 处测量吸光度A 595。
[实验数据与结果分析](一)标准方法的数据和图表1 考马斯亮蓝标准法实验表格根据表1,以A595为纵坐标,标准蛋白质量/(μg)为横坐标,作图1。

实验八考马斯亮蓝G-250法测定蛋白质含量一实验目的学会用考马斯亮蓝G-250法测定蛋白质含量二实验原理考马斯亮蓝能与蛋白质的疏水微区结合,这种结合具有高度的敏感性。
考马斯亮蓝G-250的磷酸溶液呈棕红色,最大吸收峰在465nm当它与蛋白质结合形成复合物时呈蓝色其最大吸收峰改为595nm,考马斯亮蓝G-250-复合物的高消光效应导致了蛋白质定量测定的高敏感度。
在一定范围内,考马斯亮蓝G-250-复合物呈色后,在595nm下吸光度与蛋白质含量呈线性关系,故可以用于蛋白质浓度的测定。
三实验器材(1)旋涡混合器。
(2)试管1.5cm×15cm(×8)(3)吸管0.10ml(×1),0.50ml(×2),1.0ml(×2),2.0ml(×1),2.0ml(×1)。
(4)722型(或7220型)分光光度计。
(5)容量瓶1000ml(×1)。
(6)量筒100ml(×1)。
(7)电子分析天平。
四实验试剂1、9%NaCL溶液。
2、标准蛋白液;牛血清白蛋白(0.1mg/ml),准备称取牛血清白蛋白0.2g,用0.9%NaCl 溶液溶解并稀释至2000ml。
3、染液:考马斯亮蓝G250(0.01%),称取0.1g考马斯亮蓝G250溶于50ml95%乙醇中,再加入100ml浓磷酸,后加蒸馏水定容到1000ml。
4、样品液:取牛血清白蛋白(0.1mg/ml)溶液,用0.9%NaCl稀释至一定浓度。
五实验方法(一)标准曲线的制备1、取7支干净试管,按表15进行编号并加入试剂。
2、混匀,室温静置3min,以第1管为空白,于波长595nm处比色,读取吸光度,以吸光度为纵坐标,名标准液浓度(ug/ml)作为横坐标作图得标准曲线。
表15 考马斯亮蓝法测定蛋白质浓度——标准曲线的制备(二)样品的测定另取一支干净试管,加入样品液1.0ml及考马斯亮蓝染液4.0ml,混匀,室温静置3min,于波长595nm处比色,读取吸光度,由样品液的吸光度查标准曲线即可求出含量。

考马斯亮蓝法测定蛋白质含量1. 前言嘿,朋友们,今天咱们聊聊一个有趣的话题——考马斯亮蓝法,听起来挺高大上的吧?其实这玩意儿就是用来测定蛋白质含量的,简单来说,就是看看你的食物里到底有多少“肌肉”的成分。
想象一下,咱们吃的肉、蛋、豆腐,都是富含蛋白质的食物,咱们用这个方法可以精确地知道它们含有多少蛋白质,绝对是个好玩的实验,来吧,跟我一起揭开它的神秘面纱。
2. 什么是考马斯亮蓝法?2.1 简单介绍首先,咱们来聊聊什么是考马斯亮蓝法。
它其实是一种颜色变化的实验,听起来是不是有点像魔法?你只要把样品(比如说一小块肉或者一勺蛋白质粉)放在试管里,加点特殊的染料,这染料就叫考马斯亮蓝,之后再加点酸溶液,哇,你会发现颜色发生了变化。
更厉害的是,颜色的深浅就能告诉你蛋白质的含量,简直像变魔术一样!这就是为什么它受到许多科学家和实验室的青睐。
2.2 原理揭秘那么,这个颜色变化的背后,究竟有什么科学原理呢?嘿,别着急,听我慢慢说。
考马斯亮蓝这种染料会和蛋白质中的氨基酸发生反应,形成一种稳定的复合物。
这就像是小伙伴们在一起聚会,越多人参加,气氛就越热烈。
随着蛋白质的浓度增加,复合物的数量也就随之增加,所以颜色也会越来越深。
只要用仪器测量一下颜色的深度,咱们就能算出蛋白质的含量,真是既简单又方便。
3. 实验步骤3.1 准备工作想要在家里试一试这个方法,当然得先做好准备。
首先,你得准备好一些材料:考马斯亮蓝染料、酸性溶液(一般用盐酸就可以)、待测样品(不妨试试豆腐或者鸡肉),还有一些基本的实验器材,比如试管、比色皿、量筒等。
别小看这些东西,有时候实验的成功与否就看这些小玩意儿了。
3.2 操作步骤接下来,就是真正的实验时刻了!首先,咱们把待测样品处理一下,比如切成小块,然后用水萃取出蛋白质。
接着,把提取液倒入试管,加入考马斯亮蓝染料,搅拌均匀。
再倒入酸性溶液,注意,这里要控制好比例,不然可就要出乱子了。
然后,静置几分钟,让颜色充分反应。

考马斯亮蓝法测蛋白质含量原理
方法原理:
考马斯亮蓝法是一种常用于测定蛋白质含量的光谱分析方法。
该方法基于蛋白质与考马斯亮蓝之间的物理化学相互作用,通过分析其吸光度变化来确定蛋白质的含量。
具体而言,考马斯亮蓝与蛋白质中的氨基酸残基(主要是赖氨酸、组氨酸和色氨酸)发生强烈的静电相互作用。
在酸性条件下,考马斯亮蓝将以阳离子形式结合到蛋白质上,从而使溶液中的考马斯亮蓝吸光度发生变化。
利用该吸光度变化,可以根据标准曲线或计算公式来确定蛋白质的含量。
具体操作上,首先将待测溶液中的蛋白质与酸性的考马斯亮蓝溶液充分混合,在一定的反应时间后,将反应溶液进行离心或过滤,使蛋白质沉淀下来。
然后,用适当的溶液洗涤蛋白质沉淀,以去除杂质。
最后,将洗涤后的蛋白质沉淀重溶并进行吸光度测定。
通过测定吸光度,并利用事先确定的标准曲线或计算公式,可以计算出待测溶液中蛋白质的含量。
考马斯亮蓝法相对简便、快速且具有较高的准确度,广泛应用于生物化学和生物技术等领域的蛋白质测定中。
注意,以上文中没有标题相同的文字。

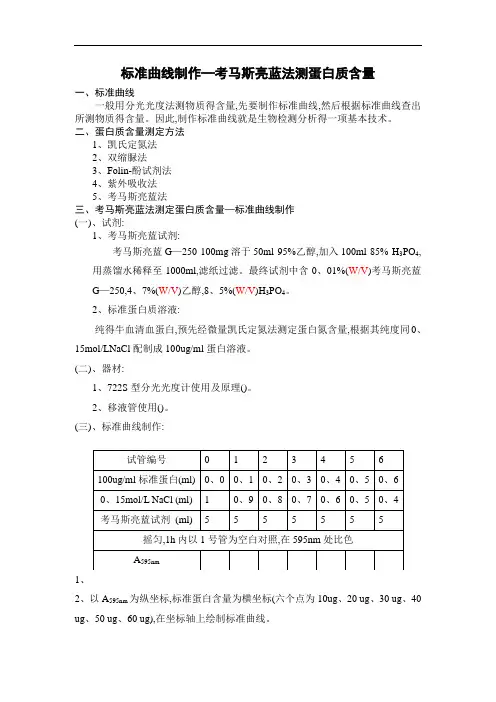
标准曲线制作—考马斯亮蓝法测蛋白质含量欧阳学文一、标准曲线一般用分光光度法测物质的含量,先要制作标准曲线,然后根据标准曲线查出所测物质的含量。
因此,制作标准曲线是生物检测分析的一项基本技术。
二、蛋白质含量测定方法1、凯氏定氮法2、双缩脲法3、Folin酚试剂法4、紫外吸收法5、考马斯亮蓝法三、考马斯亮蓝法测定蛋白质含量—标准曲线制作(一)、试剂:1、考马斯亮蓝试剂:考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% H3PO4,用蒸馏水稀释至1000ml,滤纸过滤。
最终试剂中含0.01%(W/V)考马斯亮蓝G—250,4.7%(W/V)乙醇,8.5%(W/V)H3PO4。
2、标准蛋白质溶液:纯的牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0.15mol/LNaCl配制成100ug/ml蛋白溶液。
(二)、器材:1、722S型分光光度计使用及原理()。
2、移液管使用()。
(三)、标准曲线制作:1、A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。
1)、利用标准曲线查出回归方程。
2)、用公式计算回归方程。
3)、或用origin作图,测出回归线性方程。
即A595nm=a×X( )+6一般相关系数应过0.999以上,至少2个9以上。
4)、绘图时近两使点在一条直线上,在直线上的点应该在直线两侧。
(四)、蛋白质含量的测定:样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品的A595nm,然后利用标准曲线或回归方程求出样品蛋白质含量。
一般被测样品的A595nm值在0.1—0.05之间,所以上述样品如果A595nm值太大,可以稀释后再测A595nm值,然后再计算。
(五)、注意事项:1、玻璃仪器要洗涤干净。
2、取量要准确。
3、玻璃仪器要干燥,避免温度变化。
标准曲线制作—考马斯亮蓝法测蛋白质含量一、标准曲线一般用分光光度法测物质得含量,先要制作标准曲线,然后根据标准曲线查出所测物质得含量。
因此,制作标准曲线就是生物检测分析得一项基本技术。
二、蛋白质含量测定方法1、凯氏定氮法2、双缩脲法3、Folin-酚试剂法4、紫外吸收法5、考马斯亮蓝法三、考马斯亮蓝法测定蛋白质含量—标准曲线制作(一)、试剂:1、考马斯亮蓝试剂:考马斯亮蓝G—250 100mg溶于50ml 95%乙醇,加入100ml 85% H3PO4,用蒸馏水稀释至1000ml,滤纸过滤。
最终试剂中含0、01%(W/V)考马斯亮蓝G—250,4、7%(W/V)乙醇,8、5%(W/V)H3PO4。
2、标准蛋白质溶液:纯得牛血清血蛋白,预先经微量凯氏定氮法测定蛋白氮含量,根据其纯度同0、15mol/LNaCl配制成100ug/ml蛋白溶液。
(二)、器材:1、722S型分光光度计使用及原理()。
2、移液管使用()。
(三)、标准曲线制作:1、2、以A595nm为纵坐标,标准蛋白含量为横坐标(六个点为10ug、20 ug、30 ug、40 ug、50 ug、60 ug),在坐标轴上绘制标准曲线。
1)、利用标准曲线查出回归方程。
2)、用公式计算回归方程。
3)、或用origin作图,测出回归线性方程。
即A595nm=a×X( )+6一般相关系数应过0、999以上,至少2个9以上。
4)、绘图时近两使点在一条直线上,在直线上得点应该在直线两侧。
(四)、蛋白质含量得测定:样品即所测蛋白质含量样品(含量应处理在所测范围内),依照操作步骤1操作,测出样品得A595nm,然后利用标准曲线或回归方程求出样品蛋白质含量。
一般被测样品得A595nm值在0、1—0、05之间,所以上述样品如果A595nm值太大,可以稀释后再测A595nm值,然后再计算。
(五)、注意事项:1、玻璃仪器要洗涤干净。
2、取量要准确。
3、玻璃仪器要干燥,避免温度变化。
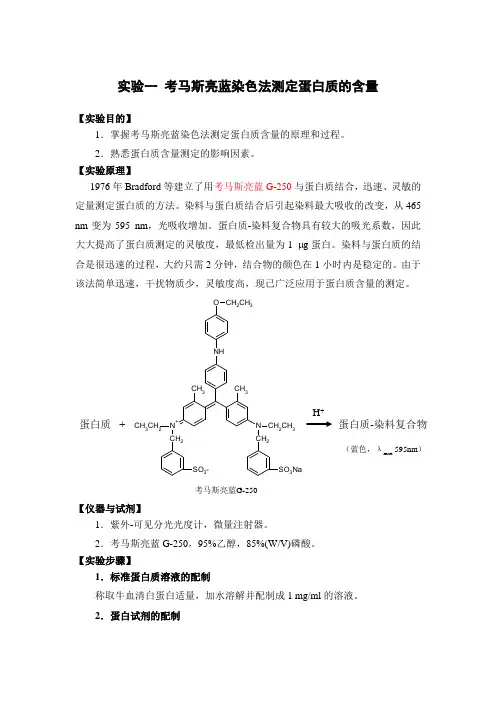
实验一 考马斯亮蓝染色法测定蛋白质的含量【实验目的】1.掌握考马斯亮蓝染色法测定蛋白质含量的原理和过程。
2.熟悉蛋白质含量测定的影响因素。
【实验原理】1976年Bradford 等建立了用考马斯亮蓝G-250与蛋白质结合,迅速、灵敏的定量测定蛋白质的方法。
染料与蛋白质结合后引起染料最大吸收的改变,从465 nm 变为595 nm ,光吸收增加。
蛋白质-染料复合物具有较大的吸光系数,因此大大提高了蛋白质测定的灵敏度,最低检出量为1 g 蛋白。
染料与蛋白质的结合是很迅速的过程,大约只需2分钟,结合物的颜色在1小时内是稳定的。
由于该法简单迅速,干扰物质少,灵敏度高,现已广泛应用于蛋白质含量的测定。
N CH 2CH 3CH 2N +CH 3CH 2CH 2NHCH 3CH 3O CH 2CH 3SO 3-SO 3Na蛋白质+ 蛋白质-染料复合物H +考马斯亮蓝G-250(蓝色,λmax595nm )【仪器与试剂】1.紫外-可见分光光度计,微量注射器。
2.考马斯亮蓝G-250,95%乙醇,85%(W/V)磷酸。
【实验步骤】1.标准蛋白质溶液的配制称取牛血清白蛋白适量,加水溶解并配制成1 mg/ml 的溶液。
2.蛋白试剂的配制称取100 mg考马斯亮蓝G-250,加入95%乙醇50 ml溶解,再加入85%(W/V)磷酸100 ml,将溶液用水稀释至1000 ml。
试剂的终浓度为0.01%考马斯亮蓝G-250,4.7%乙醇和8.5%(W/V)磷酸。
3.标准曲线的制作取标准蛋白质溶液5、10、20、50、100 μl于小试管中,用水稀释至0.1 ml,然后分别加入5 ml蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。
以0.1 ml水及5 ml蛋白试剂作为空白对照。
以蛋白浓度为横坐标,吸光度值为纵坐标,绘制标准曲线作为定量依据。
4.样品测定取含10~100 μg蛋白质溶液于小试管中,加水稀释至0.1 ml,然后加入5 ml 蛋白试剂,充分振荡混合,2分钟后于595 nm测定其吸光度值。
考马斯亮蓝法测蛋白质含量原理考马斯亮蓝法是一种常用的蛋白质含量测定方法,其原理是利用考马斯亮蓝与蛋白质结合形成蓝色络合物,通过比色测定蛋白质含量。
这种方法具有操作简便、灵敏度高、结果稳定等优点,被广泛应用于蛋白质含量的测定。
首先,将待测样品与考马斯亮蓝溶液充分混合,使蛋白质与考马斯亮蓝发生络合反应。
考马斯亮蓝与蛋白质结合后,形成蓝色络合物,其吸光度与蛋白质的含量成正比。
然后,利用分光光度计测定络合物的吸光度,根据标准曲线或计算公式,可以精确地计算出待测样品中蛋白质的含量。
在进行考马斯亮蓝法测定蛋白质含量时,需要注意一些关键操作。
首先,样品的制备要求精确,必须保证待测样品中蛋白质的完全溶解和混合均匀。
其次,在与考马斯亮蓝溶液混合后,需要充分反应一定时间,以保证蛋白质与考马斯亮蓝充分结合形成稳定的络合物。
最后,在测定吸光度时,应选择合适的波长,并进行零点校正,确保测定结果的准确性。
考马斯亮蓝法测定蛋白质含量的优点之一是操作简便。
相比于其他方法,考马斯亮蓝法无需复杂的仪器和操作步骤,只需常见的实验设备和基本的化学品即可完成测定。
另外,该方法的灵敏度高,可以测定微量的蛋白质,适用于各种类型的样品。
此外,考马斯亮蓝法的结果稳定可靠,具有较高的重复性和准确性,被广泛用于生物化学、分子生物学等领域的蛋白质研究中。
总的来说,考马斯亮蓝法是一种简便、灵敏、稳定的蛋白质含量测定方法,其原理是利用考马斯亮蓝与蛋白质形成络合物,通过比色测定蛋白质含量。
在进行测定时,需要注意样品制备、反应时间和吸光度测定等关键操作,以确保测定结果的准确性和可靠性。
考马斯亮蓝法已成为蛋白质研究中常用的技术手段,为科研工作者提供了重要的实验数据支持。
考马斯亮蓝法测蛋白质含量实验概要bradford法是最常用的蛋白质快速定量方法。
coomassie brilliant blue g-250与蛋白质结合使染料的最大吸收峰由465 nm变为595 nm,溶液的颜色由棕色变为蓝色,595nm波长下吸光度值与蛋白含量成正比。
灵敏度比lowry法高4倍,与bca法相当。
反应迅速,2分钟即可达到平衡并在1小时内保持稳定。
操作简便,只需要一种反应试剂。
实验原理考马斯亮蓝(coomassie brilliant blue)法测定蛋白质浓度,是利用蛋白质―染料结合的原理,定量的测定微量蛋白浓度的快速、灵敏的方法。
这种蛋白质测定法具有超过其他几种方法的突出优点,因而正在得到广泛的应用。
这一方法是目前灵敏度最高的蛋白质测定法。
考马斯亮兰g-250染料,在酸性溶液中与蛋白质结合,使染料的最大吸收峰(lmax)的位置,由465 nm变为 595 nm,溶液的颜色也由棕黑色变为兰色。
通过测定595 nm处光吸收的增加量可知与其结合蛋白质的量。
研究发现,染料主要是与蛋白质中的碱性氨基酸(特别是精氨酸)和芳香族氨基酸残基相结合。
主要试剂考马斯亮蓝g-250染色工作液: 10mg考马斯亮蓝g-250粉末溶于5ml 95%乙醇中,彻底溶解后,加入10ml 85%磷酸中,边加边搅拌(市售液体磷酸(h3po4)的质量分数≥85.0%,稠状透明液体,可直接使用,对皮肤有很强的腐蚀作用,建议使用5ml移液枪缓慢吸取使用)蒸馏水稀释至100ml。
后经滤纸过滤后储存于棕色试剂瓶中,避光保存。
长时间不用,可放置于4℃冰箱中保存1年,再次使用还需过滤,加入反应管前需要升至室温,否则虽不影响精度,但测得的od值较低,对仪器要求较高。
标准牛血清白蛋白(bsa):精确称取4mg bsa粉末,溶于1ml 0.15mol/l nacl溶液配制成4mg/ml标准蛋白溶液,-20℃保存。
(如用1cm比色皿测定,建议精确称取40mg bsa 粉末,溶于10ml 0.15mol/l nacl溶液配制成4mg/ml标准蛋白溶液,分装成小管,-20℃保存。
考马斯亮蓝G-250法测定蛋白质含量专业班级:制药工程3班小组成员:李梦娴李敏林晓丝一、实验目的1、了解考马斯亮蓝法测定蛋白质的原理2、掌握考马斯亮蓝法测定蛋白质含量的操作步骤二、实验原理1、根据蛋白质的理化性质,有多种蛋白质定量方法。
考马斯亮蓝G-250是比色法与色素法相结合的复合方法。
考马斯亮蓝G-250是一种染料,在游离状态下呈棕红色,当与蛋白质结合后呈青蓝色。
在一定范围内,也就是蛋白质含量在0~1000ug范围内,蛋白质-色素结合物在595nm下的吸光度与蛋白质含量成正比,所以可用比色法测定。
2、考马斯亮蓝G-250法有常量法和微量法两种。
三、仪器与试剂1、仪器:分析天平;铁架台;大漏斗;洗瓶;烧杯100m l×2、50m l×1;吸管10ml×2、5ml×1;胶头滴管;移液枪;离心管10个;722型分光光度计;容量瓶100ml×3;洗耳球×2;玻璃棒;记号笔。
2、试剂:〔1〕蒸馏水。
〔2〕标准蛋白质溶液:用移液枪吸取1ml浓度为1mg/ml标准蛋白质溶液,溶于蒸馏水并定容至10ml,制成0.1mg/ml的原液。
〔3〕考马斯亮蓝G-250(0.01%)染液:称取0.01g考马斯亮蓝G-250,溶于5ml 90%乙醇中,加入85%〔m/v)的磷酸10ml,最后用蒸馏水定容至100ml〔此溶液不宜久存,在常温中可放置1~2个月〕;将定容好的染液过滤并装入棕色瓶中保存。
〔4〕样品液:用移液枪取1ml纯牛奶液体〔经调查,市场上大部分纯牛奶中蛋白质的含量大致为每100ml中2.5~3.5g〕,用蒸馏水稍做稀释,然后转移至一号100ml的容量瓶中并定容至100ml;用10ml的吸量管吸取10ml一号容量瓶中的液体于二号100ml的容量瓶中,最后用蒸馏水定容至100ml,此时二号容量瓶中为待测样品液。
四、操作步骤1、0~100μg/ml标准曲线的制作:取8支离心管,编号后,按下表加入试剂,盖塞后,将各试管中的溶液纵向倒转混匀,室温静止5min后,以管一为空白对照,在595nm 下比色测定。
考马斯亮蓝法测蛋白质含量
一、原理
考马斯亮蓝G-25(Coomassie G-250是一种甲基取代的三苯基甲烷,分子中磺酸基的蓝色染料,在 465nm 处有最大吸收值。
考马斯亮蓝 G-250能与蛋白质通过范得华相互作用形成蛋白质一考马斯亮蓝复合物蓝色溶液,引起该染料的最大吸收入max的位置发生红移,在
595nm 处有最大吸收值。
由于蛋白质—考马斯亮蓝复合物在 595nm 处的光吸收远高于考马斯亮蓝在 465nm 处的光吸收,因此,可大大地提高蛋白质的测定灵敏度。
蛋白质—考马斯亮蓝复合物溶液颜色的深浅与蛋白质的浓度成正比。
利用溶液颜色的差异进行比色测定,适合于蛋白质类的定量分析,尤其适合于稀有蛋白质的微量分析。
考马斯亮蓝G-250试剂呈色反应颜色稳定、灵敏度高,最低测试蛋白质量在 1ug 左右。
二、操作步骤
1. 标准曲线测定法
分别取六只试管,其中一只加入 1.0ml蒸馏水做空白,5只分别加入不同体积的浓度为 100ug/ml 牛血清清蛋白标准液,补充水到 1.0ml。
然后每只试管加入5.0ml考马斯亮蓝G-250试剂,摇匀放置5min,在紫外 -可见分光光度计 595nm 处测定吸光值。
以 A595 吸光值为纵坐标,牛血清清蛋白的 ug 数量为横坐标绘制标准曲线。
具体操作见下表。
蛋白质标准曲线测定加样
在标准蛋白质测定时,为了减小误差,每一个浓度的蛋白质做3支平
行管。
3•试剂配置
a. 牛血清清蛋白标准液结晶牛血清清蛋白或酪蛋白,预先经微量凯氏定氮法标定该蛋白质的百分含量或者根据牛血清清蛋白的消光系数
是6.6来计算其百分含量。
然后根据该蛋白的纯度配置成浓度为
100 ug/ml的蛋白溶液。
b. 考马斯亮兰G— 250染料试剂:称100mg考马斯亮兰G—250,溶于
50ml 95%的乙醇后,再加入100ml 85%的磷酸,用水稀释至1升
三、数据及绘图
蛋白质标准區。